大黄酸对糖尿病肾病大鼠足突细胞nephrin基因表达的影响
陈建伟,刘 玲,钟 玲
(重庆医科大学附属第二医院肾内科 400010)
糖尿病肾病(diabetic nephropathy,DN)是2型糖尿病严重的常见微血管并发症,是最终导致终末期肾衰竭的常见原因,也是糖尿病致死的主要原因之一,由于其发病率高,治疗棘手、效果差,危害大而备受关注。而近年来研究发现nephrin基因在足突细胞上的表达下调在肾功能不断恶化中起到重要作用[1]。因此,如何抑制nephrin基因在足突细胞上的下调,在DN的治疗中起到至关重要的作用,目前为止很多临床对照研究显示,大黄酸在控制DN蛋白尿及DN进展中有一定作用,然而,其除了对血糖、胰岛素抵抗、减轻肾脏肥大等作用之外[2-3],是否能够抑制nephrin基因下调,目前尚无实验研究。本实验旨在探索大黄酸对DN的治疗作用,以及通过nephrin基因在DN大鼠足突细胞的表达变化,探讨大黄酸治疗DN的作用机制。
1 材料与方法
1.1 实验动物 Wistar雄性大鼠18只,体质量170~200g(重庆医科大学中心实验室);链脲佐菌素(streptozotocin,STZ)[3-4]。
1.2 试剂 24h尿蛋白测定试剂盒(北京为康惠华生物公司);酶联免疫吸附测试大鼠尿微量清蛋白试剂盒(上海研谨生物科技有限公司);抗体稀释液(ADI公司);兔抗nephrin抗体。
1.3 实验药物 大黄酸是从大黄的根茎中提取[5-6],大黄根茎购自北京兴事堂,并由上海众华生物科技有限公司提取。
1.4 仪器 德国Satorious电子天平;日立7020生物分析仪。
1.5 方法
1.5.1 动物模型制作 按照Anderson等[1]建立方法将所有动物适应性喂养5d,禁食12h,STZ以0.1mmol/L柠檬酸缓冲液溶解,按照50mg/kg一次性腹腔注射作为DN模型,模型对照组给予同等剂量的柠檬酸缓冲液,72h后开始检测空腹血糖、尿糖、尿量及24h微量清蛋白排泄率,DN建立成功标准为:(1)空腹血糖高于16.6mmol/L;(2)尿糖强阳性;(3)尿量/原尿量大于1.5;(4)24h尿蛋白排泄率大于30mg/24h。
1.5.2 实验分组 将DN动物模型分为2组:模型组、大黄酸治疗组。大黄酸溶于生理盐水,灌胃给药,每天1次,大黄酸治疗组给予大黄酸150mg·kg-1·d-1干预8周(n=6),模型组及模型对照组分别给予等剂量生理盐水灌服作为对照(n=6)。实验重复2次。
1.5.3 血糖、体质量、肾功能的测量 每2周测量各组大鼠血糖1次;第8周测定各组大鼠体质量;股动脉放血20μL分离血清,使用日立7170A全自动生化分析仪(重庆医科大学中心实验室)测量血肌酐(Cr)、尿素氮(BUN)、血清总胆固醇(TC)及三酰甘油(TG)。
1.5.4 尿微量清蛋白排泄率的检测 给药6周后,大鼠放入代谢笼,留取24h尿液,计算尿量,尿液离心25min(4℃,4 000r/min),取上清液分装,并于-70℃冻存,后使用酶联免疫吸附试验(ELISA)试剂盒检测尿蛋白。
1.5.5 肾组织形态学观察 大体观察并称质量。光镜下观察:在给予大鼠大黄酸干预8周后,麻醉并经腹主动脉插管,5℃磷酸盐缓冲液(PBS)灌注后取肾脏。迅速剥去肾包膜,称重后纵向剖开肾脏,切取约0.5cm×0.5cm×0.2cm大小的肾脏组织,肾组织经过10%中性甲醛缓冲溶液中固定、浸蜡、包埋、切片,HE、PAS、Masson3染色观察,取1mm×1mm×1 mm肾皮质,经戊二醛固定、饿酸后固定、脱水、环氧树脂618包埋,制作成超薄切片,用醋酸铀-柠檬酸铅染色,JEM透射电镜下观察。
1.5.6 肾脏免疫组织化学检测 5μm肾组织石蜡切片梯度脱蜡水化后,3%过氧化氢封闭内源性过氧化物酶,0.01mol/L PBS缓冲液洗涤,正常兔血清封闭,一次加入nephrin抗体,DAB显色,苏木精复染,树脂封片,采用JD-801计算机图像分析系统,每张切片随机选取15个肾小球,计算各组肾小球内nephrin的阳性信号占肾小球面积百分比[4]。
1.5.7 肾小球足突细胞密度测定 10%中性甲醛缓冲溶液固定,常规脱水、浸蜡、包埋、5μm石蜡切片。兔抗大鼠 WT1多克隆抗体(Merk公司)免疫组化SP法检测肾小球WT1表达,Image-Pro Plus 6.0彩色图像分析系统半定量足突细胞密度。
1.6 统计学处理 采用SPSS 18.0统计软件,计量资料以表示,两组间比较进行t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 模型组血糖均有升高,与模型对照组比较,均有多尿、多饮、多食、消瘦等症状。模型制作成功后,模型组血糖较模型对照组血糖升高明显(P<0.05),除模型对照组外,其余两组间血糖差异无统计学意义(P<0.05)。DN大鼠体质量均低于模型对照组(P<0.05)。
2.2 各组指标比较 模型组大鼠24h尿蛋白定量均高于模型对照组(P<0.05),见图1。6周后大黄酸治疗组与模型组比较,除血糖无明显变化外,BUN,Cr显著改善(P<0.05),见表1。
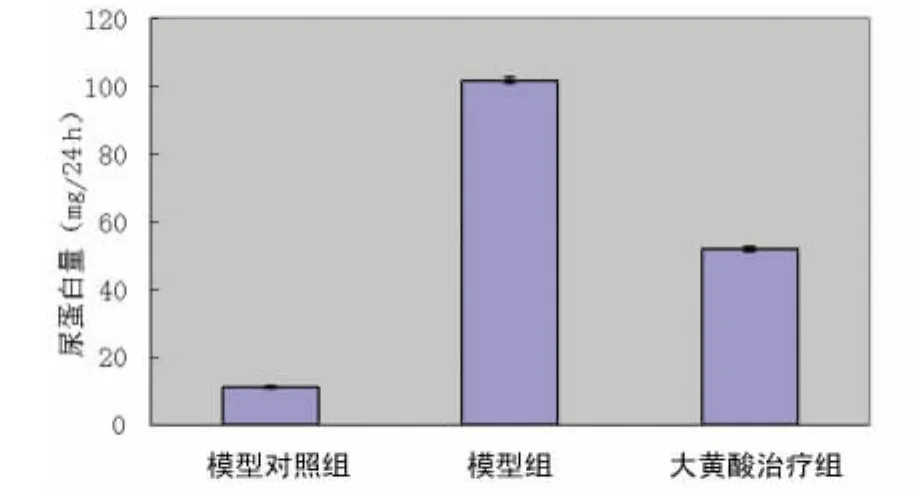
图1 各组24h尿蛋白量
2.3 肾组织形态学改变 模型组肾脏较模型对照组肾脏外观苍白、肿胀,质地变硬。模型对照组大鼠肾小球、肾小管形态规则,无明显细膜基质增生。模型组肾小球肥大,见系膜区弥漫性增宽,并有逐渐增多的PAS阳性物质沉积,肾小球基底膜(GBM)增厚,近端肾小管上皮细胞含较多糖原,并呈空泡样及颗粒样变性,间质内较多淋巴细胞等炎性细胞浸润。大黄酸干预后,肾小球及肾小管病变均有不同程度改变。见图2。
表1 各组生化数据变化比较
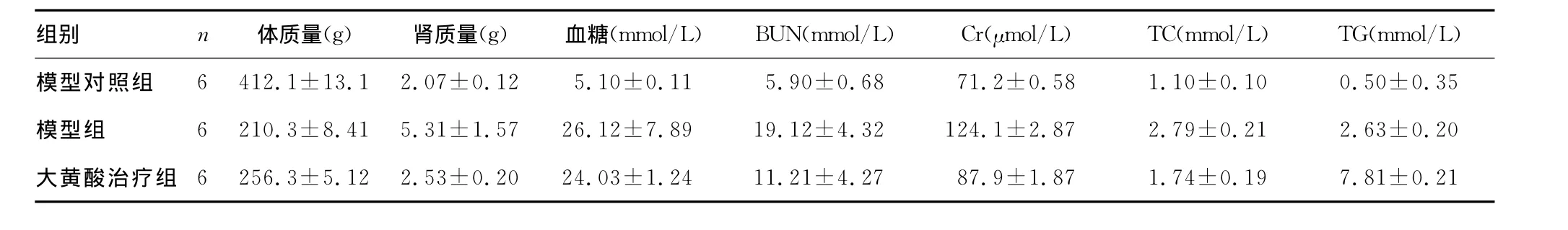
表1 各组生化数据变化比较
组别 n 体质量(g) 肾质量(g) 血糖(mmol/L) BUN(mmol/L) Cr(μmol/L) TC(mmol/L) TG(mmol/L)模型对照组 6 412.1±13.1 2.07±0.12 5.10±0.11 5.90±0.68 71.2±0.58 1.10±0.10 0.50±0.35模型组 6 210.3±8.41 5.31±1.57 26.12±7.89 19.12±4.32 124.1±2.87 2.79±0.21 2.63±0.20大黄酸治疗组 6 256.3±5.12 2.53±0.20 24.03±1.24 11.21±4.27 87.9±1.87 1.74±0.19 7.81±0.21

图2 模型组肾小球病理改变电镜下图片(免疫组化,×1 000)
2.4 足突细胞上nephrin的表达 nephrin特异性的表达于肾小球足突细胞上,通过电镜观察,模型组足突细胞上nephrin阳性明显,大黄酸治疗组阳性明显减少,半定量分析见:大黄酸治疗组与模型组比较,肾小球nephrin阳性面积百分比差异有统计学意义(P<0.05)。见图3。
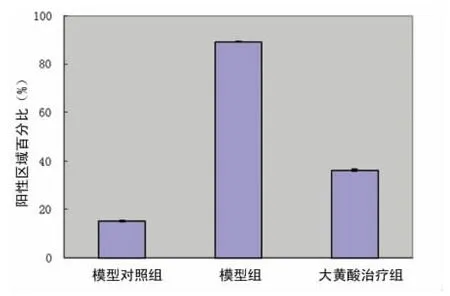
图3 各组足突细胞nephrin表达
3 讨 论
研究发现,DN在早起正确治疗,可能逆转肾小球、肾小管病理改变,但是,一旦进入Ⅳ期,病理改变就难以逆转,因此,在DN的治疗中应该早起诊断及治疗,既往研究发现,GBM成分改变及细胞外基质聚集是最终导致DN的关键病理改变,然而这些研究并不能完全解释蛋白尿及肾小球滤过率的改变,而近期研究发现足突细胞的损伤在DN的发病中起了重要作用,而nephrin基因表达的nephrin蛋白在足突细胞的裂孔隔膜中起重要作用,是裂空隔膜的主要成分[7-9]。本实验研究大黄酸在早期使用,对足突细胞裂空隔膜的主要成分nephrin基因表达的影响。
目前,国内外大部分研究,都是针对肾脏血管紧张素Ⅱ(AngⅡ)升高的研究,研究认为高血糖等作用最终导致AngⅡ升高,使机体血流动力学的改变,从而让肾脏处于高压力、高滤过、高灌注的病理情况下,最终导致肾脏损伤[10]。今年研究发现,使用血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)、血管紧张素受体(accounting Research Bulletins,ARB)等药物阻断AngⅡ或者AT1发挥生物学效应。而针对足突细胞及nephrin基因的研究较少,足突细胞即肾足突细胞,小囊脏层上皮细胞,它附着于GBM的外侧,是一种高度分化和特异性的细胞,呈星状多突状,主要由3部分组成:细胞体、主突、足突,足突呈指状交叉覆盖于GBM外侧,并通过黏附分子及糖蛋白分子将二者相连,足突细胞之间由极薄的裂空隔膜相连接,构成一种拉链式结构,从而与GBM及肾小球内皮细胞共同构成肾小球滤过屏障,是具有电荷及相对分子质量选择性的分子筛[11-12]。正常情况下,这种电荷屏障及机械屏障能保持肾脏正常的滤过功能,然而在糖尿病病程进展过程中,由于高血压等诸多因素,可通过细胞内因子、活性氧基团及改变血流动力学等导致足突细胞的坏死及凋亡,足突细胞数目减少及功能减弱以及GBM的裸露等原因最终导致患者出现蛋白尿。近期研究发现,足突细胞的裂空隔膜上的蛋白分子的表达与nephrin基因密切相关,而该基因与肾小球滤过屏障选择功能密切相关[13-14],并且nephrin下调及重新分布先于肾小球组织损害,是DN病程中的早期改变,且nephrin表达与蛋白尿的程度呈负相关,而已经有研究发现缬沙坦在阻止了nephrin下调后,小鼠蛋白尿有明显下降[15],然而针对DM引起足突细胞的损伤,除了严格控制血糖、抑制肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)外,并无其他治疗方法,因此积极寻找抑制足突细胞损伤,控制DN病情进展的药物迫在眉睫。
近年来研究发现,大黄酸具有改善糖代谢,逆转胰岛素抵抗作用,对治疗DN有一定效果,但是大黄酸除了抑制内皮细胞PAI-1的表达,保护内皮功能逆转胰岛素抵抗预防糖尿病高血糖对肾脏的影响外,是不是还对肾脏足突细胞本身有一定作用,目前尚无研究。本实验采用STZ 60mg/kg一次性腹腔注射方式制作大鼠DN模型,并给予大黄酸灌胃给药8周,后取肾脏行病理活检及免疫组化发现模型组与大黄酸治疗组比较,nephrin表达下调受到抑制,与对照组比较差异有统计学意义,本实验研究发现大黄酸对DN不止与改善糖代谢、逆转胰岛素抵抗、抗炎等功能有关,而且与nephrin基因的表达有一定关系,可能是通过nephrin蛋白的损伤,维持足突细胞完整性有一定作用,但是最佳剂量及不良反应等尚需进一步实验来证实。
[1] Anderson S,Rrenner BM.Reduced permselectivity in isolated perfused rat kidneys following small elevations of glomerular capillary pressure[J].Acta Physiologica Scandinavica,1994,150(2):201-209.
[2] Wolf G,Chen S,Ziyadeh FN,et al.From the periphery of glomerular capillary wall toward the center of disease podocyte injury comes of age in diabetic nephropathy[J].Diabates,2005,54(6):1626-1634.
[3] Langham RC,Kelly DJ,Cox AJ,et al.Proteinuria and the expression of the podocyte slit diaphragm protein nephrin in diabetic nephropathy effects ofangiotensin[J].Diabetologia,2002,45(11):1572-1576.
[4] 管娜,邓江红.足细胞分子分布和表达与足突形态变化和蛋白尿发生的关系[J].北京大学学报:医学版,2004,36(2):139-144.
[5] Aatltonen P,Luimula P,Astrom E,et al.Changes in the expression of nephropathy[J].Lab Invest,2001,81(9):1185-1190.
[6] Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J].Analyti Bio,1987,10(154):125-128.
[7] Shankland SJ,Scholey JW,Ly H.Expression of transforming growth-β1during diabetic renal hypertrophy[J].Clin Study,2012,7(34):862-870.
[8] Ruano G,Fenton W,Kidd KK.Biphasic amplification of very dilute DNA samples via"booster"PCR[J].Nucl Aci Res,1989,17(13):335-350.
[9] Ruano G,Kidd KK,Stephens C.Haplotype of multiple polymorphisms resolved by en zymatic amplification of single DNA molecules[J].Author Affiliations,2003,23(4):45-50.
[10]Fujihara CK,Padilha RM,Zatz R.Glomerular abnomalities in long-term experiment al diabetes:role of hemodynamic and nonhemodynamic factors and effects of antih pertensive therapy[J].Sym Dia Me,1992,12(26):689-695.
[11]Remuzzi A,Perico N,Amuchastegui CS.Short and longterm effect of a ngio tensinⅡreceptor blockade in rats with experimental diabetes[J].J Am Soc Nephrol,1993,21(5):214-219.
[12]何东元,王笑云,王宁宁,等.大黄酸抑制肾间质成纤维细胞激活的实验研究[J].中华肾脏病杂志,2006,22(2):105-108.
[13]攀均明,唐嵘.含马铃酸中草药及马兜铃酸肾病的熏蒸医学观点[J].中药药理与临床,2001,12(6):396-399.
[14]Mauer SM,Steffes MW,Brown DM.Animal models of diabetic nephropathy[J].Adv Nephrol,1979,12(8):23-42.
[15]Qsterby R,Gundersen HJG.The glomerular basement membrane in early diabetes[J].Front Matrix Biol,1979,12(7):72-77.

