丁酸钠通过下调细胞干扰素调节因子-1抑制鼻咽癌细胞CNE2吲哚胺-吡咯2,3-双加氧酶的表达*
郭芝刚,曾 军,张锦宏,何玉文△
(广州医学院:1.基础学院;2.第一附属医院药剂科 510120)
研究表明,吲哚胺-吡咯2,3-双加氧酶(indoleamine-pyrrole 2,3-dioxygenase,IDO)在肿瘤逃避免疫监视、肿瘤发生、发展中起着重要作用[1-2]。多种人肿瘤细胞和原发性肿瘤组织表达IDO,其抑制抗原特异性T淋巴细胞的增生,使肿瘤逃避机体的免疫攻击[3-4]。研究发现,抑制IDO表达可以抑制自发性肿瘤的生长[5],丁酸钠(sodium butyrate,NaB)也能抑制IDO的表达,但机制不明确。本研究主要探讨NaB抑制鼻咽癌细胞CNE2内IDO表达的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 CNE2细胞株为人鼻咽癌上皮细胞,由中山大学肿瘤医院基础部赠送。
1.1.2 试剂 试剂Soudim butyrade,购自Sigma公司;注射用重组人干扰素γ(IFN-γ),海雷泰,国药准字S19990059;兔抗IDO抗体(中山大学微生物与生化制药研究室制作);β-肌动蛋白抗体(β-actin)购自北京博奥森生物技术有限公司;辣根过氧化物酶(HPR)标记的羊抗兔IgG购自Promega公司;SYBR Green PCR检测试剂盒购自Toyobo公司;RPMI-1640培养基粉末购自美国Gibco公司;新生牛血清购自北京晨曦勇创公司。
1.2 细胞培养 CNE2细胞用含10%新生牛血清的RPMI-1640培养基,37℃,5%CO2条件下培养,以每孔3×105个接种6孔板,待细胞覆盖率达60%~70%,加入NaB和(或)IFN-γ处理细胞。
1.3 Western blot免疫印迹检测IDO的表达 取上述培养的细胞,加入2mmol/L NaB处理CNE2细胞0、6、12、24h后,加入100U/mL IFN-γ刺激24h后裂解细胞,进行蛋白定量,每孔20μg蛋白上样,120V电压进行10%SDS-PAGE聚丙烯酰胺凝胶电泳分离,在100V,90min的条件下电转,5%脱脂奶粉(TBST配制)封闭1.5h后,IDO抗体按1∶1 000的比例与封闭液混合,4℃过夜孵育电转膜,TBST洗涤3次后,加入HPR标记的羊抗兔IgG二抗(1∶2 000),室温摇床振荡1h,TBST洗涤3次,加入ECL发光液后用X光片曝光。
1.4 RT-PCR检测细胞因子信号抑制因子(suppress of cytokine signaling,SOCS)的转录 采用2mmol/L NaB和100U/mL IFN-γ同时处理CNE2细胞6h,Trizol抽提总RNA;42℃60min,95℃5min进行逆转录;以逆转录的cDNA为模板,94℃变性5min,94℃变性30s,SOCS1 44℃、SOCS3 51℃ 退火30s,72℃延伸45s,35个循环,最后72℃延伸10min,终止反应,进行PCR反应(表1)。
1.5 Real time PCR 检测干扰素调节因子-1(interferon regulatory factor-1,IRF-1)的转录水平 取2mmol/L NaB,100U/mL IFN-γ单独或同时处理CNE2细胞6h后,Trizol抽提总RNA;42℃60min,95℃5min进行逆转录;用25μL标准PCR反应体系检测IRF-1的转录,25μL标准PCR反应体系:2×SYBR Green 12.5μL,PCR Forward Primer(10μmol/L)1 μL,PCR Reverse Primer(10μmol/L)1μL,DNA 模板 1~5 μL,加H2O到25μL。采用两步法进行Real time PCR反应:步骤1:95℃30s,步骤2:95℃5 10s,60℃40s40个循环,反应结束后分析Real time PCR的扩增曲线、融解曲线和标准曲线。IRF-1引物F:ATG GCT GGG ACA TCA ACA AGG,R:CAT GGC ACA GCG AAA GTT GG。

表1 检测SOCS1和SOCS3转录的引物
2 结 果
Western blot和RT-PCR检测NaB对CNE2细胞IDO、SOCS1、SOCS3转录的影响(图1~3)。结果显示SOCS1和SOCS3的转录没有显著变化。提示两者未参与NaB抑制IDO表达的信号传导。NaB抑制IRF-1的转录,间接影响IDO的表达,见图4。

图1 Western-blot检测结果NaB对CNE2细胞IDO表达的影响
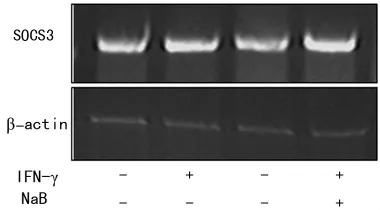
图2 RT-PCR检测NaB及IFN-γ对CNE2细胞内SOCS1转录的影响
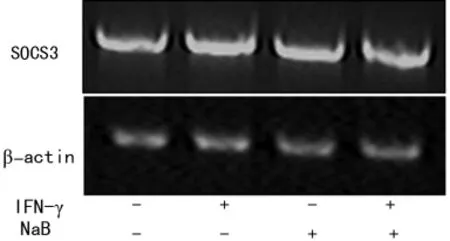
图3 RT-PCR检测NaB及IFN-γ对CNE2细胞内SOCS3转录的影响
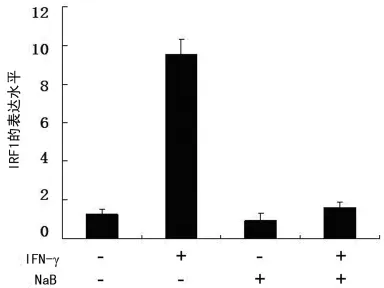
图4 Real time PCR检测NaB及IFN-γ对CNE2细胞内IRF1转录的影响
3 讨 论
NaB是由厌氧菌分解发酵结肠中未经小肠消化的食物中的糖类(主要是纤维和蛋白)产生的,是结肠上皮细胞主要的能量来源,能刺激结肠肽或生长因子的释放,调节结肠黏膜血供,促进上皮细胞的增殖[6]。近来发现NaB能有效抑制肿瘤细胞增殖、诱导分化、促进凋亡的作用。NaB通过抑制组蛋白去乙酰化酶活性,导致组蛋白(非H1组蛋白H3、H4)高乙酰化,使组蛋白与相邻DNA的接触受抑制,改变了染色质的紧密结合,有利于转录因子激活特异性的基因,细胞分裂周期被阻滞于G1期,而达到NaB抗肿瘤的作用[7-8]。本研究发现NaB抑制IFN-γ诱导的IDO的表达。
IFN-γ调节基因的转录主要是通过Jak-STAT信号通路,其中有50多种细胞调节因子参与[9-10]。在IFN-γ未结合其受体时,IFN-γR1和IFN-γR2可能没有密切的联系。然而,最近研究发现在配体结合之前,IFN-γR1和IFN-γR2是装配好的。当IFN-γ与其受体结合后,受体的胞内区开放,Jak2自身磷酸化,然后磷酸化激活Jak1,两个Jak1可以形成一个招募STAT1同源二聚体的槽,STAT1二聚体接着被Jak2磷酸化,磷酸化后的STAT1二聚体从受体上脱离下来。IFN-γ激活其受体到STAT1二聚体从受体上脱离这一过程只需要1min就完成了。STAT1二聚体进入核内结合启动子,诱导或抑制IFN-γ调节的基因。STAT1结合的元件有GAS和ISRE。IFN-γ诱导的第一批基因转录发生在15~30min之内。许多IFN-γ诱导基因是细胞内的转录因子,它们由IFN-γ诱导转录,接着调节下一批基因的转录[11-12]。
细胞因子是一类由细胞分泌的调节细胞生长、分化、增殖的多肽小分子,它们不能直接进入细胞内发挥作用,而是通过细胞因子受体介导,经相应信号传导途径发挥其生物学效应。SOCS是信号传导通路JAK/STAT(Janus kinase/signal transduction and activators of transcription)的一个负性调控分子家族。SOCS家族有8个成员,每个成员都有一个中央SH2域,除了通常的蛋白质降解的泛素化机制,SOCS1和SOCS3能直接抑制JAK的酪氨酸激酶活性。
干扰素调节因子-1(IRF-1)是IFN-γ调节IDO表达通路上的关键因子,IRF-1通过IRF-E位调节靶基因的表达,IRF-E位的序列重叠于ISR-E的序列,此序列被ISGF3识别,其被Ⅰ型、Ⅱ型IFN-γ诱导[13]。在本研究采用Real time-PCR检测了NaB和(或)IFN-γ作用下IRF-1的转录水平,发现IFN-γ作用下IRF-1的转录水平显著增高,而NaB有效阻断了IRF-1的转录,结果提示NaB对IFN-γ调节IDO表达抑制,可能是通过抑制IFN-γ的下游信号通路来实现的。
本研究证明了NaB通过抑制IRF-1的转录,从而抑制IDO表达的细胞内信号通路,为其在鼻咽癌治疗的应用中提供了实验依据,为以IDO为靶点的鼻咽癌的免疫治疗提供一种新的策略。
[1] 张文颖.IDO、树突状细胞与免疫耐受[J].国际免疫学杂志,2006,29(6):364-367.
[2] 王慧,潘科,夏建川.IDO和CD4+CD25+调节性T细胞在肿瘤免疫逃逸中相互作用的研究进展[J].癌症,2009,28(2):221-224.
[3] Uyttenhove C,Pilotte L,Théate I,et al.Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J].Nat Med,2003,9(10):1269-1274.
[4] Munn DH.Indoleamine 2,3-dioxygenase,tumor-induced tolerance and counter-regulation[J].Curr Opin Immunol,2006,18(2):220-225.
[5] Zeng J,Cai S,Yi Y,et al.Prevention of spontaneous tumor development in a ret transgenic mouse model by ret peptide vaccination with indoleamine 2,3-dioxygenase inhibitor 1-methyl tryptophan[J].Cancer Res,2009,69(9):3963-3970.
[6] Blottiere HM,Buecher B,Galmiche JP,et al.Molecular analysis of the effect of short-chain fatty acids on intestinal cell proliferation[J].Proc Nutr Soc,2003,62(1):101-106.
[7] Budillon A,Di Gennaro E,Bruzzese F,et al.Histone deacetylase inhibitors:a new wave of molecular targeted anticancer agents[J].Recent Pat Anticancer Drug Discov,2007,2(2):119-134.
[8] Bi G,Jiang G.The molecular mechanism of HDAC inhibitors in anticancer effects[J].Cell Mol Immunol,2006,3(4):285-290.
[9] Choi WH,Ji KA,Jeon SB,et al.Anti-inflammatory roles of retinoic acid in rat brain astrocytes:Suppression of interferon-gamma-induced JAK/STAT phosphorylation[J].Biochem Biophys Res Commun,2005,329(1):125-131.
[10]David M,Petricoin E,Larner AC.Activation of protein kinase a inhibits interferon induction of the Jak/Stat pathway in U266cells[J].J Biol Chem,1996,271(9):4585-4598.
[11]Heim MH,Kerr IM,Stark GR,et al.Contribution of STAT SH2groups to specific interferon signaling by the JAKSTATpathway[J].Science,1995,267(5202):1347-1349.
[12]Greenlund AC,Morales MO,Viviano BL,et al.STAT recruitment by tyrosine-phosphorylated cytokine receptors:an ordered reversible affinity-driven process[J].Immunity,1995,2(6):677-687.
[13]Tanaka N,Kawakami T,Taniguchi T.Recognition DNA sequences of interferon regulatory factor 1(IRF-1)and IRF-2,regulators of cell growth and the interferon system[J].Mol Cell Biol,1993,13(8):4531-4538.

