槲皮素对人肝癌细胞生长、迁移能力的影响及机制研究*
周 进,方 丽,姚文秀,熊竹娟,周 详,周 行,谢 华
(1.四川省肿瘤医院肿瘤内科,成都 610041;2.成都医学院第一附属医院消化内科,成都 610500)
恶性肿瘤是目前的医学难点。传统的治疗手段包括手术、放疗、化疗以及最近新兴的生物靶向治疗。然而,对于化学治疗来说,尽管药物众多,但强烈的不良反应限制了许多联合方案的运用,迫切需要寻找高效低毒的抗肿瘤新型药物。近年来,天然植物提取物——小分子黄酮类受到研究者们的强烈关注。黄酮类主要包括了姜黄素、槲皮素和厚朴等。他们存在广泛,体外及动物实验研究表明其能抑制子宫内膜癌、前列腺癌、结肠癌、鼻咽癌、肺癌、白血病等多种恶性细胞生长[1-4]。本课题研究拟通过生长抑制试验及划痕检测,观察槲皮素对人肝癌细胞(human hepatocellular carcinoma cell lines,HepG2)生物学行为的影响,并对其机制进行初步探讨。
1 材料与方法
1.1 材料与试剂 槲皮素100mg(批号:051K1225)购自Sigma公司。使用时经二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,Dulbecco最低必需培养基(Eagle′s minimum essential medium,DMEM)培养基稀释成所需浓度,其中DMSO终浓度小于0.1%。胎牛血清、DMEM培养基购自Gibco公司;胰蛋白酶(Tyrisin)购自Promega公司,HepG2细胞由四川大学生物治疗国家重点实验室留存。
1.2 HepG2细胞生长形态学观察 复苏冻存的HepG2细胞,于5%CO2、37%湿度的孵箱中培养。倒置显微镜(Olympus)对槲皮素作用前、后HepG2细胞的生长速度、形态、悬浮细胞比例进行比较、评估。
1.3 生存抑制实验[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT] HepG2细胞生长至对数期,胰蛋白酶消化,以104个/每孔的密度接种于96孔培养板,每孔体积约200μL。继续培养24h,依次加入浓度为10、20、50、100和200μmol/L的槲皮素稀释液,以含0.1%DMSO的DMEM培养基为空白对照,分别培养24、48和72h。加入MTT液(5mg/mL)20μL,孵育4h,加入100μL DMSO,振荡10min,全自动酶标仪(490nm)测定各孔的光吸收值(A),按公式:生存抑制率=1-药物组A/空白对照组A×100%进行计算。
1.4 细胞划痕实验 将细胞培养于6孔培养皿,接种密度为1×105/孔。待细胞生长至约80%培养皿时,用200μL移液枪尖在细胞中做一划痕,宽度约2mm。磷酸缓冲液(phosphate buffer solution,PBS)冲洗培养皿以移去上层悬浮细胞。加入50μM浓度的槲皮素稀释液,以正常DMEM培养基为空白对照。继续培养,使用数码照相系统(Carl Zeiss,Axiovert200,SIP No.MICO1223,德国)于实验后24、48h对同一划点照相,重复3次,并将图片数据输入Scion软件,计算划痕空白剩余面积,进行统计学比较。
1.5 Western blot检测 槲皮素作用前、后HepG2细胞中细胞 迁 移 黏 附 因 子 (Ras GTPase-activating-like protein,IQGAP1)的表达差异:细胞裂解液裂解HepG2细胞,提取总蛋白,定量。电泳分离、转膜。50g/L脱脂奶粉缓冲液4℃封闭过夜,加一抗IQGAP1(1∶200)室温振摇孵育2h,洗膜30 min后加二抗(1∶8 000)室温振摇孵育1h,洗膜,暗盒显影。内参选用β-actin。
1.6 统计学处理 应用SPSS11.0软件进行统计学数据处理,将MTT检测数据和划痕修复面积进行统计学处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 槲皮素处理细胞后形态学变化 正常HepG2细胞生长旺盛,紧贴培养瓶壁生长,轮廓清楚,胞浆饱满,细胞间接触紧密。经槲皮素处理后,细胞变圆,增殖变慢,附壁疏松,脱壁,周围碎片增多。随着槲皮素作用时间和浓度的增加,上述变化愈加明显。
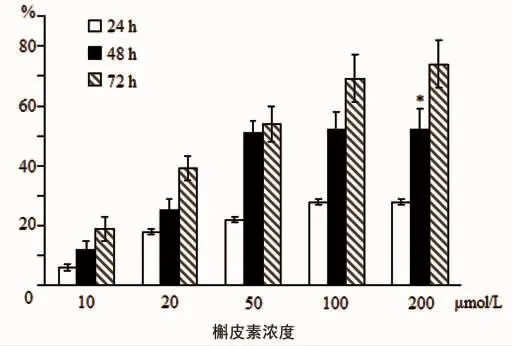
图1 不同浓度槲皮素对HepG2细胞生存抑制效果
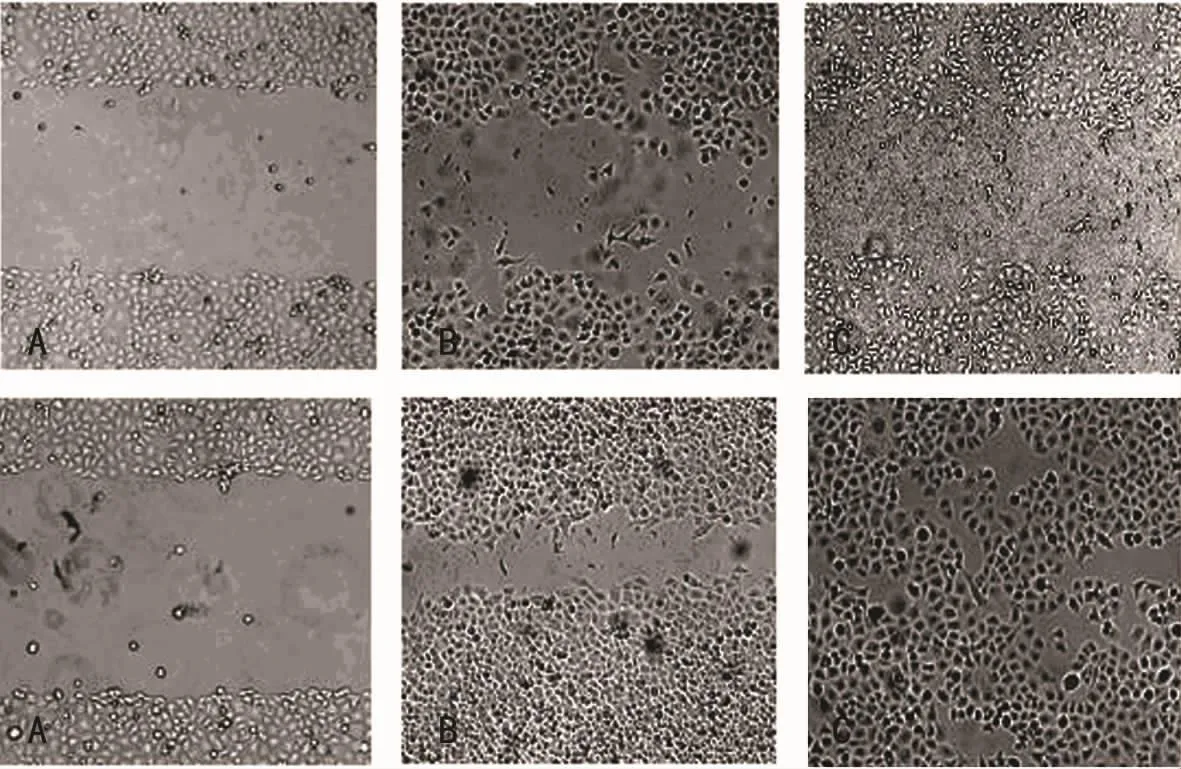
图2 HepG2细胞下的表达(倒置显微镜,×10)

图3 划痕实验空白面积比较
2.2 槲皮素对HepG2细胞增殖的影响 MTT显示,槲皮素对HepG2细胞生长有明显抑制作用,且具有剂量和时间依赖性。药物处理24h后,槲斗皮素浓度为10、20、50、100和200 μmol/L的抑制率分别为8%、18%、22%、27%、27%;药物继续作用至48h,50μmol/L浓度的抑制作用明显提高,达到51%(IC50),细胞生存抑制作用比较见图1。
2.3 加入槲皮素前、后HepG2迁徙能力的变化 正常生长的HepG2细胞生长旺盛,迁徙能力强,24h划痕面积明显减小,48hHepG2细胞几乎全部覆盖划痕。而在加入50μmol/L槲皮素作用48h后,HepG2细胞的迁徙能力明显减弱(图2)。对残留划痕面积进行比较,两组差异有明显的统计学意义(图3),P<0.05。
2.4 槲皮素作用前、后HepG2细胞中IQGAP1蛋白的表达
实验48h获取Western blot结果(图4)相对于正常生长的HepG2细胞来说,加入槲皮素(50μmol/L)充分作用后,细胞中IQGAP1蛋白表达明显减低。

图4 Western blot检测槲皮素作用前、后HepG2细胞中IQGAP1蛋白的表达
3 讨 论
槲皮素在恶性肿瘤、炎症反应的作用是目前生命科学的研究热点。本实验主要观察槲皮素在HepG2细胞生长增殖和转移迁徙中的抑制作用。结果显示,槲皮素能明显抑制HepG2细胞的增殖生长,并对其迁徙能力产生强大的负调控作用。
关于槲皮素发挥抑制恶性肿瘤细胞生长的机制,目前的研究表明可能与下列因素有关:(1)失活原癌基因akt-1、bcr、ras,上调抑癌基因p21、p53等表达[5];(2)抑制肿瘤新生血管生成:VEGF是血管生成的重要调节因子,而槲皮素则可以高效抑制VEGF表达[6];(3)诱导凋亡:槲皮素能上调 Bax、Bad、Bcl-x等促凋亡基因,抑制凋亡负调控分子Bcl-2而诱导凋亡[7];(4)阻遏热休克蛋白(heat shock protein,HSP)产物,HSP是重要的分子伴侣蛋白,能减轻高热、低氧、化学药物等刺激对细胞的损伤。槲皮素能下调 HSP70、HSP72、HSP90基因转录水平[8];(5)抗氧化作用:槲皮素还能减弱细胞的氧化压力损伤[9];(6)其他如逆转多药耐药(MDR)机制[10]。
最近,IQGAP1在恶性细胞黏附迁移中的中枢作用受到研究者的广泛关注。IQGAPs(Ras GTPase-activating-like protein)是真核细胞内一个相对保守的蛋白家族,位于染色体15q26,具有IQ和Ras-GTPase激活蛋白相关结构域(Ras-GAP-related domain,GRD)。IQ结构域由4个串联排列的IQ模体组成,能与钙调蛋白、肌球蛋白轻链和S100B结合[11]。GRD结构域可以和 Rho GTPase、cdc42、Racl结合[12]。目前,人类至少发现了3个家族成员,IQGAPl、IQGAP2和IQGAP3。IQGAPl是研究热点,许多学者认为由IQGAP1介导的细胞黏附迁移是肿瘤转移侵袭的基本步骤之一[13]。这个生命过程中,在上游蛋白Rac1、GTP等信号调节下,IQGAP1通过与α-连环蛋白(α-catenin)、β-连环蛋白(β-catenin)、钙调蛋白相互作用改变细胞之间的黏附能力[14]。有学者发现在抑制IQGAP1功能后,恶性细胞的黏附迁移能力显著降低,与正常时比较表现为较低的侵袭力[15]。
本研究观察到槲皮素作用前、后HepG2细胞生长及迁移能力的变化,并结合免疫印迹法中IQGAP1表达结果,推测槲皮素对IQGAP1基因的影响可能是其干扰HepG2细胞生长、减弱其黏附侵袭能力的途径之一。
[1] 周进,方丽,姚文秀,等.细胞培养氨基酸稳定同位素标记——质谱技术测定槲皮素对人肝癌细胞热休克蛋白表达的影响[J].中华肿瘤杂志,2011,33(10):737-741.
[2] Volate SR,Davenport DM,Muga SJ,et al.Modulation of aberrant crypt foci and apoptosis by dietary herbal supplements(quercetin,curcumin,silymarin,ginseng and rutin)[J].Carcinogenesis,2005,26(8):1450-1456.
[3] Kuo PC,Liu HF,Chao JL.Survivin and p53modulate quercetin-induced cell growth inhibition and apoptosis in the human lung carcinoma cells[J].J Biol Chem,2004,279(53):55875-55885.
[4] 罗进勇,李林,尹一兵.槲皮素对人肺腺癌A549细胞增殖和凋亡的影响[J].重庆医学,2005,34(4):551-552.
[5] Ranelletti FO,Maggiano N,Serra FG,et al.Quercetin inhibits p21-RAS expression in human colon cancer cell lines and in primary colorectal tumors[J].Int J Cancer,2000,85(3):438-442.
[6] Tan WF,Lin LP,Li MH,et al.Quercetin,a dietary-derived flavonoid,possesses antiangiogenic potential[J].Eur J Pharm,2003,459(3):255-262.
[7] Nguyen TT,Tran E,Nguyen TH,et al.The ro1eof activated MEK-ERK pathway in quercetin-induced growth inhibition and apoptosis in A549lung cancer cells[J].Carcinogenesis,2004,25(5):647-659.
[8] Wei YQ,Zhao X,Kariya Y,et al.Induction of apoptosis by quercetin:involvement of heat shock protein[J].Cancer Res,1994,15(54):4952-4957.
[9] Alia M,Ramos S,Mateos R,et al.Quercetin protects human hepatoma HepG2against oxidative stress induced by tert-butyl hydroperoxide[J].Toxicol Appl Pharmacol,2006,212(2):110-118.
[10]Kim SH,Yeo GS,Lim YS,et al.Suppression of multidrug resistant via inhibition of heat shock factor by quercetin in MDR cells[J].Exp Mol Mnd,1998,30(2):87-96.
[11]Darerca O,Louise JC,Keily L,et al.The IQGAP1-Rac1 and IQGAP1-Cdc42interactions:interfaces differ between the complexes[J].J Biol Chem,2008,283(3):1692-1704.
[12]Mataraza JM,Li Z,Jeong HW,et al.Multiple protein mediate IQGAP1-stimulated cell migration[J].Cell Signal,2007,19(9):1857-1865.
[13]Ren JG,Li Z,Sacks DB.IQGAP1integrates Ca2+/calmodulin and B-Raf signaling[J].J Biol Chem,2008,283(34):22972-22982.
[14]Wang JB,Sonn R,Tekletsadik YK,et al.IQGAP1regulates cell proliferation through a novel CDC42-mTOR pathway[J].J Cell Sci,2009,122(12):2024-2033.
[15]Dong PX,Jia N,Xu ZJ,et al.Silencing of IQGAP1by shRNA inhibits the invasion of ovarian carcinoma HO-8910PM cells in vitro[J].J Wxp Clin Cancer Res,2008,27(27):77-87.

