侵袭性真菌病111例临床特点及体外药敏分析
唐晓丹,吴菊芳,章强强,徐俊芳,陈轶坚
2.复旦大学附属华山医院。
侵袭性真菌病的发病率随着易感人群(如接受广谱抗菌药物和侵袭性操作技术)的增加而逐年上升,病死率居高不下。但真菌病的诊断仍为医疗界关注的重点,各国都相应制定了侵袭性真菌病的诊断标准,本研究参考2008年EORTC/MSG在移植和肿瘤患者中制定的侵袭性真菌病的诊断标准修正定义[1],回顾性分析复旦大学附属华山医院2004—2006年侵袭性真菌病的临床及病原学特点。
材料与方法
一、研究对象
2004年1月—2006年12月本院门诊及住院患者中血液、正常无菌体液(包括脑脊液、胸水、腹水、胆汁、关节腔积液等)、深部脏器组织(包括肺、肝、脑等)真菌培养或镜检阳性的病例,及支气管肺泡灌洗液或痰标本中分离出曲霉或隐球菌的病例。
二、研究方法
(一)病例入选标准 查阅上述真菌培养和(或)镜检阳性患者病史,根据侵袭性真菌病诊断标准[1],筛选出“确诊”及“拟诊”为侵袭性真菌病的病例。不包括“疑似”病例。
(二)调查方法 按照设计的侵袭性真菌病调查表,回顾性分析符合上述入选标准的侵袭性真菌病患者的基础疾病、危险因素、临床特点、病原学特点。
(三)医院感染诊断标准 按照2001年卫生部颁布的《医院感染诊断标准(试行)》将上述病例分为医院感染和社区获得感染。
(四)真菌药敏测试 参照美国CLSI/NCCLS M27-A推荐的微量肉汤稀释法,以6种抗真菌药物对收集病例相应的病原真菌共94株进行药敏测试。抗真菌药物包括两性霉素B、氟胞嘧啶、氟康唑、伏立康唑、伊曲康唑、卡泊芬净。隐球菌由于对卡泊芬净天然耐药,故只检测其余5种抗真菌药物对其抗菌活性。
(五)结果判读 参照美国2002年NCCLS M27-A2及2005年 CLSI Antifungal Subcommittee minutes meeting上又提出伏立康唑对念珠菌微量肉汤稀释法和纸片法临界浓度判断的解释,酵母对两性霉素B尚无明确临界浓度,参考M27-A2,本研究以 MIC>1 mg/L为耐药,而 MIC≤1 mg/L为敏感。酵母于卡泊芬净无判断标准,所以本研究只列其MIC。
结 果
一、一般资料
根据上述入选标准,本研究共入选侵袭性深部真菌病病例111例。其中确诊(proven)104例,拟诊(probable)7例。男72例,女39例。年龄4~79岁,平均(48±17)岁。其中属社区获得性感染61例(55.0%),医院感染者50例(45.0%)。
111例患者中有基础疾病者76例(68.5%),依次包括颅内实体肿瘤术后、脑血管意外、慢性阻塞性肺疾病(COPD)、脑外伤术后、糖尿病、肝硬化、自身免疫性疾病、HIV感染、慢性肾功能不全、风湿性心脏病等。
二、感染部位
真菌侵犯的感染部位依次为:血流感染51例(45.9%)、中枢神经系统感染44例(39.6%)、肺部感染14例(12.6%)、眼部感染2例(1.8%)。
(一)血流感染 本研究侵袭性真菌病中血流感染居第1位,共51例,占45.9%。引起真菌血流感染的病原菌以念珠菌属最多,49例,占96.1%,其中白念珠菌32例,占62.7%;其次为非白念珠菌17例,占33.3%。见表1。
51例血流感染均为确诊病例,以医院感染最常见,48例占94.1%,而社区获得性感染仅3例占6.0%。
血流感染患者均存在不同程度的基础疾病和诱发因素。其中医院感染和社区获得性感染的基础疾病和诱发因素亦有所不同。
医院血流感染常见的基础疾病包括术后、脑血管意外等。其诱发因素中,最常见者为深静脉置管,有33例,占64.7%,且11例患者静脉留置管与血培养呈相同的真菌。广谱抗菌药物应用>7 d者35例,占72.9%。其他包括住院时间长、老年、经历重大手术、侵袭性操作、导尿管留置等。见图1。
3例社区获得感染患者的病史分别为:①输尿管结石所致尿路梗阻引起的逆行性白念珠菌血流感染;②人工心瓣膜继发白念珠菌血流感染合并心内膜炎;③HIV感染继发马尼菲青霉病。
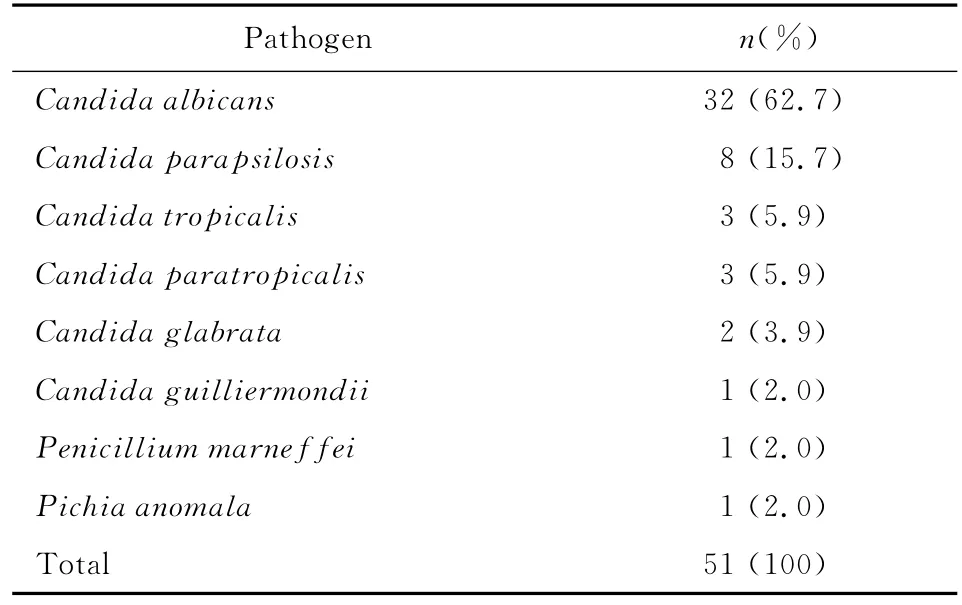
表1 血流感染的病原真菌分布Table 1 The fungal pathogens of blood stream infections
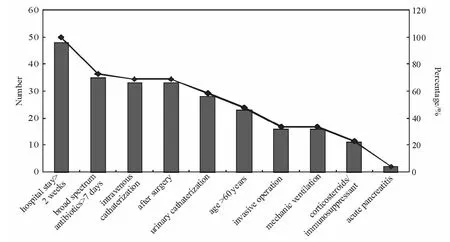
图1 医院血流感染因素分布Figure 1 The precipitating factors of nosocomial fungal blood stream infections
(二)中枢神经系统感染 本研究侵袭性真菌病中中枢神经系统感染居第2位,共44例,占39.6%,均为社区获得性感染确诊病例。男34例,女10例,平均年龄(41±16)岁。病原菌分布隐球菌43例,均分离自腰穿脑脊液,烟曲霉1例,分离自脑脓肿(肝肾联合移植术后出现脑脓肿,外科手术病理检查真菌阳性),见表2。

表2 中枢神经系统致病真菌分布Table 2 The fungal pathogens of central nervous system infection
隐球菌脑膜炎43例患者均为社区获得性,平均年龄(40±11)岁。其中有基础疾病者10例(23.3%),包括HIV感染2例、慢性乙型肝炎3例、结缔组织病长期服用激素3例、糖尿病1例、矽肺1例。
(三)肺部感染 本组侵袭性肺部真菌病14例,占12.6%。其中确诊7例,拟诊7例。确诊7例均为肺穿刺组织镜检或培养阳性,包括隐球菌4例、曲霉2例、白念珠菌1例。拟诊7例包括痰中检出曲霉6例,支气管肺泡灌注液检出曲霉1例,并符合宿主因素及临床标准(详见下述)。
病原真菌依次为曲霉、隐球菌、白念珠菌,见表3。
肺曲霉病中确诊2例,拟诊7例。男6例,女3例。平均年龄(61±12)岁。
肺曲霉病除1例确诊患者无基础疾病及诱发因素外,另8例患者均存在基础疾病及危险因素,基础疾病包括:COPD、肾移植合并糖尿病、皮肌炎合并糖尿病、类风湿性关节炎合并糖尿病、糖尿病酮症酸中毒、系统性红斑狼疮、银屑病、双肺转移性肿瘤。宿主因素:8例中除1例双肺转移性肿瘤者外,其余7例均在起病前1月内应用过激素、免疫抑制剂、细胞毒等药物。

表3 肺部真菌病的病原菌Table 3 The pathogens of pulmonary fungal infections
肺曲霉病9例临床表现:咳嗽9例、发热(37~38.5℃)5例、咯血3例,病情进展快,有4例在治疗情况下仍1~2周内发展为呼吸衰竭,部分患者从最末正常肺部CT/X线胸片发展至影像学明显异常时间为2周~1个月。
影像学表现:以结节或伴空洞形成为特点。4例为多发结节伴空洞、3例为多发结节、1例单个结节/团块、1例斑片状渗出。病变累及双肺者3例、累及双下肺者2例、累及左肺上叶者2例、累及右下肺者2例。
(四)眼内炎 2例眼内炎均确诊为曲霉病,眼科手术取病理或培养阳性。1例患者曲霉分离自眼内容物,无基础疾病及明确危险因素。另1例患者曲霉分离自玻璃体液,基础疾病为重度慢性乙型肝炎,发病前1月内有应用激素史,且其同时合并中枢神经系统感染(病原菌未确定)。
三、病原学特点
(一)病原真菌构成及来源 病原真菌的构成及来源见表4。
(二)病原真菌在各系统感染的分布 病原真菌在各部位的分布有明显不同,见表5。如念珠菌属绝大部分引起血流感染。隐球菌主要引起中枢神经系统感染,其次为肺部感染。曲霉主要引起肺部感染。
四、社区获得性感染与医院感染的区别
本研究侵袭性真菌病起病于社区者61例,占55.0%。医院感染50例,占45.0%。这2种不同起病场所感染的感染部位、致病真菌、基础疾病及危险因素均有不同。

表4 病原真菌的构成及来源Table 4 The distribution and source of fungal pathogens
(一)感染部位不同 61例社区获得性感染的部位主要为中枢神经系统44例(72.1%)和肺部12例(19.7%)。50例医院感染的部位则以血流感染为主,48例(96.0%)。见表6。

表5 病原菌在各感染部位的分布[n(%)]Table 5 The source of fungal pathogens[n(%)]
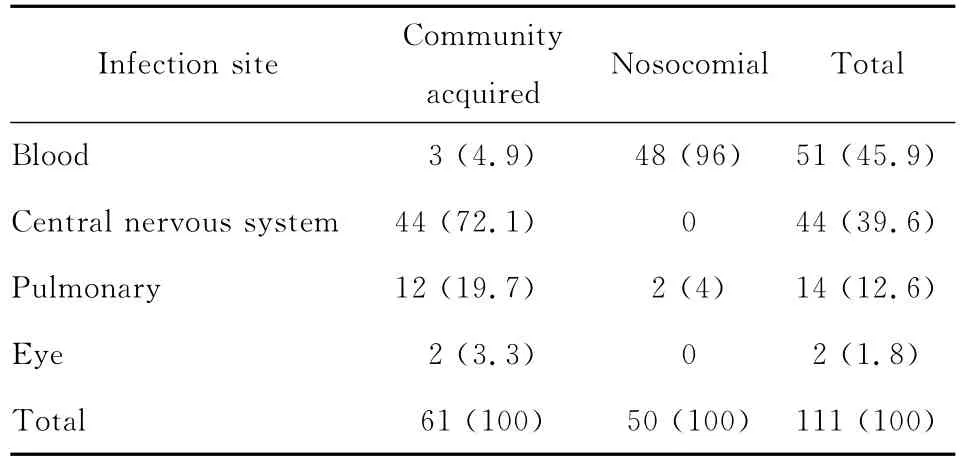
表6 社区获得性真菌病与医院真菌病的部位比较[n(%)]Table 6 Infection site of community acquired versus nosocomial fungal infections[n(%)]
(二)病原真菌不同 社区获得性真菌病和医院真菌病的病原菌分布有明显差别,见表7。社区获得性感染中占优势的真菌为隐球菌(77.0%)、曲霉(16.4%)。本研究隐球菌病47例均为社区获得性。曲霉病10例患者中8例起病于社区。而医院感染者中主要为念珠菌属(94.0%),主要分布于血流感染。
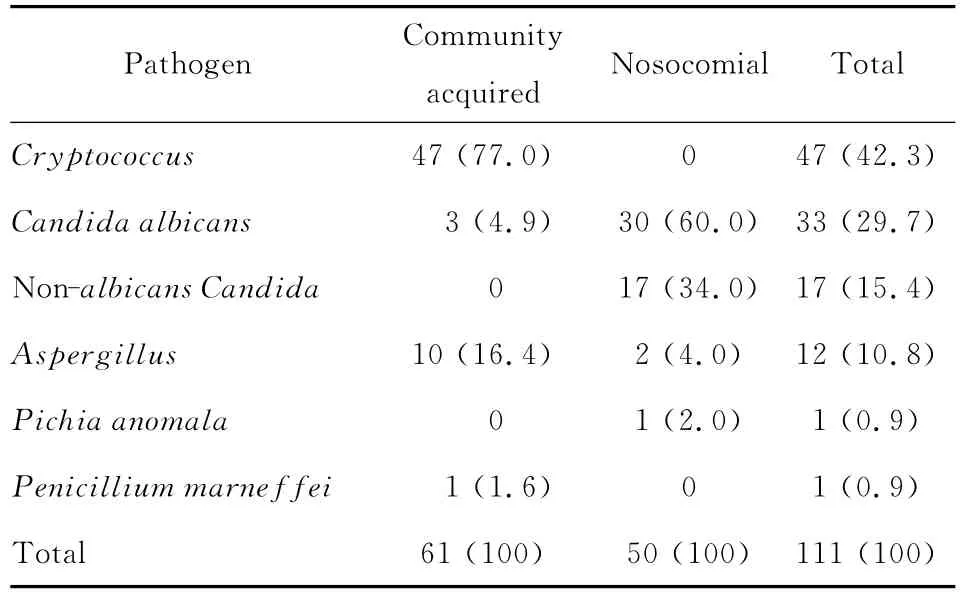
表7 社区获得性感染和医院感染的病原菌分布[n(%)]Table 7 Pathogen distribution of community acquired versus nosocomial fungal infections[n(%)]
(三)基础疾病 社区获得性感染患者中41.0%存在基础疾病。常见的包括糖尿病、肝硬化、自身免疫性结缔组织病、HIV感染、移植术后等,并都在近期内服用激素和(或)免疫抑制剂。
医院感染患者中100%存在基础疾病,常见为实体肿瘤、颅脑外伤、脑血管意外等。
(四)诱发因素 社区获得性感染的患者中,仅30.0%患者有明确的诱发因素,依次为:低白蛋白血症、应用激素、应用免疫抑制剂(其中1例肝肾联合移植患者在移植术后1个月曾发生肺部巨细胞病毒感染)、禽鸟稻草接触史、HIV感染低CD4细胞计数、腹膜透析。
医院感染患者97.0%存在诱发因素,包括:①住院时间长,平均住院天数47 d,感染发生中位时间为住院第22天;②经历手术者30例,占60%;③深静脉置管超过1周者27例,占54.0%;④广谱抗菌药物使用时间超过7 d者31例,占62.0%;⑤留置导尿管者22例,占44%;⑥其他侵袭性操作24例,包括脑室-腹腔分流术(V-P)、内镜逆行胰胆管造影(ERCP)术、胆总管探查术、狐臭切除术;⑦接受糖皮质激素和(或)免疫抑制剂者13例,占26%;⑧其他如机械通气者19例(38.0%)、急性胰腺炎2例(1例为颅脑术后并发急性胰腺炎、1例为急性胰腺炎发作入院)、粒细胞缺乏2例、巨细胞病毒感染1例、低白蛋白血症3例。
五、治疗与转归
(一)治疗 59例白念珠菌感染患者中41例应用氟康唑治疗。27例非白念珠菌感染中12例应用氟康唑治疗,其余应用伊曲康唑、伏立康唑等药物。隐球菌感染中,中枢神经系统感染患者多数应用两性霉素B联合氟胞嘧啶或氟康唑治疗。肺部感染1例以氟康唑治疗,1例以伏立康唑治疗。曲霉病统计的11例患者中,6例以伏立康唑治疗(其中1例脑曲霉脓肿联合手术治疗),4例应用伊曲康唑治疗,1例应用两性霉素B治疗。马尼菲青霉感染患者以氟康唑治疗无效后改伊曲康唑治疗。异常毕赤酵母感染患者以氟康唑治疗无效后改卡泊芬净治疗。
(二)转归 111例侵袭性真菌病患者死亡16例,病死率为14.4%,痊愈或好转61例(55.0%),病情反复4例(3.6%),自动出院7例(6.3%),失访23例(20.7%)。
1.不同起病场所的病死率:医院侵袭性真菌病病死率为18%(9/50),社区获得性侵袭性真菌病病死率为11.5%(7/61),差异无统计学意义(P=0.176)。
2.不同病原菌感染的病死率:病死率由高到低依次为曲霉病33.3%、念珠菌病18.0%(包括白念珠菌21.2%、非白念珠菌11.8%)、隐球菌病4.2%。见表8。1例异常毕赤酵母血流感染死亡。1例马尼菲青霉血流感染好转。但是部分菌种感染失访率较高,影响病死率的统计。
本研究16例死亡患者均伴有严重的基础疾病,如重大外科手术(颅脑肿瘤、颅脑外伤及脑血管意外术后5例)、HIV感染、糖尿病、肿瘤、慢乙肝、化疗、一些侵袭性操作(V-P分流术)、异物置入(心瓣膜置换术2例)、近期使用激素和(或)免疫抑制剂史。

表8 不同病原菌感染的转归[n(%)]Table 8 Patient outcome of different fungal infections[n(%)]
六、药敏试验结果
(一)念珠菌属 分离的33株白念珠菌对两性霉素B、氟胞嘧啶、氟康唑、伊曲康唑、伏立康唑及卡泊芬净的耐药情况见表9。17株非白念珠菌对6种抗真菌药物的药敏结果见表10。
(二)隐球菌 47例病例中分离的隐球菌中3株保存不善死亡,共收集44株,其中1株为土生隐球菌,分离自脑脊液,其余43株为新型隐球菌。药敏结果见表11。5株隐球菌均分离自脑脊液,对氟康唑、伊曲康唑、伏立康唑耐药。唯一1株土生隐球菌对两性霉素B、氟胞嘧啶、氟康唑、伊曲康唑、伏立康唑均敏感。
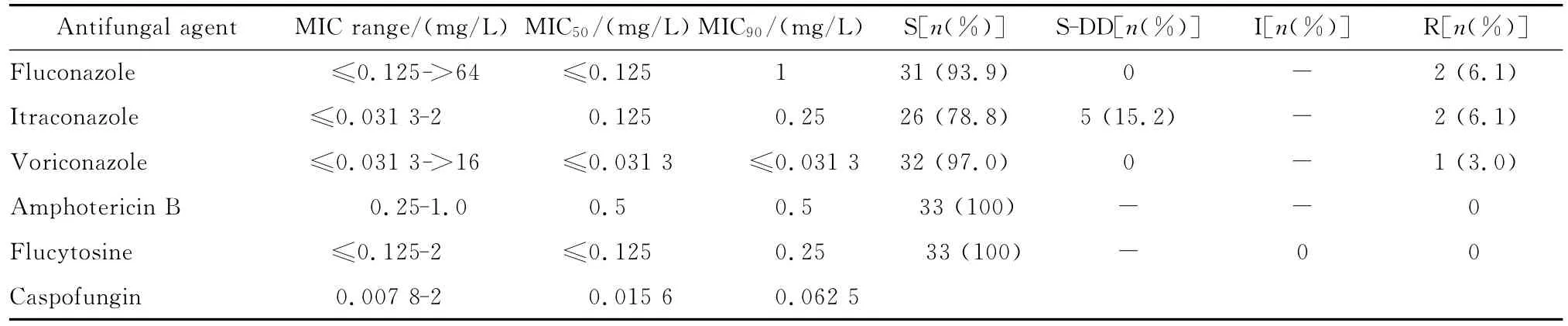
表9 6种抗真菌药物对33株白念珠菌的抗菌活性Table 9 The in vitro activity of six antifungal agents against 33 strains of Candida albicans in terms of minimum inhibitory concentration
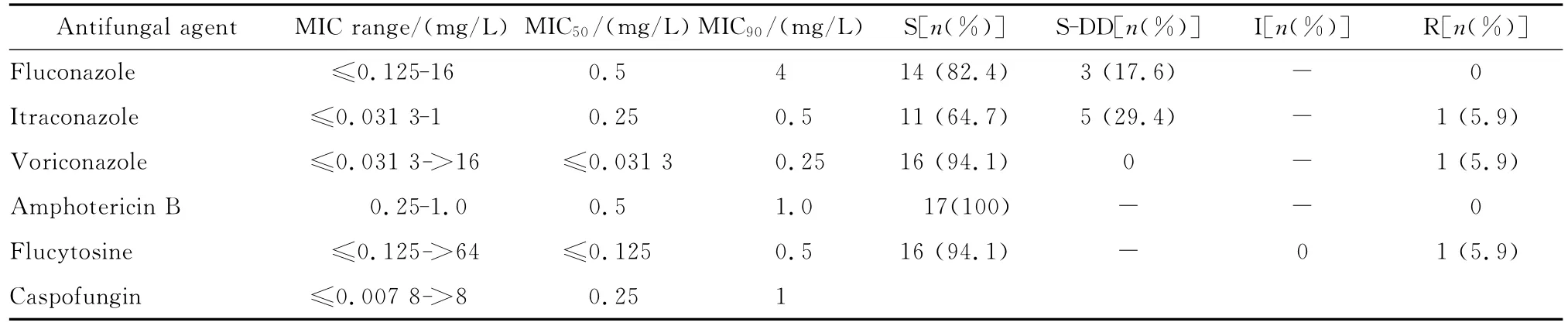
表10 6种抗真菌药物对17株非白念珠菌的抗菌活性Table 10 The in vitro activity of six antifungal agents against 17 strains of non-albicans Candida in terms of minimum inhibitory concentration
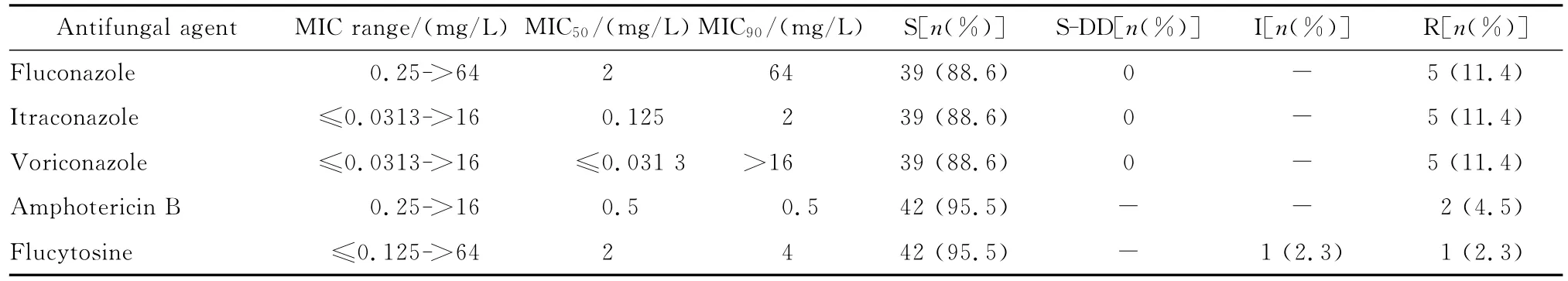
表11 5种抗真菌药物对44株隐球菌的抗菌活性Table 11 The in vitro activity of five antifungal agents against 44 strains of Cryptococcus in terms of minimum inhibitory concentration
讨 论
一、侵袭性真菌病的感染部位
本研究结果显示侵袭性真菌病的感染部位以血流感染最为常见,占45.9%,其次为中枢神经系统感染和肺部感染,分别占39.6%和12.6%。国外文献报道侵袭性真菌病最常见为血流感染,其次为肺部感染[2-3],据国内文献报道深部真菌病以呼吸道感染最常见[4]。本研究结果中枢神经系统感染居第2位,造成此差异的原因考虑我院传染科、神经内科等相关科室收治外院转入的隐球菌脑膜炎患者较多,故中枢神经系统感染比例明显高于其他文献报道。
二、侵袭性真菌病的病原学及临床特点
本系列111例侵袭性真菌病的病原分布依次为念珠菌(45.0%)、隐球菌(42.3%)、曲霉(10.8%)。与文献相比,就常见的病原菌分布及各系统感染特点而言,本组血流感染的病原菌以念珠菌属最常见,占96.0%,与文献报道相似[2,5-7]。
据文献报道隐球菌感染最常见侵犯部位为肺部及中枢神经系统[8]。本研究中隐球菌最常见的感染部位为中枢神经系统,占91.5%。但隐球菌肺部感染仅4例,占8.5%。本组患者中,隐球菌中枢神经系统感染比例明显高于肺部感染,其原因主要考虑与上述本院各科特色有关。有关隐球菌感染与机体免疫状态的关系也是目前侵袭性真菌病中值得关注的问题,本组隐球菌感染病例中除2例HIV感染者外,多数为免疫功能正常者。不同于以往认为隐球菌感染常发生于免疫缺陷人群尤其是艾滋病患者。国外文献调查也发现隐球菌感染者中有相当一部分为免疫功能正常者,占31.3%[8]。
曲霉病在本研究病例中占10.8%,次于念珠菌病和隐球菌病,而与国外文献相比[2],本研究曲霉病在侵袭性真菌病中所占比例相对较少,其原因考虑与曲霉病的易感人群有关。国外侵袭性曲霉病大多数发生于器官移植受者中,约2/3的侵袭性曲霉病患者为血液系统疾病患者或器官移植受者[2,9],而本院移植患者较少,曲霉病12例患者中仅2例为移植患者。本组曲霉主要引起肺部感染,而且肺部感染的病原真菌中也以曲霉最多见,此与国外文献报道相一致[2-3,9-10];但与国内许多文献报道肺部感染以念珠菌属最常见截然不同,其原因考虑因本组病例入选严格参考侵袭性真菌诊断标准纳入的病例均为确诊或拟诊,无疑似病例,标本排除了呼吸道定植菌的因素。虽然痰液中培养出念珠菌很常见,但非免疫缺陷患者侵袭性念珠菌肺炎很罕见[11-12]。el-Ebiary等[13]通过对25例ICU患者的尸体解剖发现,10例生前念珠菌培养阳性,但尸解仅2例确诊为念珠菌肺炎。
三、侵袭性真菌病的病死率
据报道侵袭性真菌病的病死率高,如侵袭性念珠菌病的病死率10.0%~49.0%[2],侵袭性曲霉病在各种类型的器官移植受者中病死率高达52.0%~92.0%[9]。但本研究111例侵袭性真菌病患者病死率为14.4%,其中曲霉病的病死率为33.3%、念珠菌病病死率为18.0%、隐球菌病病死率仅为4.2%。病死率与文献报道相比明显为低,考虑差异的原因:本研究中隐球菌感染大部分为社区感染,且无免疫缺陷状态,故治疗有效率高,病死率低;其次是本组病例中虽病死率低,但好转率也仅为55.0%,自动出院及部分失访的患者也属疗效不满意或可能死亡者,因而影响病死率统计。
四、药敏试验结果分析
药敏试验结果显示,白念珠菌对氟康唑及伏立康唑的敏感率均在90.0%以上,对伊曲康唑的敏感率则为78.7%。与白念珠菌相似,非白念珠菌对伊曲康唑的敏感率也明显低于其他吡咯类药物,敏感率为64.7%。但白念珠菌对伊曲康唑的耐药率仅为6.0%,与其对氟康唑的耐药率相同,主要是剂量依赖性敏感株明显增多。此结果与文献报道伊曲康唑抗菌活性等同或略高于氟康唑有明显差异[14-15]。原因考虑CLSI中伊曲康唑的临界浓度判断仅是根据口腔黏膜等表浅部位分离的念珠菌MIC与临床结果的关系制定的,而确有报道吡咯类对各部位分离的念珠菌的 MIC不同[16],故此临界浓度判断标准可能并不适用于深部分离的念珠菌。而且本研究中伊曲康唑对念珠菌属的MIC范围为≤0.031 3~2 mg/L,MIC90为0.5 mg/L,仍显示良好的抗菌活性。另外本组菌株数少,尤其是非白念珠菌只有17株,代表性欠佳。
[1] De Pauw Ben,Walsh TJ,Donnelly JP,et al.Revived definitions of invasive fungal disease from the European Organiza-tion for Research and Treatment of Cancer/Invasive fungal diseases Cooperative Group and the National Institution of Allergy and Infectious Diseases Mycoses Study Group(EORTC/MSG)Consensus Group[J].Clin Infect Dis,2008,46(12):1813-1821.
[2] Pfaller MA PP,Wingard JR.Invasive fungal pathogen:current epidemiological trends[J].Clin Infect Dis,2006,43(1):s3-s14.
[3] Fridkin SK.The changing face of fungal infections in health care setting[J].Clin Infect Dis,2005,41(10):1455-1460.
[4] 栗芳,王清涛,杜小玲,等.医院内深部真菌病的临床分布和药敏结果[J].中华医院获得感染学杂志,2006,16(4):445-447.
[5] Trick WE,Fridkin SK,Edwards JR,et al.Secular trend of hospital-acquired candidemia among intensive care unit patients in the United States during 1989-1999[J].Clin Infect Dis,2002,35(5):627-630.
[6] Tortorano AM,Peman J,Bernhardt H,et al.Epidemiology of candidaemia in Europe:results of 28-month European Confederation of Medical Mycology(ECMM)hospital-based surveillance study[J].Eur J Clin Microbiol Infect Dis,2004,23(4):317-322.
[7] Almirante B,Rodriguez D,Park BJ,et al.Epidemiology and predictors of mortality in cases of Candida bloodstream infection:results from population based surveillance,barcelona,Spain,from2002 to 2003[J].J Clin Microbiol,2005,43(4):1829-1835.
[8] Chen S,Sorrell T,Nimmo G,et al.Epidemiology and hostand variety dependent characteristics of infection due to Cryptococcus neoformans in Australia and New Zealand.Australasian Cryptococcal Study Group[J].Clin Infect Dis,2000,31(2):499-508.
[9] Singh N,Paterson DL.Aspergillus infections in transplant recipients[J].Clin Microbiol Rev,2005,18(1):44-69.
[10] 曹木英,纪小龙,谭汉君,等.75例深部真菌病尸体解剖及临床分析[J].北京医学,1994,16(1):47-48.
[11] 王辉,曹彬.真菌体外鉴定和药敏试验的临床意义[J].中华结核和呼吸杂志,2006,29(5):291-293.
[12] Pappas PG.Invasive Candidiasis[J].Infect Dis Clin North Am,2006,20(3):485-506.
[13] el-Ebiary M,Torres A,Fabregas N.Significance of the iso-lation of Candida species from respiratory samples in critically ill,non-neutropenic patients.An immediate postmortem histologic study[J].Am J Respir Crit Care Med,1997,156(2 Pt 1):583-590.
[14] Tortorano AM,Prigitano A,Biraghi E,et al.The European Confederation of Medical Mycology(ECMM)survey of candidaemia in Italy:in vitro susceptibility of 375 Candida albicans isolates and biofilm production[J].J Antimicrob Chemother,2005,56(4):777-779.
[15] Seifert H,Aurbach U,Stefanik D,et al.In vitroactivities of isavuconazole and other antifungal agents against Candida bloodstream isolates[J].Antimicrob Agents Chemother,2007,51(5):1818-1821.
[16] Pfaller MA,Diekema DJ,Mendez M,et al.Candida guilliermondii,an opportunistic fungal pathogen with decreased susceptibility to fluconazole:geographic and temporal trends from the ARTEMIS DISK antifungal surveillance program[J].J Clin Microbiol,2006,44(10):3551-3556.
[17] Perkins A,Gomez-Lopez A,Mellado E,et al.Rates of antifungal resistance among Spanish clinical isolates of Cryptococcus neoformans var.neoformans[J].J Antimicrob Chemother,2005,56(6):1144-1147.
[18] Yildiran ST,Fothergill AW,Sutton DA,et al.In vitro susceptibilities of cerebrospinal fluid isolates of Cryptococcus neoformans collected during a ten-year period against fluconazole,voriconazole and posaconazole(SCH56592)[J].Mycoses 2002,45(9-10):378-383.
[19] Panackal AA,Gribskov JL,Staab JF,et al.Clinical significance of azole antifungal drug cross-resistance in Candida glabrata[J].J Clin Microbiol,2006,44(5):1740-1743.
[20] Pfaller MA,Messer SA,Boyken L,et al.Geographic variation in the susceptibilities of invasive isolates of Candida glabratato seven systemically active antifungal agents:aglobal assessment from the ARTEMIS Antifungal Surveillance Program conducted in2001 and2002[J].J Clin Microbiol,2004,42(7):3142-3146.
[21] Drago M,Scaltrito MM,Morace G.In vitro activity of voriconazole and other antifungal agents against clinical isolates of Candida glabrata and Candida krusei [J].Eur J Clin Microbiol Infect Dis,2004,23(8):619-624.

