多层螺旋CT在边缘不足房间隔缺损介入治疗中的应用
孙守刚,白 锋,赵 锋,王琼英,胡 浩
房间隔缺损(atrial septal defect,ASD)是最常见的先天性心脏病,占成人先天性心脏病的30%~40%,以往外科手术是其唯一的治疗方法,随着介入技术的发展,在经胸超声心动图(transthoracic echocardiography,TTE)引导下介入封堵已成为治疗ASD的重要方法之一。ASD介入封堵术的关键技术是准确定量测量ASD的大小、边缘状况和邻近组织的关系,以及选择大小合适的封堵器[1]。但TTE受声窗、胸骨及诊断人员技术的限制,易造成诊断及测量上的不准确,甚至漏诊,从而使部分ASD患者丧失介入封堵机会或使介入封堵失败。
随着多层螺旋CT(multi-slice computed tomography,MSCT)及三维重建技术的发展,MSCT横断扫描避免了图像重叠,有利于观察心内解剖及心腔与大血管关系,MSCT已经逐步成为诊断先天性心脏病的新方法[2]。本研究对16例边缘不足ASD患者行TTE及MSCT检查,探讨MSCT在边缘不足ASD介入治疗中的优势和临床应用价值。
1 材料与方法
1.1 临床资料
2010年1月至2012年7月,我科收治16例经TTE诊断为继发型ASD伴部分边缘缺乏或边缘 <5 mm患者,其中主动脉侧缘不足4例,左房后上缘不足2例,左房后壁缘不足2例,上腔静脉侧缘不足3例,下腔静脉侧缘不足4例,左房后壁缘合并下腔静脉侧缘不足1例。16例中男7例,女9例,年龄6~55岁,体重10~66 kg,术前均行MSCT检查,缺损口均离心脏主要结构房室瓣、冠状静脉窦口、肺静脉 ≥5 mm,剔除合并其他心血管畸形、重度肺动脉高压并已导致右向左分流者。
1.2 方法
1.2.1 TTE检查 使用GE Vivid E9型超声诊断仪,探头频率为3~5 MHz,术前检查一般采用多普勒仪自然组织谐波功能,以便清晰显示ASD周缘软硬程度及ASD确切大小,检查主要切面及观察项目包括:①胸骨旁四腔切面:测量ASD后上前下径,ASD后上缘及前下缘。②大血管短轴切面:测量ASD前后径,ASD主动脉侧缘及后壁缘。③剑突下上腔静脉长轴切面:主要测量ASD上下径及ASD缘至上腔静脉入口处的距离。④剑突下上腔静脉长轴略偏左切面:主要测量ASD下缘至下腔静脉入口处的距离,若此切面ASD下缘直至下腔静脉入口处,则为下腔型。除上述固定切面外,应多切面连续扫查获取ASD最大径。
1.2.2 MSCT检查及后处理 采用Siemens Sensation 64层MSCT扫描仪,对于不能合作的患儿,检查前口服10%水合氯醛镇静(0.5~0.8 ml/kg体重),待其睡着后行MSCT增强扫描。对于不能配合屏气或(和)明显心律不齐及心率 >90次/min患者,不使用心电门控,采用快速扫描大血管成像模式。扫描参数为:120 kV,100~700 mA,准直器宽度0.625 mm,螺距 0.5,旋转扫描时间0.5 s/r,重建层厚0.625 mm。若患者能配合屏气,且心律规整,心率<90次/min,采用心电门控下的心脏成像模式。扫描参数为:120 kV,准直器宽度0.625 mm,螺距0.34,旋转扫描时间0.35 s/r。对比剂使用非离子型的欧乃派克(370 mg I/ml),总量 1.2~2 ml/kg,注射速率1.0~7.5 ml/s,注射后延迟扫描时间14~35 s。所有患者重建层厚1.0 mm,重建间隔0.7 mm,采用心电门控的患者常规以75%R-R间期重建,在Wizadz工作站进行后处理,后处理方法包括多平面重组(multiple planar reformation,MPR)、最大密度投影(maximum intensity projection,MIP)和容积重组(volume rendering,VR)和VR图像上斜面剪切技术(oblique trim)。按Van Praagh顺序分段诊断心房位置、心室位置、房室间隔及房室连接异常,心室、大动脉连接异常和大血管异常等。
1.2.3 介入治疗方法 对小于7岁不配合患儿采用插管氯胺酮全麻,其余患者为局部麻醉,穿刺右股静脉置入鞘管,行常规右心导管检查,根据ASD大小及ASD距周边各缘的距离选择比MSCT测得ASD最大径大4~6 mm的封堵器(北京华医圣杰医疗器械公司生产)型号进行封堵。TTE及X线实时监测下引导放置封堵器,TTE通过四腔心切面、大动脉短轴切面、双房上下腔静脉切面,实时引导封堵器推送鞘管,经ASD进入左房,指导释放左房侧伞,确定左房侧伞位于左房并平行于房间隔时,引导推送鞘管回撤,使左房侧伞贴近ASD左房面,同时释出封堵器腰部,推送鞘管回撤至右房,释出右房侧伞封紧ASD,反复推送、牵拉牵引导丝,检查封堵器牢固性。在确定封堵器位置稳定、塑性良好、周围结构功能不受影响、无明显残余分流后,指导释放封堵器,撤除推送鞘管。释放封堵器后,即刻TTE各切面观察封堵效果。具体过程同文献[3]报道。
1.3 统计学分析
采用SPSS13.0软件进行统计学分析。所有数据以均数±标准差表示,分别计算术前TTE、MSCT测量所得的ASD直径与术中封堵器大小的相关性,计算相关系数r、相关系数的显著性检验相关系数界值表,P<0.05为差异有统计学意义。
2 结果
TTE和MSCT测得16例ASD患者的不同类型ASD直径及各边缘宽度见表1和表2。TTE测得ASD直径 6~30 mm,平均(17.68±7.80)mm;MSCT测得ASD直径6~33 mm,平均(19.62±9.33)mm;封堵器直径9~40 mm,平均(24.50±10.02)mm。术前TTE测得ASD值与ASD封堵器直径相关系数r=0.71(P<0.05),MSCT测得ASD值与ASD封堵器直径相关系数r=0.99(P<0.01)。显然MSCT测得的ASD直径与ASD封堵器直径相关性较好。
15例患者封堵成功,1例失败(TTE测量仅为下腔静脉侧缘不足,MSCT显示为左房后壁缘合并下腔静脉侧缘不足,缺损直径为33 mm,置入40 mm封堵器仍未成功,因当时无更大封堵器放弃封堵,转外科手术治疗)。1例患者因反复胸闷、气短、下肢水肿,在多家医院多次行TTE均未能诊断为ASD,MSCT明确诊断为下腔型ASD并成功封堵,MSCT还发现2处其他异常,1例为肺动脉畸形引流,另1例为右冠状动脉肺动脉瘘。2例TTE测量下腔缘分别为0及显示不清,但MSCT均清楚显示下腔缘分别为2、3 mm。所有患者在治疗前后无相关并发症发生。图1为1例ASD患者术前及术后MSCT图像。

表1 TTE、MSCT测得不同类型ASD直径(mm)
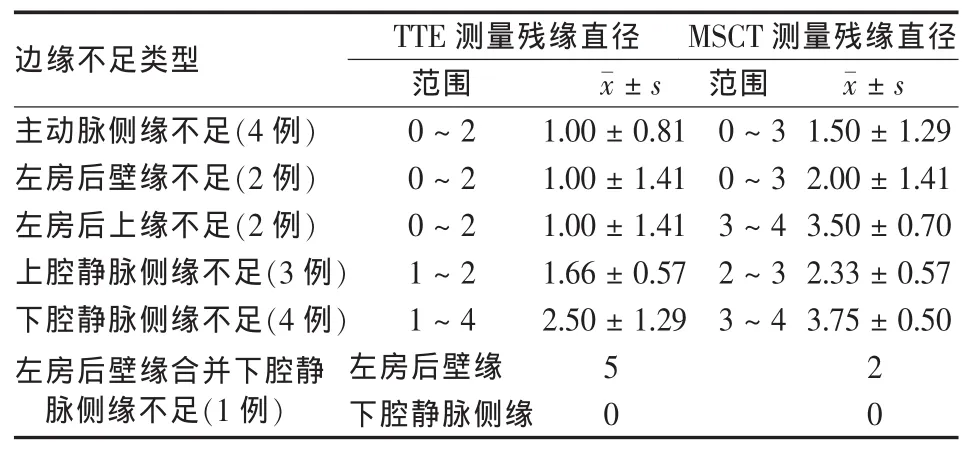
表2 TTE、MSCT测得不同类型ASD边缘宽度(mm)
3 讨论
经导管封堵继发孔型ASD已成为ASD治疗的主要方法[4],该方法具有创伤小、恢复快、不留瘢痕、操作简单、成功率高等优点。ASD周围有足够的边缘大于5 mm则是介入治疗的必备条件[5]。但随着先天性心脏病介入治疗器材的不断改进及介入治疗技术的提高,经导管封堵ASD的适应证不断拓宽,许多特殊类型的ASD(如巨大型ASD、短残边ASD、多孔型ASD、伴房间隔瘤ASD及合并其他心脏畸形的ASD等)均可通过介入治疗手段获得根治[6-8]。无论哪种类型的ASD,成功封堵的关键是准确定量测量ASD的大小及边缘状况,选择合适的封堵器。常规方法是利用TTE对患者进行初步筛选,测量ASD大小及边缘状况,但TTE有时受声窗制约,对远离心脏的大血管显示不佳,易受诊断人员个人技术的影响,造成诊断不清或测量数据不准确,尤其对下腔静脉缘的测量更是如此,最终导致放弃封堵治疗或封堵手术失败,下腔静脉残端边缘缺乏被认为是封堵失败的预测因子[9]。即便在非常有经验的医学中心,由于不准确的TTE评价,使20%~30%ASD患者遭受不当的介入治疗[10]。

图1 上腔静脉缘不足ASD患者术前及术后MSCT图像
随着MSCT及三维重建技术的发展,MSCT已逐步成为诊断先天性心脏病的新方法,MSCT横断扫描避免了图像重叠,有利于观察心内解剖及心腔与大血管关系,三维重组技术的效果与造影相仿,可直观地显示心脏大血管连接、大血管形态及空间位置关系,同时发现并发的内脏改变,对内脏转位等复杂心血管畸形的节段分析均有其重要价值。MSCT扫描速度快,重建图像质量高,可多角度、多方位地显示病变的空间位置,这些已成为无创性心血管检查最具潜力和价值的检查方法之一[11]。TTE必要时辅以MSCT,除能对先天性心脏病作出准确诊断和精确测量,MSCT还能弥补TTE的许多不足,尤其在测量下腔静脉缘和后缘时,准确性更高,效果更好。吴越等[12]报道并经手术证实,MSCT对心外大血管畸形及复杂先天性心脏病的诊断准确率分别为97.08%和97.0%,若与TTE联合可提高诊断准确率至98.7%。
在本研究16例ASD患者中,TTE漏诊1例,而MSCT对16例患者均作出了明确诊断,同时发现肺静脉畸形引流、右冠状动脉肺动脉瘘各1例。MSCT对ASD直径测量的准确性优于TTE,ASD封堵器与MSCT测量的ASD直径有更好的相关性。15例单一边缘不足患者均成功进行封堵,1例未成功,考虑与巨大ASD同时合并下腔缘及后缘不足有关,与文献报道的下腔静脉残端边缘缺乏是封堵失败的预测因子相符[9]。对于伴有部分短残边ASD患者进行介入治疗时,释放封堵器前要仔细进行TTE检查,若见封堵器呈Y型夹持在升主动脉的后壁,则封堵器一般稳定牢靠,但Y形合抱不能影响主动脉瓣开放和关闭,以合抱不超过主动脉周径的1/5为妥,且随心跳搏动时与主动脉无相对运动,以免发生封堵器与主动脉根部磨擦造成主动脉心房瘘的远期并发症[13]。我们建议对于TTE诊断为边缘不足或图像不清时,常规行MSCT明确诊断及精确测量ASD大小及边缘状况,以提高介入封堵的成功率。本文仅观察了16例患者,样本量较少,说服力有限,还有待扩大样本进一步研究。
[1]Karamlou T,Diggs BS,Ungerleider RM,et al.The rush to atrial septal defect closure:is the introduction of percutaneous closure driving utilization? [J].Ann Thorac Surg,2008,86:1584-1590.
[2]Lee T,Tsai IC,Fu YC,et al.Using multidetector-row CT in neonates with complex congenital heart disease to replace diagnostic cardiac catheterization for anatomical investigation:initial experiences in technical and clinical feasibility [J].Pediatr Radiol,2006,36: 1273-1282.
[3]张玉顺,张 军,代政学,等.经胸超声心动图和X线透视引导下行房间隔封堵术 [J].中华放射学杂志,2003,37:356-359.
[4]Berger F,Ewert P,Abdul-Khaliq H,et al.Percutaneous closure of large atrial septal defects with the Amplatzer Septal Occluder:Technical overkill or recommendable treatment [J].J Interv Cardiol,2001,14: 63-67.
[5]中国医师协会心血管内科分会先心病工作委员会.常见先天性心脏病介入治疗中国专家共识—房间隔缺损介入治疗[J].介入放射学杂志,2011,20:3-9.
[6]张玉顺,代政学,王 垒,等.边缘不足房间隔缺损的介入治疗评价[J].心脏杂志,2005,17: 265-267.
[7]骆志玲,沈 艳,顾 云,等.超声心动图在特殊类型房间隔缺损封堵术中的应用 [J].中国医学影像技术,2009,25:1021-1024.
[8]López-Fernández T,Gómez de Diego JJ,Monedero MC,et al.Aortic wall erosion after percutaneous closure of atrial septal defect[J].J Am Soc Echocardiogr,2011,24: 227.e5-227.e8.
[9]Demkow M,Ruzyllo W,Konka M,et al.Transvenous closure of moderate and large secundum atrial septal defects in adults using the Amplatzer septal occluder [J].Catheter Cardiovasc Interv,2001,52:188-193.
[10]Tworetzky W,McElhinney DB,Brook MM,et al.Echocardiographic diagnosis alone for the complete repair of major congenital heart defects[J].J Am Coll Cardiol,1999,33: 228-233.
[11]Goo HW,Park IS,Ko JK,et al.Computed tomography for the diagnosis of congenital heart disease in pediatric and adult patients[J].Int J Cardiovasc Imaging,2005,21: 347-365.
[12]吴 越,梁长虹,杨本强,等.先天性心脏病复杂畸形的影像学诊断[J].放射学实践,2010,25: 393-396.
[13]Chun DS,Turrentine MW,Moustapha A,et al.Development of aorta-to-right atrial fistula following closure of secundum atrial septal defect using the Amplatzer septal occluder [J].Catheter Cardiovasc Interv,2003,58:246-251.

