Ni2+掺杂Ti/SnO2-Sb2O5 电极的制备及性能
陈 野 许维超 段体岗
(哈尔滨工程大学材料科学与化学工程学院,哈尔滨 150001)
电化学水处理技术是一种清洁的水处理工艺,对有机污染物的去处效率较高,并且操作简单、反应条件温和、无二次污染,所以其应用潜力很大[1-6]。电催化电极作为电化学水处理技术的核心部分,而受到了广泛的关注。在众多的电催化电极中,Ti/SnO2-Sb2O5电极具有很强的产生·OH 的能力,可以对有机物进行直接氧化、间接氧化,并且制备成本较低,所以备受研究者的青睐[7-14]。为了进一步提高Ti/SnO2-Sb2O5电极的稳定性和催化性能,国内外工作者进行了许多研究,其中有关稀土掺杂改性的研究较多[15-20],研究表明部分稀土掺杂可以提高电极的催化性能。另外,还有研究表明以部分过渡金属元素作为中间层加入可以提高Ti/SnO2-Sb2O5电极的稳定性[21-22]。但目前以过渡金属元素对Ti/SnO2-Sb2O5电极活性层进行掺杂改性的研究较少,本文采用溶胶凝胶法[23-24]以过渡金属元素Ni 对Ti/SnO2-Sb2O5电极进行掺杂改性,并对其形貌、结构、电催化性能、寿命进行了分析表征。
1 实验部分
1.1 电极的制备
钛板(厚0.5 mm)用砂纸(180#)反复打磨光亮后,剪切成规格为85 mm×10 mm×0.5 mm 的钛板,在90 ℃的10wt% NaOH 溶液中碱洗1 h,然后用5wt%的HF 刻蚀,最后保存在4wt%的草酸中备用。
将11.3 g 的SnCl2·2H2O、1.27 g 的SbCl3分 别溶于100 mL、50 mL 无水乙醇中,先分别沸腾冷凝回流2 h,然后再混合沸腾冷凝回流2 h,最后在40℃恒温水浴锅中陈化,即得到含锡锑的淡黄色溶胶。按不同比例称取Ni(NO3)2·6H2O 并将其溶于20 mL 无水乙醇,然后加入到制得的锡锑溶胶中混匀,再陈化一段时间即得到绿色的含Ni2+的锡锑溶胶。将处理好的钛板用浸渍提拉机在含Ni2+的锡锑溶胶中提拉涂膜,涂4 层后在100 ℃的烘箱中干燥10 min,然后在350 ℃电炉中煅烧15 min,反复涂膜煅烧15 次,最后一次在600 ℃条件下煅烧2 h,即得到Ni2+掺杂的Ti/SnO2-Sb2O5电极。因为Ni2+是Ni 离子最稳定的价态,无须严格控制价态即可得到[25]。
1.2 电极的活性层的表征
采用JSM-6480 型扫描电子显微镜(日本电子公司) 对电极活性层的表面形貌和结构组成进行了分析,其中加速电压为20 kV。XRD 测试是在D/Max2500 型X 射线衍射仪(日本岛津) 上Cu 靶Kα线、管电压40 kV、管电流150 mA 条件下完成的,2θ 范围为20°~80°。
1.3 电极的电催化性能测试
以100 mg·L-1的苯酚溶液100 mL 为目标有机物,用0.25 mol·L-1的Na2SO4溶液为支持电解质,制备电极作为阳极,钛板作为阴极,在20 mA·cm-2恒定电流密度下电解。根据GB7490-87 采用标准4-氨基安替比林直接分光光度法测定苯酚浓度。
电极的加速寿命测试
加速寿命试验是利用CHI760C 型电化学工作站,在0.25 mol·L-1的Na2SO4溶液中,电流密度为0.1 A·cm-2条件下进行的,记录电极电压变化超过5 V 的时间,即为电极的强化寿命。
2 结果与讨论
2.1 电极的XRD 分析
图1 是Ti/SnO2-Sb2O5和Ni2+掺杂的Ti/SnO2-Sb2O5电极的XRD 图。由图可知,电极涂层与四方金红石相SnO2的PDF 标准卡片(41-1445)数据基本相符,表明涂层中的SnO2是四方金红石结构,其主要衍射峰所对应的晶面指数已在图中标出。由于在图中没有发现Ni 的特征峰,说明Ni2+的掺入没有引入新的物相。Ni2+具有很高的八面体择位能,将尽可能处于八面体晶体场中,而在金红石型SnO2的结构中,Sn4+位于O2-所组成的八面体中,并且Ni2+、Sn4+的半径分别为0.062 nm、0.071 nm,半径差异很小,所以Ni2+很可能以类质同相替换Sn4+的方式进入了SnO2晶格内部。若半径较小的Ni2+进入SnO2晶格中,必然引起金属氧键的键长变短,从而会造成晶胞参数的减小。比较图中a、b 发现掺入Ni2+后衍射峰位置略向高角度区偏移,说明SnO2晶格发生了收缩现象,证明了Ni2+是以类质同相替换Sn4+的方式进入了SnO2晶格内部。
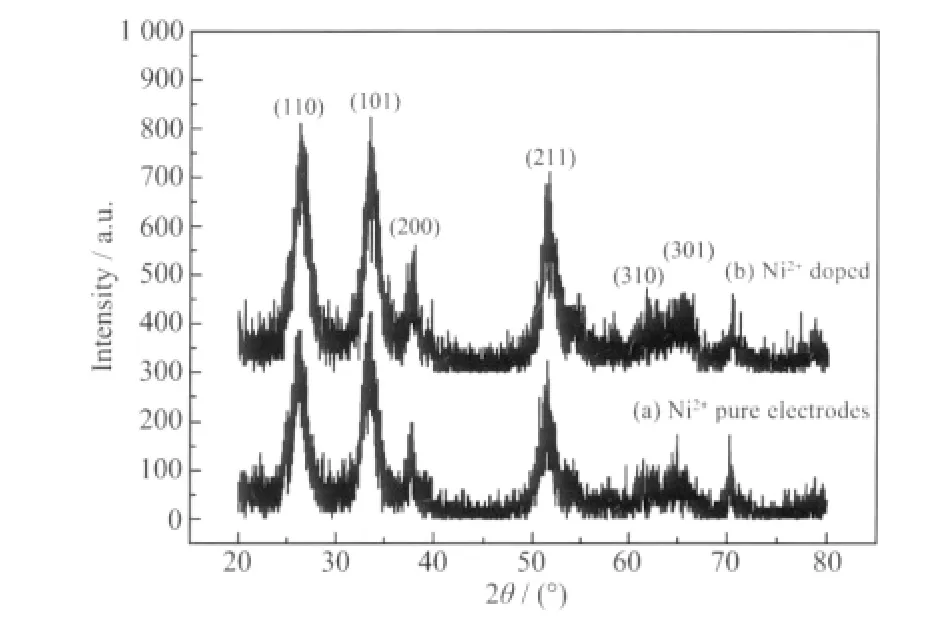
图1 不掺Ni2+和掺Ni2+的Ti/SnO2-Sb2O5 电极的XRD 图Fig.1 XRD patterns of pure Ti/SnO2-Sb2O5electrodes and Ni2+-doped Ti/SnO2-Sb2O5 electrodes
图中可以看出Ni2+的掺入使得SnO2晶相所对应的衍射峰宽变大,由谢乐公式D=Kλ/(β·cosθ)(D为晶粒尺寸,λ 为X 射线波长,β 为衍射半高峰宽,θ为衍射角)可得,在K、λ、θ 近似保持不变,峰宽变大则晶粒尺寸变小。这是因为Ni2+进入到SnO2晶格中后,在晶体结构中产生杂质缺陷,缺陷的出现增大了晶体生长所需的能量,使晶核的生长变得相对困难、缓慢,从而增大了SnO2晶粒的生成速度与生长速度之比,使得SnO2晶粒细化。意味着Ni2+的掺入增大了涂层的比表面积,活性点数量增多,进一步提高了电极的催化活性。
2.2 电极的形貌分析
图2 中(a)、(b)是Ni2+掺杂电极的加速寿命实验前后的表面形貌,(c)、(d)是无Ni2+掺杂的电极加速寿命实验前后的表面形貌,分别比较两组图发现加速寿命后电极氧化物涂层均有不同程度的脱落,表面龟裂程度变大、变深。由此可推断电极失活的原因是电极裂痕内部发生析氧反应,反应产生的气体不断的冲击裂痕使裂痕进一步加深,从而导致钛基体裸露并被氧化。由(a)、(c)比较可以发现,Ni2+掺杂的电极表面裂痕少而且很细小,无Ni2+掺杂的电极表面呈“干泥”状,裂痕较多且大而深。说明Ni2+的掺入有效的改善了电极表面的界面张力,降低了电极表面的龟裂程度。比较(b)、(d)发现加速寿命后Ni2+掺杂的电极表面只是部分脱落,其他部分并未遭到破坏,而无Ni2+掺杂的电极加速寿命后电极表面出现了大面积脱落,表明电极表面越致密、平整越不容易被破坏,相反电极表面龟裂越严重涂层越容易脱落也就易失去活性。
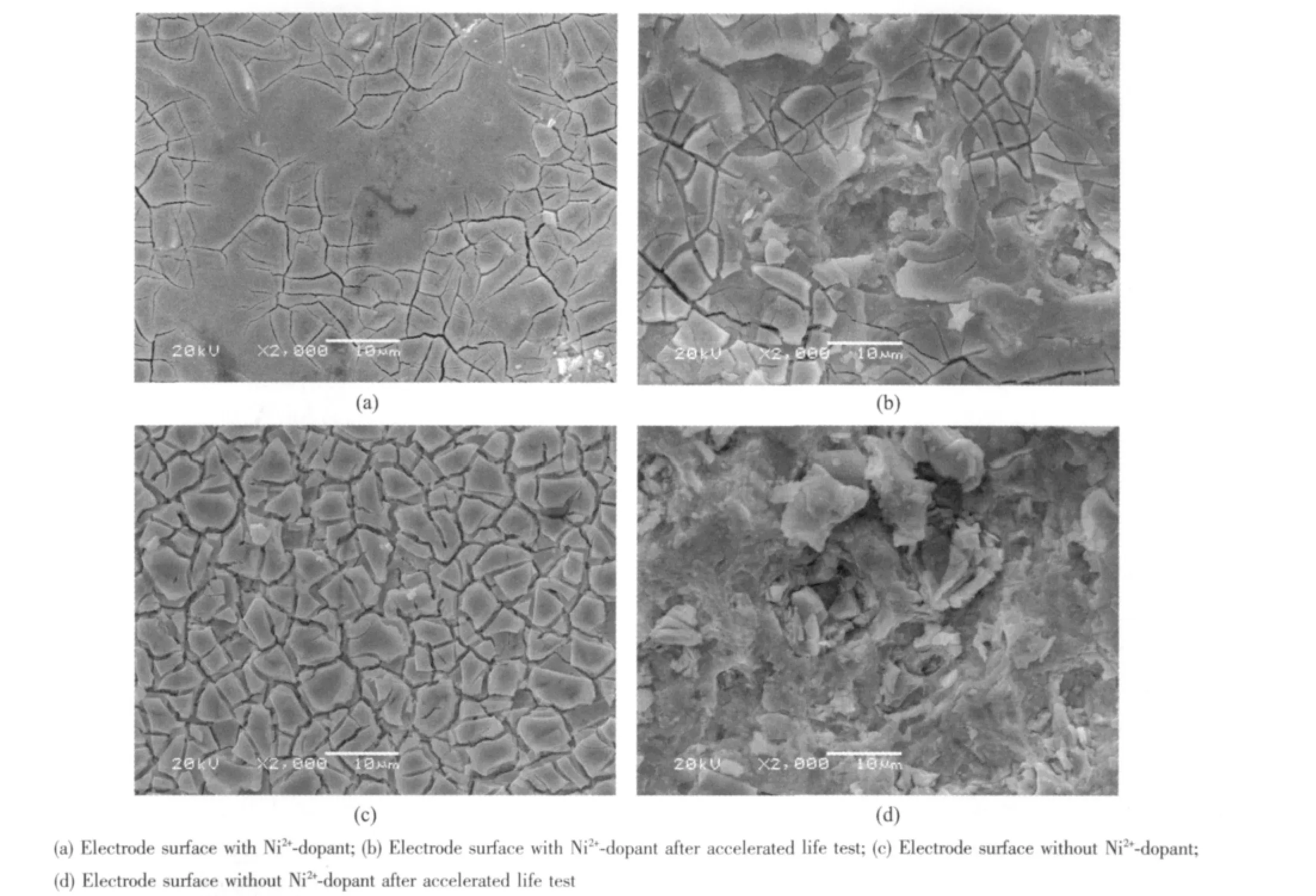
图2 不掺Ni2+和掺Ni2+的Ti/SnO2-Sb2O5 电极的SEMFig.2 SEM images of pure Ti/SnO2-Sb2O5electrodes and Ni2+-doped Ti/SnO2-Sb2O5 electrodes
表1 是电极涂层表面的元素分析,由表1 可知Ni2+掺杂的Ti/SnO2-Sb2O5电极表层中nSb/nSn(物质的量比)为0.503,Ti/SnO2-Sb2O5的nSb/nSn为0.35,并且两种电极的nSb/nSn都大于原溶胶中的nSb/nSn(0.11)。说明Ni2+掺入更促进了Sb 在电极表面出现。
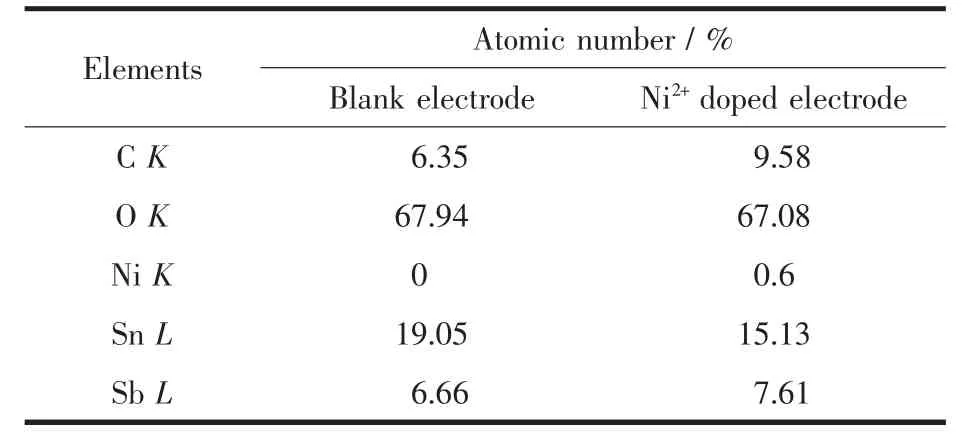
表1 电极涂层中几种主要元素的EDS 结果Table 1 EDS data of prepared electrode
2.3 电极的催化性能
图3 是不同Ni2+掺杂比的Ti/SnO2-Sb2O5电极的苯酚降解曲线。从图3 中可以看出电极的降解效果为Ni2+(6%)>Ni2+(4%)>Ni2+(8%)>Ni2+(2%)>Ni2+(0%),并且Ni2+掺入量为6%(nNi/nSn) 的电极在2 h 时已将苯酚降解完全,Ni2+掺入量为4%的电极在2 h 时降解效果也达到了98.42%,而无Ni2+掺杂的电极若将苯酚降解完全则需5 h 左右,说明Ni2+的掺入大幅提高了电极的电催化性能。
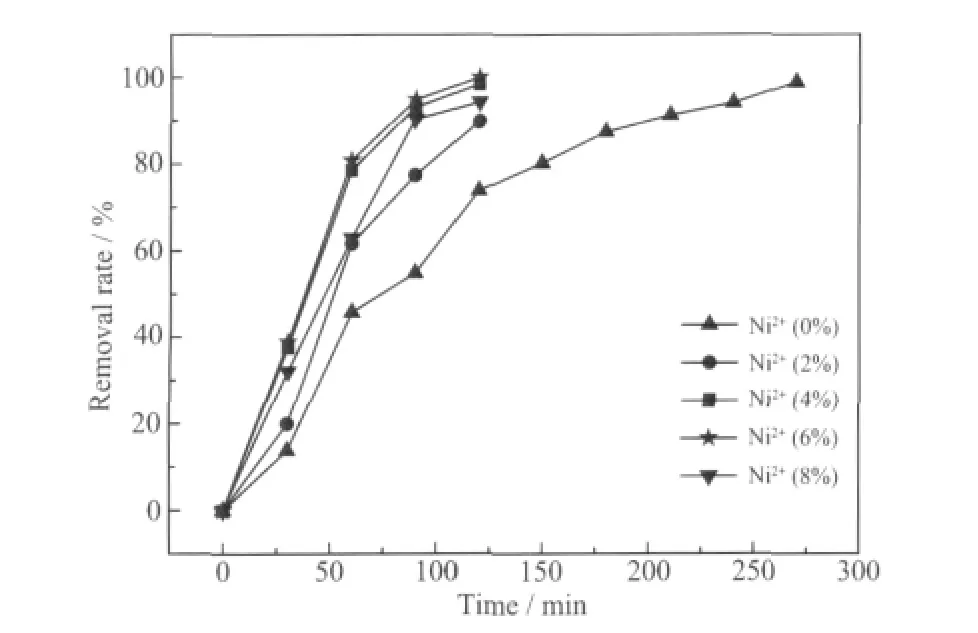
图3 不同Ni2+掺杂比的Ti/SnO2-Sb2O5 电极的苯酚降解曲线Fig.3 Phenol degradation curves of Ti/SnO2-Sb2O5 electrodes with different Ni2+-doped levels
另外,有研究者制备的Fe 掺杂的Ti/SnO2-Sb2O5电极将相同的苯酚降解完全需3 h[26],而Dy 掺杂的Ti/SnO2-Sb2O5电极也需要3 h 才能降解完全[17],还有Ce 掺杂的Ti/SnO2-Sb2O5电极需要2.5 h[27],以及Ti/SnO2-Sb2O5/PbO2电极也在3 h 的时候才将苯酚降解完全[28]。综合比较来看,不论是与其他改性Ti/SnO2-Sb2O5电极相比,还是与不同种类的钛电极相比,Ni2+掺杂的Ti/SnO2-Sb2O5电极都具有较高的催化性能。
在Ti/SnO2-Sb2O5电极的降解过程中溶液呈现透明的浅黄色,并且随着反应的进行溶液的颜色逐渐加深,最后溶液颜色又逐渐变浅,最后变为无色透明溶液,说明降解过程中有苯酚中间产物的生成和积累[29]。而有Ni2+掺杂的电极在降解过程中溶液无明显的颜色变化,由此可以说明Ni2+的掺入增强了电极对苯酚中间产物的降解作用。
电极电解过程中,H2O 在氧化物电极表面放电,形成吸附态的羟基自由基SnOx(·OH)z,当氧化物晶体内存在大量氧空位缺陷时,吸附态的·OH 也会转移到氧化物晶格内形成过氧化物SnOx+1。所以对有机物的电催化氧化机理主要分为两种方式:“电化学燃烧(1)”;另一种是“电化学转化(2)”[17]。下式中R 为有机污染物,RO 为中间产物。
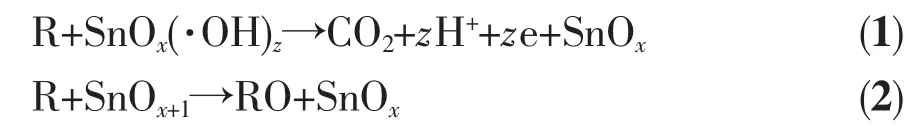
由于·OH 活性极强,对有机物无选择性氧化,可以将有机物彻底分解为无机物。而金属过氧化物的活性不太强,对有机物具有选择性,某些中间产物不能被分解,所以就会出现中间产物的积累。
因为Ni2+掺杂的Ti/SnO2-Sb2O5表面涂层中Sb5+含量高于Ti/SnO2-Sb2O5,为了保持电荷平衡,就需要更多的晶格氧,这样晶格氧与金属原子之比上升,使电极晶格中的氧空位则减少。从而降低了电极表面的吸附态·OH 中的活性氧向氧化物晶格内的转移,保留了更多的·OH,其强氧化性有利于有机物的彻底分解。相反,Ti/SnO2-Sb2O5表面氧空位较多,则增加了电极表面·OH 向晶格内的转移,形成了大量的金属过氧化物,进而使有机污染物难以彻底分解,表现为有机中间产物的积累。结合实验现象可以看出Ni2+掺杂的Ti/SnO2-Sb2O5对有机物的催化氧化以电化学燃烧为主,而Ti/SnO2-Sb2O5以电化学转化为主。
2.4 电极的稳定性
其他条件保持不变,电极电压的变化是衡量电极稳定性的重要标志。正常情况下电极是在一个比较稳定的电压下工作并且缓慢的上升,当电极电压迅速上升并且超过一定值时,意味着电极已经失去了活性。图4 为不同Ni2+掺杂比Ti/SnO2-Sb2O5电极的加速寿命曲线。可以看出电极涂层中Ni2+的掺杂量对电极的稳定性影响很大,并不是Ni2+掺入量越高越好,而是随着Ni2+掺入电极的稳定性先变好后又逐渐变差,其中Ni2+掺入量为4%时的电极最稳定。当Ni2+掺入量较低时,能够和SnO2较好的形成固溶体,提高电极涂层的稳定性,当Ni2+含量较高时,Ni2+过多的进入SnO2晶格内,会造成晶体结构的混乱,无序度上升,从而使电极的稳定性变差。
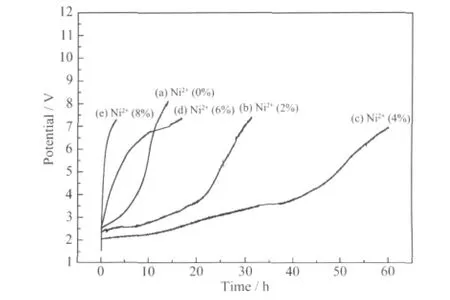
图4 不同Ni2+掺杂比的Ti/SnO2-Sb2O5 电极的加速寿命曲线Fig.4 Accelerated life curves of Ti/SnO2-Sb2O5 electrodes with different Ni2+-doped levels
表2 是没掺Ni2+和Ni2+掺杂比为4%的电极的加速寿命和实际寿命,其中实际寿命是参考文献[30]计算得来的。由表2 可以看出Ni2+掺杂Ti/SnO2-Sb2O5电极寿命为1 507.5 h,是Ti/SnO2-Sb2O5电极寿命的4.8 倍,充分说明掺入适量的Ni2+可大大提高电极的稳定性。因为Ni2+掺杂的Ti/SnO2-Sb2O5电极活性层中氧空位相对于Ti/SnO2-Sb2O5电极来说比较少,所以电解时形成的金属过氧化物较少,这样活性层内过氧化物分解产生的O2较少,并且Ni2+掺杂电极的活性层比较致密,可以有效的阻止O2进一步向涂层内部扩散,从而延缓了钛基体被氧化,提高了电极的稳定性,这与前面电极表面SEM的分析结果一致。
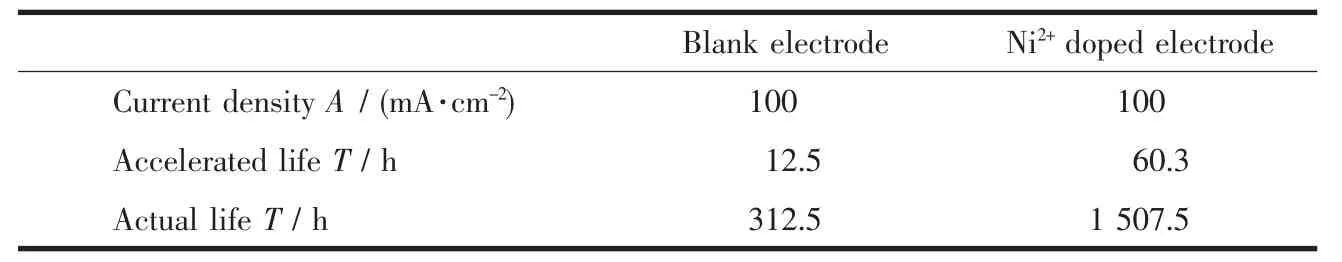
表2 大电流加速寿命试验结果Table 2 Results of accelerated life experiment
国内外许多学者在电极的稳定性方面取得了一定的成果,其中研制的Y 掺杂的Ti/SnO2-Sb2O5电极的加速寿命达到了49.8 h[31],La 掺杂的Ti/SnO2-Sb2O5电极的加速寿命为53.2 h[18],以及La 掺杂的Ti/PbO2电极的加速寿命为44 h[32]。由此可以看出相对于Ti/SnO2-Sb2O5电极的其他改性研究,Ni2+的掺杂更能提高电极的稳定性。
比较曲线a 和c 可以看出,相同的电流密度下c 的工作电压始终低于a,表明Ni2+的掺入提高了电极的导电性,降低了反应的能耗。这是由于SnO2是金红石结构的n 型半导体,通过五价离子和二价离子的复合掺入,可在SnO2晶格内产生缺陷,使SnO2的能级分裂,产生新的缺陷能级,这样价带中的电子容易进入部分缺陷能级,从而提高了载流子浓度,进而导电性提高[33]。
3 结 论
(1) 与Ti/SnO2-Sb2O5电极相比,Ni2+的掺入使电极表面的SnO2晶粒更加细小,增加了电极的表面积,提高了电极催化活性。
(2) Ni2+的掺入改善了电极表面的龟裂程度,促进了Sb 在电极表面的出现。
(3) 与Ti/SnO2-Sb2O5电极相比,Ni2+的掺入提高了电极对苯酚的降解效率,大幅缩短了降解时间。
(4) 与Ti/SnO2-Sb2O5电极相比,Ni2+的掺入大幅提高了电极的使用寿命,并且增强了电极的导电性,降低了反应的能耗。
[1] Rodgers J D, Jedral W, Bunce N J, et al. Environ. Sci.Technol., 1999,33(9):1453-1457
[2] Gotsi M,Kalogerakis N,Psillakis E.Water Res.,2005,39(17):4177-4187
[3] Iniesta J, Michaud P A, Panizza M, et al. Electrochim. Acta,2001,46(23):3573-3578
[4] Lozano B C, Comnonellis C, Battisti A D, et al. J. Appl.Electrochem., 1997,27(8):970-974
[5] Stucki S, Kotz R, Carcer B, et al. J. Appl. Electrochem.,1991,21(2):99-104
[6] MENG Hui-Min(孟惠民), LI Jin-Hong(李金鸿), YU Hong-Ying(俞 宏 英), et al. J. Univ. Sci. Technol. Beijing(Beijing Keji Daxue Xuebao), 2003,25(5):405-409
[7] SUN Zhi-Quan(孙智权), LU Hai-Yan(陆海彦), REN Xiu-Bin(任秀彬),et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2009,25(7):1385-1390
[8] SHI Yan-Hua(史艳华), MENG Hui-Min(孟惠民), SUN Dong-Bo(孙 冬 柏), et al. Acta Phys.-Chim. Sin.(Wuli Huaxue Xuebao), 2007,23(10):1553-1559
[9] LIANG Zhen-Hai(梁镇海), DING Yong-Bo(丁永波), FAN Cai-Mei(樊彩梅), et al. Acta Phys.-Chim. Sin.(Wuli Huaxue Xuebao), 2010,26(3):758-762
[10]Zanta C L P S, Michaud P A, Comninellis C, et al. J. Appl.Electrochem., 2003,33(12):1211-1215
[11]Chen G H, Chen X M, Yue P L. J. Phys. Chem. B, 2002,106(17):4364-4369
[12]Cui X, Zhao G H, Lei Y Z, et al. Mater. Chem. Phys., 2009,113(1):314-321
[13]ZHANG Nai-Dong(张乃东), LI Ning(李宁), PENG Yong-Zhen( 彭 永 臻). Chinese J. Inorg. Chem.(Wuji Huaxue Xuebao), 2002,18(11):1173-1176
[14]DAN Yuan-Yuan(丹媛媛), LU Hai-Yan(陆海彦), LIU Xiao-Lei(刘 晓 蕾), et al. Chem. J. Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao), 2011,32(1):124-128
[15]LI Guo-Hua(李国华),PENG Qiao(彭乔).Chin.J.Raremetlas(Xiyou Jinshu), 2011,35(5):725-730
[16]ZHU Fu-Liang(朱福良), HUANG Xiu-Yang(黄秀扬), YU Xi-Bo(余 细 波), et al. J. Chin. Soc. Rare Earths(Zhongguo Xitu Xuebao), 2010,28(6):709-715
[17]FENG Yu-Jie(冯玉杰), CUI Yu-Hong(崔玉虹), WANG Jian-Jun(王建军).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,6(21):837-841
[18]LI Shan-Ping(李善评), CAO Han-Lin(曹翰林), HU Zhen(胡振). Chinese J. Inorg. Chem.(Wuji Huaxue Xuebao), 2008,3(24):369-374
[19]YANG Hui(杨 辉), PENG Qiao(彭 乔). Chin. J. Raremetlas(Xiyou Jinshu), 2009,3(33):357-360
[20]CHU Qiu-Xia(褚秋霞), LIANG Zhen-Hai(梁镇海), SUN Yan-Fa(孙颜发), et al. Rare Metal Mater. Eng.(Xiyou Jinshu Cailiao Yu Gongcheng), 2009,5(38):821-824
[21]LIU Jun-Feng(刘俊峰), FENG Yu-Jie(冯玉杰), LÜ Jiang-Wei(吕 江 维), et al. Chin. J. Mater. Res.(Cailiao Yanjiu Xuebao), 2008,8(22):593-597
[22]YOU Hong(尤宏), CUI Yu-Hong(崔玉虹), FENG Yu-Jie(冯玉杰), et al. Mater. Sci. Technol.(Cailiao Kexue Yu Gongyi),2004,3(12):230-233
[23]ZHANG Jun(张君), ZHAO Qing-Nan(赵青南), CHEN Jia-Lin(陈甲林),et al.J.Chin.Ceram.Soc.(Guisuanyan Xuebao),2005,33(5):553-558
[24]WANG He(王贺), WEI Chang-Ping(魏长平), PENG Chun-Jia(彭春佳),et al.J.Chin.Ceram.Soc.(Guisuanyan Xuebao),2012,7(40):945-949
[25]FENG Gao-Feng(冯高锋), ZHOU Shi-Feng(周时风), XU Shi-Qing(徐 时 清), et al. J. Chin. Ceram. Soc.(Guisuanyan Xuebao), 2007,S1(35):66-71
[26]ZHANG Yi(张翼), LIU Lei(刘蕾), SUN Xiao-Dong(孙晓东),et al. Mater. Protect.(Cailiao Baohu), 2008,3(41):31-33
[27]CUI Yu-Hong(崔玉虹), LIU Zheng-Qian(刘正乾), LIU Zhi-Gang(刘 志 刚), et al. J. Funct. Mater.(Gongneng Cailiao),2004,Sup.(35):2035-2038
[28]WANG Ya-Qiong(王雅琼), GU Bin(顾彬), XU Wen-Lin(许文 林), et al. Rare Metal Mater. Eng.(Xiyou Jinshu Cailiao Yu Gongcheng), 2007,5(36):874-877
[29]FAN Hong-Fu(范洪富), WANG Lei(王磊), GUAN Jie(关杰),et al. J. Chin. Soc. Rare Earths(Zhongguo Xitu Xuebao),2007, 25(3):299-304
[30]ZHANG Zhao-Xian(张招贤).Titanium Electrode Engineering.2nd. Ed.(钛电极工学.2 版). Beijing: Metallurgical Industry Press, 2003:309-310
[31]LI Shan-Ping(李善评), FU Jing(付敬), HU Zhen(胡振). J.Shandong Univ.(Shandong Daxue Xuebao),2008,9(43):22-26
[32]LIU Nan(刘南), LIU Miao(刘淼), JIAO Xin-Qian(焦昕倩),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao), 2011,6(32):1266-1271
[33]WEI Mei-Ling(魏美玲), REN Wen-Juan(任文娟), SUI Xue-Ye(隋 学 叶), et al. J. Funct. Mater.(Gongneng Cailiao),2007,Sup.(38):3100-3102

