全身垂直振动对去卵巢骨质疏松大鼠血清和骨组织碱性磷酸酶水平的影响
张洋 杨少峰 卜淑敏
首都体育学院运动科学与健康学院(北京100191)
骨质疏松是一种以低骨量和骨组织结构破坏为特征的骨系统疾病,典型的骨质疏松是绝经引发雌激素缺乏所导致的骨质疏松,即绝经后骨质疏松[1]。目前绝经后骨质疏松日益成为公众健康问题,其预防和治疗仍具挑战性。长期雌激素治疗的副作用迫使人们寻求其他副作用小的药物或非药物治疗替代方法[2]。 一种可能的替代疗法是全身振动[3]。最初全身振动用来增加宇航员骨密度,像其他负重的生理活动一样,全身振动引起肌肉和骨骼抗重力工作。近年来,全身振动被用作增加老年人和其他骨质疏松风险患者骨密度的一种治疗手段,但目前对其确切作用以及适应人群尚不很清楚[3]。 动物研究表明[4-6],低强度高频率机械刺激能改善去卵巢骨质疏松大鼠骨强度,但其作用机制还知之甚少。碱性磷酸酶(alkaline phosphatase,ALP)由成骨细胞分泌,是反映骨形成的重要生化指标,常用作诊断和治疗骨质疏松的参考指标[7]。鉴此,本实验在采用去卵巢大鼠建立骨质疏松动物模型的基础上,观察了全身垂直振动对去卵巢骨质疏松大鼠股骨骨密度以及血清和骨组织ALP水平的影响,为揭示振动防治绝经后骨质疏松的机制提供实验参考依据。
1 材料与方法
1.1 动物分组与手术
3月龄健康雌性未孕SD大鼠36只,体重 (260±12)g,由北京维通利华实验动物中心提供及饲养,动物合格证号SCXK(京)2006-0008。自由饮水及进食,标准啮齿类动物饲料适应性喂养1周后,按体重分层后随机分为假手术、去卵巢静止和去卵巢振动三组,每组12只。手术前三组大鼠均禁食12~18 h。腹腔注射10%水合氯醛(3 ml/kg)麻醉,从背部切除去卵巢静止组和去卵巢振动组大鼠双侧卵巢,假手术组不切除卵巢,而切除卵巢旁与卵巢等大的脂肪组织。无菌手术在北京大学医学部实验动物科学部进行 [动物使用许可证号SYXK(京)2006-0025],并按实验动物使用的3R原则给予人道关怀。术后自由进食水。实验过程中,去卵巢静止组2只大鼠因腹部粘连而于术后2周内死亡,最后纳入实验的各组大鼠数分别为:假手术组12只,去卵巢静止组10只,去卵巢振动组12只。
1.2 主要仪器和试剂
垂直振动台:北京雅士林公司;双能X线骨密度仪:XR-36NORLAND公司,美国;JA2003天平:上品仪器公司;721E型分光光度计:上海光谱仪器厂;碱性磷酸酶检测试剂盒:南京建成生物科技有限公司。
1.3 全身垂直振动治疗方案
去卵巢振动组大鼠手术后休息10周,经双能X线骨密度仪检测,确认其在体腰椎骨密度已显著低于假手术大鼠后,于第11周开始进行1周适应性振动治疗。振动频率50 Hz,振幅0.9mm,振动时间10分钟,每天振动2次,每周7天。第12周开始正式振动治疗,振动频率90 Hz,振幅0.5mm,振动强度3.8 g,振动时间15分钟,每天振动2次,每周7天,共7周。振动方案参照Tezval等[4]的报道,所有振动均在上午进行。各组大鼠同等条件饲养,各组大鼠每周称重1次。
1.4 血清和组织样品收集
末次振动结束24~36 h内,处死各组大鼠。处死前禁食12 h。腹腔注射10%水合氯醛(3ml/kg)麻醉,腹主动脉取血后分离血清。按解剖位置迅速游离双后肢,剔除周围附着的软组织,将左股骨用生理盐水浸湿的纱布包裹并标号,置于-40℃冰箱中待测骨密度,将右侧股骨置于液氮中冻存以备检测骨组织ALP。
1.5 离体股骨骨密度检测
将所有大鼠离体股骨按从远端到近端的方位整齐摆放在一块有机玻璃板上,然后用XR-36型双能X线骨密度仪扫描,扫描后将每根股骨等分为三段,分别为远端、中段和近端,每段选取解剖结构相同、大小相同的区域为感兴趣域,通过计算机中的小动物软件系统检测每根股骨每段的骨密度。
1.6 血清和骨组织ALP水平检测
采用分光光度计测定血清和骨组织ALP水平,所有实验操作完全按照试剂盒说明书完成。
1.7 统计学分析
采用SPSS16.0软件统计实验数据,结果以均值±标准差表示,进行单因素方差分析。P﹤0.05为具有显著性差异。
2 结果
2.1 体重
由表1可知,振动前,去卵巢静止组体重显著高于假手术组,而与去卵巢振动组比较无显著性差异。振动后,假手术组和去卵巢静止组体重与振动前比较均显著增加,而去卵巢振动组无显著性差异。去卵巢振动组振动后增加的体重显著小于去卵巢静止组。
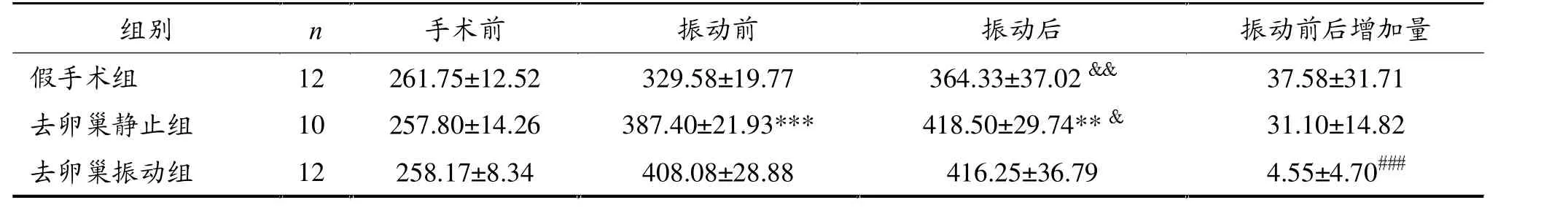
表1 各组大鼠体重(g)比较
2.2 离体股骨骨密度
由表2可知,去卵巢静止组离体股骨远端和近端骨密度显著低于假手术组,中段无显著性差异;去卵巢振动组离体股骨远端和近端骨密度显著高于去卵巢静止组,中段无显著性差异。

表2 各组大鼠离体股骨骨密度(g/cm2)比较
2.3 血清和骨组织ALP水平
由表3可知,去卵巢静止组血清ALP水平显著高于假手术组,股骨远端ALP水平显著低于假手术组;去卵巢振动组血清ALP水平与去卵巢静止组比较无显著差异,股骨远端ALP水平显著高于去卵巢静止组。
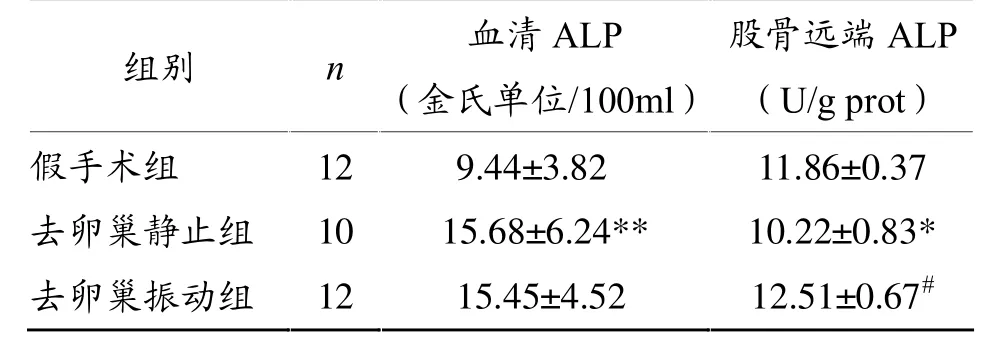
表3 各组大鼠血清和骨组织ALP水平比较
3 讨论
正常人体骨骼所受到的负荷(应力)包括静态负荷和动态负荷,静态负荷主要是体重,动态负荷主要源于肌肉主动收缩,动态负荷的成骨能力大于静态负荷,它通过骨应变影响骨细胞的代谢活动。妇女绝经后雌激素缺乏,易发生向心性肥胖和骨质疏松症,而适当机械负荷刺激不仅抑制肥胖发生,而且减缓骨质疏松的发生[8]。本研究结果显示,振动结束后,假手术组和去卵巢静止组大鼠体重均显著增加,而去卵巢振动组体重无显著变化。此结果与Van der Jagt等[8]的报道相似,提示振动治疗显著抑制去卵巢大鼠体重增加。
骨密度是骨矿代谢中量化骨量的重要指标。在目前各种骨密度的定量检测方法中,双能X线吸收测量法(DEXA)因测量精确度与准确度相对较高及对患者无伤害等优点而被认为是测定骨密度的金标准[9]。在去卵巢骨质疏松大鼠模型上,Tezval等[4]、Sehmisch等[5]以及Judex等[6]的研究结果均表明,全身垂直振动能有效改善去卵巢骨质疏松大鼠松质骨的骨质量。 而van der Jagt等[8]的研究结果表明,全身振动虽降低去卵巢大鼠体重,但对骨量无影响。本实验采用了Tezval等[4]报道的振动实验方案。结果表明,大鼠去卵巢后,离体股骨近端和远端骨密度显著下降,而经全身垂直振动治疗后,去卵巢骨质疏松大鼠离体股骨骨密度下降不明显,此与Tezval等[4]的结果相似,表明此振动治疗方案能改善去卵巢骨质疏松大鼠骨量。
血清ALP是一种同工酶糖蛋白,血清ALP主要来源于肝脏和骨骼,其中来源于骨骼的ALP占40%~75%。ALP活性测定主要用于诊断肝胆和骨骼系统疾病。临床上除肝脏疾患、妊娠等因素外,血清ALP还可反映成骨情况。骨代谢旺盛时成骨细胞活跃,ALP分泌量增加,存在于成骨细胞周围及其表面,极易释入血中,使血清ALP活性上升,因此,血清ALP是骨重建活跃性改变的标志之一[7]。本研究中,大鼠去卵巢后,血清ALP水平显著升高,此结果与以往研究报道[10-12]相似。这提示,去卵巢大鼠骨质疏松形成是骨转换加快所致。本研究中,为期7周的振动治疗对去卵巢骨质疏松大鼠血清ALP水平无明显影响。
尽管血清ALP水平常作为衡量骨代谢的重要生化检测指标,但研究表明,骨组织ALP比血液ALP活性更具代表性。因此,骨组织ALP是反映骨变化过程的最确切指标,其特异性、灵敏度及准确性优于其他指标[13,14]。 本研究结果表明,全身垂直振动提高骨组织ALP活性,提示全身垂直振动可能促进去卵巢骨质疏松大鼠成骨细胞分泌ALP。此外,本实验中,去卵巢骨质疏松大鼠血清ALP活性水平显著高于假手术大鼠,而骨组织ALP活性水平显著低于假手术大鼠,振动治疗对血清ALP无影响,却显著增加骨组织ALP水平,其原因和机制有待于进一步探讨。
4 小结
本实验结果表明,全身垂直振动可能通过增加骨组织ALP水平改善去卵巢骨质疏松大鼠骨密度。
[1] Hidaka S,Okamoto Y,Uchiyama S,et al.Royal jelly prevents osteoporosis in rats:beneficial effects in ovariectomy model and in bone tissue culturemodel.Evid Based Complement AlternatMed,2006,3:339-348.
[2] Komm BS,Mirkin S.Incorporating bazedoxifene/conjugated estrogens into the current paradigm ofmenopausal therapy.Int JWomens Health,2012,4:129-140.
[3] Wysocki A,Butler M,Sham liyan T,et al.Whole-body vibration therapy for osteoporosis:state of the science.Ann Intern Med,2011,155(10):680-686,W206-13.
[4] Tezval M,Biblis M,Sehmisch S,et al.Improvement of femoral bone quality after low-magnitude,high-frequency mechanical stimulation in the ovariectomized rat as an osteopeniamodel.Calcif Tissue Int,2011,88(1):33-40.
[5] Sehmisch S,Galal R,Kolios L,et al.Effects of low-magnitude,high-frequency mechanical stimulation in the rat osteopeniamodel.Osteoporos Int,2009,20(12):1999-2008.
[6] Judex S,Lei X,Han D,et al.Low-magnitude mechanical signals that stimulate bone formation in the ovariectomized rat are dependent on the applied frequency but not on the strainmagnitude.JBiomech,2007,40:1333–1339.
[7]刘钰瑜,吴铁,崔燎,等.去卵巢大鼠骨形成参数和血清碱性磷酸酶的相关性研究.中国老年学杂志,2004,1(24):49-50.
[8] van der Jagt OP,van der Linden JC,et al.Low-magnitude whole body vibration does notaffectbonemass but does affect weight in ovariectomized rats.J Bone Miner Metab,2012,30(1):40-46.
[9] Grier SJ,Turner AS,Alvis MR.The use of dual-energy xray absorptiometry in animals.Invest Radiol,1996,31(1):50-62.
[10] Choi MJ.Effects of taurine supplementation on bonemineral density in ovariectomized rats fed calcium deficient diet.Nutr Res Pract,2009,3(2):108-113.
[11] Lee YB,Lee HJ,Kim KS,et al.Evaluation of the preventive effect of isoflavone extract on bone loss in ovariectomized rats.Biosci Biotechnol Biochem,2004,68 (5):1040-1045.
[12] Srikanta P,Nagarajappa SH,Viswanatha GL,et al.印度草药方NR/CAL/06的甲醇提取物对卵巢切除大鼠的抗骨质疏松作用.中西医结合学报,2011,9(10):1125-1131.
[13] Zhang R,Fang H,Chen Y,et al.Gene expression analyses of subchondral bone in early experimental osteoarthritis by microarray.PLoSOne,2012,7(2):e32356.
[14] Alborzi A,Mac K,Glackin CA,et al.Endochondral and intramem-branous fetal bone development:osteoblastic cell prolixferatin and expression of alkaline phosphatese,m-twest,and histore H4.J Craniofac Genet Dev Boil,1996,16(2):94-106.

