甾体钠盐类化合物的合成研究进展
许航线,曹 赟,闫晓前
(陕西国防工业职业技术学院化学工程学院,陕西西安710300)
甾体钠盐类化合物的合成研究进展
许航线,曹 赟,闫晓前
(陕西国防工业职业技术学院化学工程学院,陕西西安710300)
按照甾体钠盐结构特点进行分类,对国内外近年来有关甾体钠盐类化合物及其衍生物的合成、生理活性研究进展进行了综述,并对其发展趋势及应用前景作了展望。
甾体钠盐;合成;生理活性;研究进展
海洋生物种类繁多,海洋生物体内孕育着大量结构奇特、生理活性极强且作用特殊的物质[1]。自20世纪60年代开始,科学家们不断从海洋生物中分离得到许多结构新颖、且具有极强生理活性的天然产物[2]。多羟基甾醇类化合物就是其中一种,但是由于甾醇类化合物普遍溶解性较差,而甾体钠盐类化合物具有较好的水溶性及生物活性,因此,科学家在甾醇的基础上进一步合成溶解性较好的甾体钠盐,以期寻找到生物活性更好的甾体类化合物。
作者按照甾体钠盐结构特点进行分类,对国内外近年来有关甾体钠盐类化合物及其衍生物的合成、生理活性研究进展进行了综述,并对此方面的发展趋势及应用前景作了展望。
1 羟基胆甾醇琥珀酸酯钠盐化类合物
20世纪70年代中期,Cheng等[3]从僵蚕体内分离出7β-羟基胆固醇,体外试验发现,该化合物具有细胞毒作用且其选择性很好,此后,氧代固醇类化合物及其衍生物的合成及生物活性成为科学家们研究的热点。由于7β-羟基胆固醇的水溶性差,并且体内抗癌活性试验效果不佳,因此,1986年,容士宏等[4]合成了水溶性较好的7β-及7α-羟基胆固醇双琥珀酸单酯钠(化合物1和化合物2),体内抗癌活性试验表明,它们对各种腹水癌细胞有较好的抑制活性,其中化合物1对人直肠癌原代培养的细胞也有抑制作用。化合物1和化合物2的结构式见图1。

图1 化合物1和2的结构式Fig.1 The structure of compounds 1 and 2
1995年,张新华等[5]合成了7β-羟基胆固醇琥珀酸酯钠类化合物3~6,并用艾氏腹水癌细胞、小鼠L1210白血病细胞及小鼠白血病P388细胞对这些化合物进行了体外抗癌活性试验,结果表明,化合物3~6对艾氏腹水癌细胞均具有一定程度的抑制活性;化合物4及化合物5对小鼠L1210白血病细胞的抑制活性优于化合物1,化合物1、化合物4和化合物5的IC50(mg·L-1)值分别为30.14、15.11、6.32;化合物4及化合物5对小鼠白血病P388细胞的体外抑制活性也优于化合物1。化合物3~6的结构式见图2。

图2 化合物3~6的结构式Fig.2 The structure of compounds 3~6
2 甾体硫酸酯钠盐类化合物
2.1 胆甾醇硫酸酯钠及其类似物
多羟基甾体硫酸酯钠类化合物具有极广泛的生物活性,如HIV的抑制作用、酪氨酸蛋白激酶的抑制作用及抗肿瘤活性等[6-10]。
1992年,AmoštovBá等[11]以天然甾醇类化合物为原料,经过多步反应合成出甾醇硫酸酯钠类化合物7和8。化合物7和8的结构式见图3。

图3 化合物7和8的结构式Fig.3 The structure of compounds 7 and 8
1999年,Comin等[12]合成了天然多羟基甾醇的硫酸酯钠盐类化合物9~12,并对其进行了活性测试。结果发现,在C-21、C-2或C-3位置处含有硫酸酯钠基团的化合物对HSV-2的抑制活性最好(表1),并且对PV-3和JV也有抑制作用。化合物9~12的结构式见图4。

图4 化合物9~12的结构式Fig.4 The structure of compounds 9~12

表1 化合物9~12的50%抑制浓度Tab.1 IC50of compounds 9~12
2003年,Garrido等[13]以(3β,5α)-3-羟基胆甾烷为原料合成了化合物13~17,生理活性研究表明,这些化合物对HSV-2均具有抑制作用,其中化合物14和15对HSV-2的抑制效果最好,此外,化合物15还对DEN-2和JV有一定的抑制作用(表2)。化合物13~17的结构式见图5。
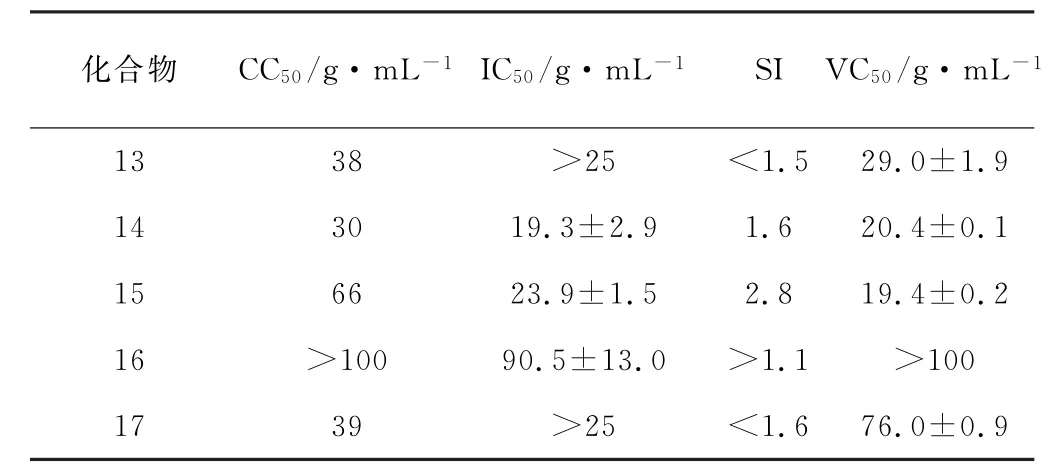
表2 化合物13~17的抗毒、杀毒活性Tab.2 Antiviral and virucidal activities of compounds 13~17

图5 化合物13~17的结构式Fig.5 The structure of compounds 13~17
2003年,Cui等[10]以胆甾醇为原料,经过PCC氧化、硼氢化钠选择性还原、三乙胺-三氧化硫复合物硫酸酯化、阳离子(钠型)交换树脂进行Na+交换四步反应,最终合成出3个二羟基甾体硫酸酯钠盐化合物18~20,用Sk-Hep-1(肝癌)、H-292(肺癌)、PC-3(前列腺癌)、Hey-1B(卵巢癌)细胞对这些化合物进行活性测试,结果发现,甾体17位侧链的存在对它们的生物活性是必要的(表3)。化合物18~20的合成路线见图6。
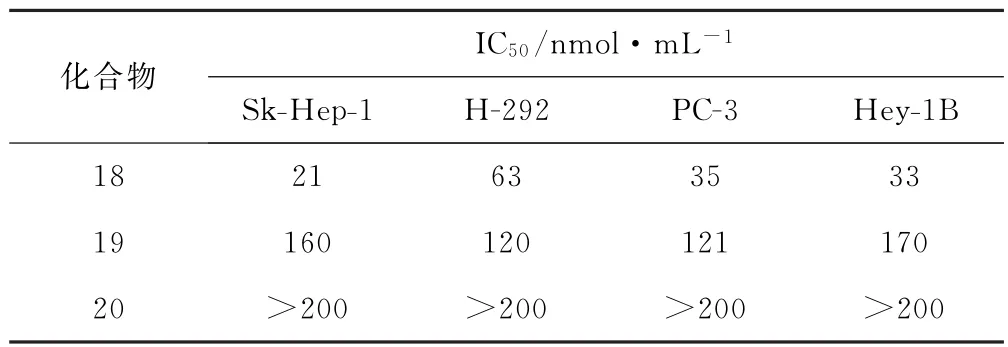
表3 化合物18~20的体外抗肿瘤活性Tab.3 In vitro antitumor activities of compounds 18~20

图6 化合物18~20的合成路线Fig.6 The synthetic route of compounds 18~20
2008年,黄上峰等[14]以胆甾醇为原料,经过硫酸酯化、钠离子交换两步反应合成出天然存在的具有抗肿瘤活性的胆甾醇硫酸酯钠及其4个类似物21~24,并对这些化合物进行抗肿瘤活性测试,结果表明,化合物22在体外对肝癌、宫颈癌、人胃癌细胞株的生长具有一定的抑制作用。化合物21~24的合成路线见图7。

图7 化合物21~24的合成路线Fig.7 The synthetic route of compounds 21~24
2008年,王辉等[15]对天然甾醇类化合物进行结构改造,经过PCC氧化、硼氢化钠选择性还原、三乙胺-三氧化硫复合物硫酸酯化、阳离子(钠型)交换树脂进行Na+交换四步反应,最终得到4-烯-6-氧代甾体硫酸酯钠类化合物25~27,合成路线见图8。

图8 化合物25~27的合成路线Fig.8 The synthetic route of compounds 25~27
2010年,陈思静等[16]以天然甾醇化合物为原料,经过环氧化、水解,然后利用三乙胺-三氧化硫复合物进行硫酸酯化,并通过阳离子(钠型)交换树脂进行Na+交换得到目标产物5,6-二羟基-3-取代甾体硫酸酯钠类化合物28~30,并用Hey-1B(卵巢癌)、Sk-Hep-1(肝癌)、H-292(肺癌)和PC-3(前列腺癌)细胞株对化合物28~30进行了抗肿瘤活性测试,结果表明,在测试浓度范围(100μg·m L-1)内,上述化合物没有表现出显著的细胞毒性。化合物28~30的合成路线见图9。

图9 化合物28~30的合成路线Fig.9 The synthetic route of compounds 28~30
2011年,Richmond等[17]合成了二取代硫酸酯钠类化合物31和32,对它们进行活性测试,发现化合物31和32对抗乙酰胆碱酯酶均有抑制活性,IC50分别为14.59μmol·L-1和59.65μmol·L-1。化合物31和32的结构式见图10。
2.2 孕甾醇硫酸酯钠类化合物
2009年,李莹等[18]以孕甾醇酮为原料,经过还原、羟基硫酸酯钠化合成出二取代的硫酸酯钠盐——孕甾-5β-烯-3β,20-二取代硫酸酯钠类化合物33,用Sk-Hep-1(肝癌)、PC-3(前列腺癌)、H-292(肺癌)和Hey-1B(卵巢癌)细胞株对该化合物进行了体外抗肿瘤活性测试,结果表明在测试浓度范围内没有明显的细胞毒性。化合物33的合成路线见图11。

图10 化合物31和32的结构式Fig.10 The structure of compounds 31 and 32

图11 化合物33的合成路线Fig.11 The synthetic route of compound 33
2.3 谷甾醇硫酸酯钠类化合物
2007年,王辉等[19]以豆甾醇为原料,通过PCC氧化生成豆甾-4,22-二烯-3,6-二酮,然后在NiC12存在下用NaBH4还原得到豆甾-22-烯-3β,6β-二醇,接着经过三乙胺-三氧化硫配合物酯化、强酸性丙烯酸型阳离子交换树脂进行Na+交换,最后得到目标化合物34。合成路线见图12。
2010年,贾琳怡等[20]以谷甾醇为原料,经过PCC氧化、硼氢化钠选择性还原、三乙胺-三氧化硫复合物硫酸酯化、阳离子(钠型)交换树脂进行Na+交换四步反应,最终得到谷甾硫酸酯钠类化合物35和36,其结构式见图13。
2010年,黄燕敏等[21]以天然甾醇类化合物为原料,经过PCC氧化、硼氢化钠选择性还原、三乙胺-三氧化硫复合物硫酸酯化、阳离子(钠型)交换树脂进行Na+交换、硼氢化钠还原,合成得到6-羟基甾体硫酸酯钠类化合物37和38,对它们进行抗肿瘤活性测试,结果表明,化合物37在体外对卵巢癌(Hey-1B)细胞株具有较好的细胞毒性,IC50值为48 nmol·m L-1。化合物37和38的结构式见图14。

图12 化合物34的合成路线Fig.12 The synthetic route of compound 34
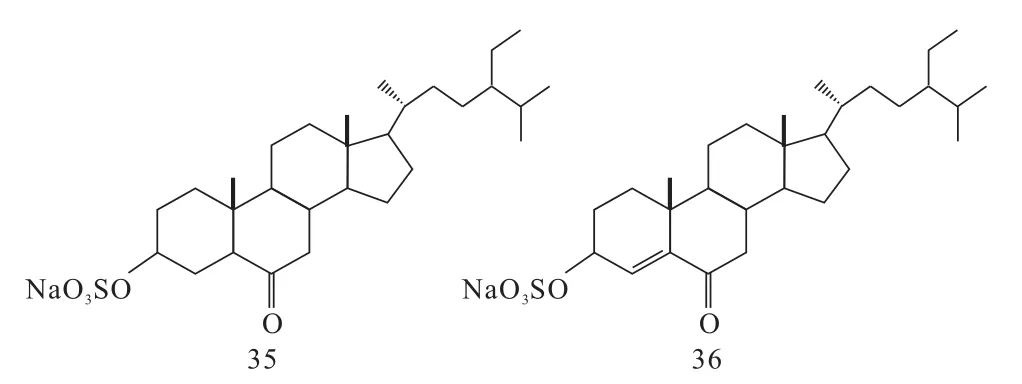
图13 化合物35和36的结构式Fig.13 The structure of compounds 35 and 36

图14 化合物37和38的结构式Fig.14 The structure of compounds 37 and 38
3 羟基胆烷酸钠盐类化合物
2002年,公瑞煜等[22]合成了牛磺胆酸钠化合物39,并将牛磺胆酸钠与胆酸钠进行镇咳、祛痰和平喘对比实验,结果表明,牛磺胆酸钠具有明显的镇咳、祛痰和平喘作用,其作用强于胆酸钠。化合物39的结构式见图15。
2004年,刘跃金等[23]合成了两个羟基胆烷酸钠类化合物40和41,并用小鼠L1210白血病细胞对该类化合物进行体外抗肿瘤活性测试,结果表明,化合物40和41对小鼠L1210白血病细胞的抑制效果并不明显, IC50分别大于100 mg·m L-1和81.66 mg·m L-1。化合物40和41的结构式见图16。

图15 化合物39的结构式Fig.15 The structure of compound 39

图16 化合物40和41的结构式Fig.16 The structure of compounds 40 and 41
2006年,刘跃金等[24]合成了3β,5α,6β-三羟基胆烷-24-酸衍生物42,对小鼠L1210白血病细胞体外增殖抑制活性测试表明,该化合物对小鼠L1210白血病细胞体外抗癌活性不佳,IC50为82.96 g·L-1。化合物42的结构式见图17。

图17 化合物42的结构式Fig.17 The structure of compound 42
4 其它甾体钠盐类化合物
1990年,Ji等[25]合成了7β-羟基胆固醇与核苷的双磷酸酯钠盐类化合物43和44,它们有较好的抗Krebs l腹水癌活性,但对实体瘤P815的抗癌效果并不稳定。化合物43和44的结构式见图18。

图18 化合物43和44的结构式Fig.18 The structure of compounds 43 and 44
5 结语
近年来,新的甾体钠盐类化合物不断被合成出来,生理活性测试表明,甾体钠盐类化合物通常具有良好的细胞毒性、抗肿瘤、抗病毒活性或抗炎作用。目前对该类化合物的分子设计、合成及生理活性研究是化学家和药物学家们关注的热点,从具有生理活性的甾醇化合物出发,结合化学和分子生物学原理以及计算机辅助设计等方法,合成具有高生物活性的甾体钠盐类化合物,将有利于新药的研制与开发。
[1] Melissa L L,Faulker D J.Unusual polyoxygenated sterols from a philippines sponge Xestospongia sp.[J].Tetrahedron,2001,57 (19):4091-4094.
[2] 黄上峰,崔建国,刘志平,等.海洋多羟基甾醇硫酸酯钠盐及其生物活性研究进展[J].天然产物研究与开发,2006,18(4):681-685.
[3] Cheng K P,Nagano H,Luu B,et al.Chemistry and biochemistry of Chinese drugs.Part I.Sterol derivatives cytotoxic to hypatoma cell,isolated from the drug Bombyx cum Botryte[J].J Chem Res, 1977,(S)217;(M):2501.
[4] 容士宏,Bergmann C,刘鹏,等.羟基固醇类的抗癌活性研究[J].沈阳药学院学报,1986,3(1):8-13.
[5] 张新华,阎少羽,李惠琴,等.氧代固醇类化合物的抗癌活性研究. 4-胆甾烷-3β,5α,6β(6α)-三醇和胆甾-4-烯-3β,6β(6α)-二醇的琥珀酸单酯钠合成与抗癌活性[J].中国药物化学杂志,1995,5(2): 101-108.
[6] Blunt J W,Copp B R,Hu W P,et al.Marine natural products[J]. Nat Prod Rep,2007,24(1):31-86.
[7] Blunt J W,Copp B R,Munro M H G,et al.Marine natural products[J].Nat Prod Rep,2005,22(1):15-61.
[8] Faulkner D J.Marine natural product[J].Nat Prod Rep,2001,18: 1-49.
[9] 韩莉妲,崔建国,黄初升.海洋生物中具有生物活性的多羟基甾醇及甾体皂苷[J].有机化学,2003,23(3):305-311.
[10] Cui J G,Wang H,Huang Y M,et al.Synthesis and cytotoxic analysis of some disodium 3β,6β-dihydroxysterol disulfates[J]. Steroids,2009,74(13-14):1057-1060.
[11] AmoštovBáL M,Pouzar V,Drašar P.Synthesis of the sulfates derived from 5α-cholestane-3β,6α-diol[J].Steroids,1992,57(5): 233-235.
[12] Comin M J,Maier M S,Roccatagliate A J,et al.Evaluation of the antiviral activity of natural sulfated polyhydroxysteroids and their synthetic derivatives and analogs[J].Steroids,1999,64(5): 335-340.
[13] Garrido Santos G A,Murray A P,Pujol C A,et al.Synthesis and antiviral activity of sulfated and acetylated derivatives of 2β,3βdihydroxy-5α-cholestane[J].Steroids,2003,68(2):125-132.
[14] 黄上峰,王辉,黄燕敏,等.胆甾醇硫酸酯钠及其类似物的合成研究[J].广西科学,2008,15(4):414-418.
[15] 王辉,李莹,崔建国.4-烯-6-氧代-3β-硫酸酯钠甾体化合物的合成研究[J].广西师范学院学报(自然科学版),2008,25(2):63-67.
[16] 陈思静,贾琳怡,王辉,等.3β,5α,6β-三羟基-3-取代甾体硫酸酯钠的合成研究[J].广西师范学院学报(自然科学版),2010,27(2): 44-47.
[17] Richmond V,Garrido Santos G A,Murray A P.Synthesis and acetylcholinesterase inhibitory activity of 2β,3α-disulfoxy-5αcholestan-6-one[J].Steroids,2011,76(10-11):1160-1165.
[18] 李莹,王辉,崔建国.孕甾-5-烯-3β,20-二取代硫酸酯钠盐的合成[J].广西师范学院学报(自然科学版),2009,26(2):52-54.
[19] 王辉,崔建国,黄立梁.豆甾-22-烯-3β,6β-硫酸酯钠盐的合成[J].化学试剂,2007,29(9):566-56.
[20] 贾琳怡,王辉,苏绍烊,等.6-氧代-谷甾-3β-硫酸酯钠和6-氧代-谷甾-4-烯-3β-硫酸酯钠的合成[J].广西师范学院学报(自然科学版),2010,27(4):42-44.
[21] 黄燕敏,李莹,崔建国,等.6-羟基-3-硫酸酯钠甾体化合物的合成及生理活性研究[J].有机化学,2010,30(11):1689-1694.
[22] 公瑞煜,李建蓉,张亚,等.牛磺胆酸钠的制备及与胆酸的药效对比[J].精细化工,2002,19(8):482-485.
[23] 刘跃金,容士宏.羟基胆烷酸类衍生物的抗癌活性研究Ⅱ.3β,5α, 6β-三羟基胆甾烷-24-酸及3β,6β-二羟基胆甾-4-烯-24-酸衍生物的合成及其抗癌活性[J].中国药物化学杂志,2004,14(6):344-349.
[24] 刘跃金,容士宏.3β,5α,6β-三羟基胆甾烷-24-酸衍生物的合成及体外抗癌活性[J].沈阳药科大学学报,2006,23(6):347-352.
[25] Ji Y H,Moog C,Schmitt G,et al.Monophosphoric acid diesters of 7 beta-hydroxycholesterol and of pyrimidine nucleosides as potential antitumor agents:Synthesis and preliminary evaluation of antitumor activity[J].J Med Chem,1990,33(8):2264-2270.
Research Progress in Synthesis of Steroidal Sodium Salts
XU Hang-xian,CAO Yun,YAN Xiao-qian
(Department of Chemical Engineering,Shanxi Institute of Technology,Xi'an 710300,China)
The synthesis and biological activities of steroidal sodium salts in recent years are reviewed according to the structure of steroidal sodium salts.The developing trends and application prospects of steroidal sodium salts are also expected.
steroidal sodium salt;synthesis;biological activity;research progress
O 629.29
A
1672-5425(2013)05-0017-05
10.3969/j.issn.1672-5425.2013.05.005
2013-03-04
许航线(1984-),男,陕西咸阳人,硕士,助教,主要从事有机合成,E-mail:hang.xian@163.com。

