一种新型含硒席夫碱与人血清白蛋白相互作用的研究
刘 洁,刘文举,吴鸣虎
(湖北科技学院核技术与化学生物学院,湖北 咸宁437100)
硒是人体必需的微量元素之一,在防癌、抑癌方面发挥着重要作用[1],其中有机含硒化合物因其对机体毒性较低且抑癌作用较好而得到研究者的广泛关注。席夫碱类药物具有抑菌、杀菌、抗癌、抗病毒活性[2]。基于此,课题组设计合成出新型含硒席夫碱2-苄基亚胺基次甲基-4-(3-苄基亚胺基次甲基-4-羟基-苯硒基)苯酚(BBHP),以期利用硒和席夫碱在生物体内的协同效应,发挥更优良的生物活性。
人血清白蛋白(Human serum albumin,HSA)是人体循环系统中最主要的水溶性蛋白质,具有多种生理功能。药物进入血浆后通过与人血清白蛋白结合参与血液循环,从而被运送到身体各部位。因此,研究药物与人血清白蛋白的相互作用,对了解药物在体内的分布、缓释、代谢及排泄方式等很有帮助。目前的研究多以白蛋白为实验模型,从不同角度研究其与药效小分子间的相互作用,而鲜见有关含硒席夫碱与人血清白蛋白相互作用的研究报道。
作者在模拟人体生理条件下,采用紫外吸收光谱法和荧光光谱法(荧光猝灭光谱和同步荧光光谱)研究新型含硒席夫碱BBHP与HSA相互作用的光谱特征,得到关于两者作用机理、结合常数、结合位点数、作用力类型、结合距离以及构象变化等方面的信息,以期为进一步研究含硒席夫碱类药物的药理作用、生物学效应提供重要参考。
1 实验
1.1 试剂与仪器
HSA,Sigma公司分装;2-苄基亚胺基次甲基-4-(3-苄基亚胺基次甲基-4-羟基-苯硒基)苯酚(BBHP),自行合成;Tris,生化试剂;盐酸、氯化钠等均为分析纯;实验用水为二次蒸馏水。
F-4500型荧光光谱仪、UV2300型紫外可见分光光度仪,日本日立公司;PHS-3C型酸度计,上海今迈仪器仪表公司;AYU120型分析天平,日本岛津;SC-15A型超级恒温槽,苏州宏拓电子有限公司。
1.2 方法
HSA的浓度为1×10-5mo1·L-1,用pH=7.4的含0.20mol·L-1NaCl的 Tris-HCl缓冲溶液配制。BBHP的浓度为2×10-3mo1·L-1,用微量注射器移取适量注入HSA溶液中,混匀,保温静置。调节紫外可见分光光度仪狭缝1.5nm,记录各溶液在298 K下200~350nm范围的紫外吸收光谱。进行荧光测定时激发和发射狭缝均固定为5.0nm。扫描得HSA最大激发波长为287nm,以287nm作为激发光,测定并记录各溶液在不同温度(290K、298K和306K)下295~500nm的荧光光谱。调节λex=λem,绘制各溶液在298K下250~750nm的共振光散射光谱。分别调节Δλ(即λem-λex)为15nm和60nm,测定各溶液在298K下的同步荧光光谱。
2 结果与讨论
2.1 体系特征光谱
2.1.1 荧光光谱
HSA的内源荧光主要来源于其分子中含有的色氨酸和酪氨酸等芳香氨基酸残基。受287nm的光激发,HSA在345nm附近产生很强的荧光峰,而相同条件下BBHP没有荧光信号,说明过量的BBHP对HSA的荧光强度不发生干扰。同时HSA的荧光强度随BBHP的加入迅速而有规律地降低,且荧光峰位有小幅移动(图1),显示BBHP与HSA之间可能存在相互作用。

图1 BBHP对HSA荧光光谱的影响Fig.1 Fluorescence spectra of HSA in the presence of different concentrations of BBHP
2.1.2 紫外吸收光谱(图2)
由图2可知,随着BBHP的加入,HSA在220~230nm及280nm附近的吸收增强,且吸收峰均有明显位移,说明HSA分子中生色团所处微环境可能发生了变化[3]。此外,BBHP在287.5nm处的吸收峰非常弱(A<0.045),因此,BBHP对 HSA的内滤效应可以忽略。
2.2 猝灭机理的判别

图2 BBHP对HSA紫外吸收光谱的影响Fig.2 UV Absorption spectra of HSA in the presence of BBHP
荧光猝灭是指荧光物质与猝灭剂发生作用,使荧光强度降低或者消失的现象。引起荧光猝灭的原因通常为动态猝灭、静态猝灭以及能量转移中的一种或几种[4]。动态猝灭是荧光物质处于激发态的分子与猝灭剂碰撞、以非辐射形式释放能量,其猝灭过程依赖于扩散,一般随温度升高猝灭得以增强;因为动态猝灭是猝灭剂与荧光物质激发态分子的作用,并不改变其基态物质浓度,所以加入猝灭剂前后体系的紫外吸收基本不发生变化。静态猝灭是荧光物质处于基态的分子与猝灭剂生成不发荧光的复合物,从而导致荧光物质荧光强度降低的过程;因为基态物质浓度发生变化,通常会导致紫外吸收光谱的改变,因此,可以通过比较加入猝灭剂前后体系的紫外吸收光谱是否发生改变来判断是否存在静态猝灭。
由图2可知,加入药物小分子BBHP后,HSA的紫外吸收光谱发生了改变,吸收峰蓝移(从278.5nm移至276.0nm);且体系的吸收光谱并不是两者的简单叠加,说明BBHP与HSA结合形成了新的化合物[5]。因此,形成复合物的静态猝灭是引起体系荧光强度降低的一个重要方面。
在荧光猝灭过程中,猝灭剂(BBHP)和荧光物质(HSA)之间的相互作用遵循Stern-Volmer方程:

式中:F0、F分别为不加BBHP、加BBHP时HSA的荧光强度;[Q]为 BBHP的浓度;KSV为 Stern-Volmer猝灭常数,L·mol-1;τ0为 HSA单独存在时自身的荧光寿命,约为10-8s;K为BBHP对 HSA 的q表观猝灭速率常数,L·mol-1·s-1。
已知水溶液中猝灭剂对蛋白质的最大受扩散控制的表观猝灭速率常数 Kq为2.0×1010L·mol-1·s-1[6],若猝灭剂与蛋白质的荧光猝灭过程为单一动态猝灭时,KSV应小于200L·mol-1。
分别绘制不同温度(290K、298K和306K)下的BBHP-HSA体系的Stern-Volmer曲线,由斜率可得猝灭常数KSV的数值,结果见图3。
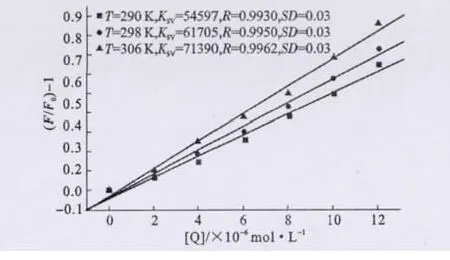
图3 不同温度下的BBHP-HSA体系的Stern-Volmer曲线Fig.3 The Stern-Volmer plots of BBHP-HSA system at different temperatures
由图3可知,3个温度下KSV均远大于200L·mol-1,进一步表明动态猝灭不是HSA发生荧光猝灭的主要原因。同时,温度升高时KSV增大,这一现象可以解释为静态猝灭形成的复合物的稳定性可能随温度升高而增强,或者在BBHP对HSA的荧光猝灭过程中动态猝灭的影响并不能完全忽略[7]。
2.3 表观结合常数及结合位点数
如上所述,BBHP对HSA的荧光猝灭主要是形成复合物的静态猝灭,若BBHP与HSA作用时有n个相同且独立的结合位点,其结合常数Kb与结合位点数n可由式(2)求出:
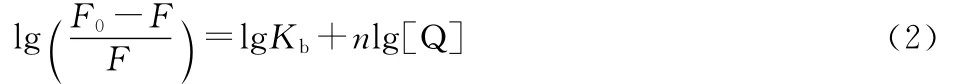
绘制不同温度下的lg[(F0/F)-1]~lg[Q]双对数曲线,由斜率和截距可得Kb和n的数值,结果列于表1。
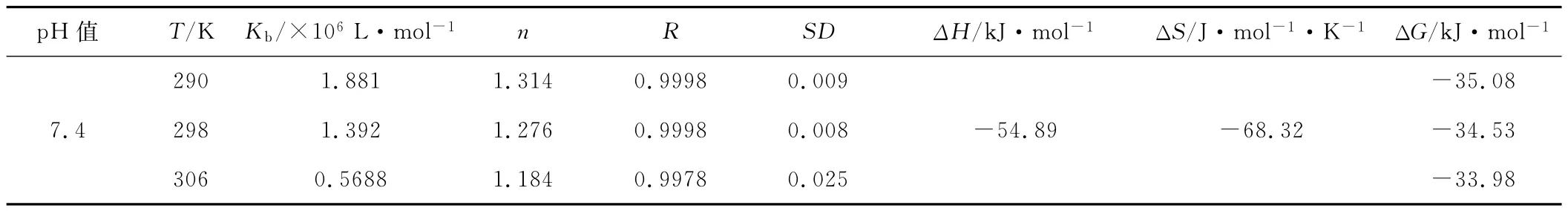
表1 不同温度下的结合常数Kb、结合位点数n及热力学参数Tab.1 Binding constant Kb,binding sites nand thermodynamic parameters at different temperatures
由表1可知,290K、298K、306K时的结合常数Kb分别为1.881×106L·mol-1、1.392×106L·mol-1和5.688×105L·mol-1,说明BBHP与 HSA之间有较强的结合作用,可以被HSA所储存和运输。当温度升高时,Kb值降低,说明形成的化合物不稳定,在温度升高时可能部分分解,因此经HSA携带的药物BBHP可以释放出来,从而实现治疗的效果。此外不同温度下的结合位点数均稍大于1,说明含硒席夫碱BBHP除了与HSA的特征结合部位形成1个结合位点外,还与其表面的其它官能团发生了相互作用。
2.4 作用力类型
由于实验过程中温度变化范围不大,因此可假设焓变为定值,则ΔH 和熵变ΔS可由式(3)求得:

式(3)中的K相当于对应温度下的结合常数Kb。吉布斯自由能变ΔG可由式(4)求得:

绘制lnK~1/T曲线,结合式(4)计算热力学常数,结果列于表1。
药物小分子与蛋白质大分子间的作用力通常包括静电引力、疏水作用力、氢键以及范德华力,均属于分子间的弱相互作用力[8]。主要作用力类型之间的规律:ΔH>0、ΔS>0,为疏水作用力;ΔH<0、ΔS<0,为氢键和范德华力;ΔH≈0、ΔS>0,为静电引力[9]。由表1可知,BBHP与HSA之间的结合反应是自发的(ΔG<0),作用力主要为氢键和范德华力(ΔH<0、ΔS<0)。
2.5 结合距离
如果猝灭剂小分子的吸收光谱与荧光分子的发射光谱之间有较大程度重叠,说明两者之间存在能量转移,包括辐射能量转移(即内滤效应)和依赖于分子间距的非辐射能量转移。根据Frster的偶极-偶极非辐射能量转移理论[10],可以计算BBHP与HSA结合时结合位置与HSA中荧光发射基团之间的距离。

式中:E为转移效率;F0为与BBHP作用前HSA的荧光强度;F为HSA和BBHP摩尔比为1∶1时HSA的荧光强度;r为HSA和BBHP之间的距离;R0为转移效率为50%时的临界距离,可由式(6)求出:

式中:K2为偶极子BBHP和HSA的空间取向因子;n为溶液介质的折射指数;Ф为HSA的荧光量子产率;J为BBHP吸收光谱与HSA荧光光谱的光谱重叠积分面积,即:

式中:F(λ)为 HSA在波长λ处的荧光强度;ε(λ)为BBHP在波长λ处的摩尔吸光系数。
BBHP的吸收光谱与HSA的荧光光谱见图4。

图4 BBHP的吸收光谱(a)和HSA的荧光光谱(b)重叠图Fig.4 Spectral overlap of BBHP absorption spectrum(a)with HSA fluorescence spectrum(b)
按式(7)采用自编的计算机积分程序,求出图4中BBHP与HSA摩尔比为1∶1时光谱重叠积分面积J为4.89×10-15cm3·L·mol-1。取 K2为2/3、n为1.336、Φ 为0.118[11],结合J的数值一起代入式(6)求出R0=2.21nm;根据式(5)以及荧光数据求出能量转移效率E=0.367;综合R0、E 的值,再由式(5)算出HSA分子内荧光基团即氨基酸残基与BBHP分子间的平均距离r=2.42nm,说明BBHP与HSA之间足够靠近(r<7nm),存在非辐射能量转移,从而促使HSA的荧光猝灭。r>R0,说明对于蛋白质的荧光猝灭,非辐射能量转移的影响比静态猝灭小,即静态猝灭是BBHP引起HSA荧光猝灭的主要原因[12]。此外,已有研究表明HSA疏水腔结构域Ⅲ中的脂肪酸与其214位色氨酸残基之间的距离为2.3nm[13],此值与BBHP和HSA之间的结合距离2.42nm非常接近,因此可认为与BBHP结合的主要是HSA分子中的色氨酸残基。
2.6 BBHP对HSA构象的影响
研究表明采用不同波长差扫描得到的蛋白质同步荧光光谱可以反映出不同氨基酸基团的信息,如Δλ=15nm和Δλ=60nm时分别显示酪氨酸和色氨酸残基的特征光谱[14]。同时蛋白质所处微环境的极性变化会影响其分子中氨基酸残基的最大发射波长的位置,极性增强即疏水性减弱时最大发射波长红移;反之,极性减弱即疏水性增强时最大发射波长蓝移。保持HSA浓度不变,逐步加入BBHP,分别绘制Δλ=15 nm和Δλ=60nm时的同步荧光光谱,如图5所示。
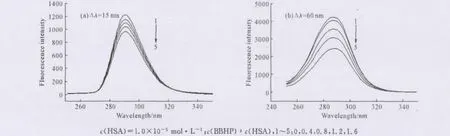
图5 BBHP-HSA体系的同步荧光光谱Fig.5 Synchronous fluorescence spectra of BBHP-HSA system
由图5可知,实验条件下,HSA的荧光强度主要由色氨酸残基贡献(约为酪氨酸强度的3.4倍);当逐渐加入BBHP时,酪氨酸残基的最大发射波长基本不变,说明BBHP的加入未改变酪氨酸残基的微环境;色氨酸残基的最大发射波长红移,说明BBHP加入后主要改变色氨酸残基所处微环境,使其疏水性降低,也即作用位点距离色氨酸更近(与结合距离求算的结果一致)。
3 结论
应用紫外吸收光谱和荧光光谱研究了新型含硒席夫碱2-苄基亚胺基次甲基-4-(3-苄基亚胺基次甲基-4-羟基-苯硒基)苯酚(BBHP)与人血清白蛋白(HSA)之间的相互作用。结果表明,在生理pH值条件下BBHP主要通过形成复合物的静态猝灭方式使HSA的内源荧光得以强烈猝灭;BBHP与HSA主要有1个结合位点数,298K时的结合常数为1.392×106L·mol-1;该结合反应为自发的放热过程,相互作用力主要为氢键和范德华力。根据Frster无辐射能量转移理论计算了两者之间的结合距离r=2.42nm,同时考察了BBHP对HSA构象的影响。
[1]Rayman M P.Selenium in cancer prevention:A review of the evidence and mechanism of action[J].The Proceedings of the Nutrition Society,2005,64(4):527-542.
[2]Xiang Y L,Wu F Y.Study of the interaction between a new Schiff-base complex and bovine serum albumin by fluorescence spectroscopy[J].Spectrochimi Acta Part A:Mol Biomol Spectrosc,2010,77(2):430-436.
[3]Lin H,Lan J F,Guan M,et al.Spectroscopic investigation of interaction between mangiferin and bovine serum albumin[J].Spectrochimi Acta Part A:Mol Biomol Spectrosc,2009,73(5):936-941.
[4]Yu X Y,Yang Y,Lu S Y,et al.The fluorescence spectroscopic study on the interaction between imidazo[2,1-b]thiazole analogues and bovine serum albumin[J].Spectrochimi Acta Part A:Mol Biomol Spectrosc,2011,83(1):322-328.
[5]Naik P N,Chimatadar S A,Nandibewoor S T.Interaction between apotent corticosteroid drug-dexamethasone with bovine serum albumin and human serum albumin:A fluorescence quenching and Fourier transformation infrared spectroscopy study[J].Journal of Photochemistry and Photobiology B:Biology,2010,100(3):147-159.
[6]Cui F L,Qin L X,Zhang G S,et al.A concise approach to 1,11-didechloro-6-methyl-4′-O-demethyl rebeccamycin and its binding to human serum albumin:Fluorescence spectroscopy and molecular method[J].Bioorganic and Medicinal Chemistry,2008,16(16):7615-7621.
[7]Xu H,Liu Q W,Wen Y Q.Spectroscopic studies on the interaction between nicotinamide and bovine serum albumin[J].Spectrochimi Acta Part A:Mol Biomol Spectrosc,2008,71(3):984-988.
[8]谢郢,李永成,杨立云,等.替加氟与牛血清白蛋白相互作用的研究[J].化学与生物工程,2010,27(9):48-52.
[9]Rohman M H,Maruyama T,Okada T,et al.Study of interaction of carprofen and its enantiomers with human serum albumin-Ⅰ.Mechanism of binding studied by dialysis and spectroscopic methods[J].Biochemical Pharmacology,1993,46(10):1721-1731.
[10]Valeur B.Molecular Fluorescence:Principles and Applications[M].Weinheim:Wiley-VCH,2001:119-123.
[11]Cui F L,Fan J,Li W,et al.Fluorescence spectroscopy studies on 5-aminosalicylic acid and zinc 5-aminosalylicylate interaction with human serum albumin[J].Journal of Pharmaceutical and Biomedical Analysis,2004,34(1):189-197.
[12]谢孟峡,徐晓云,王英典,等.4′,5,7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究[J].化学学报,2005,63(22):2055-2062.
[13]陈泽忠,冯锋,杨文娟,等.左氧氟沙星与牛血清白蛋白相互作用的液滴荧光法研究[J].光谱学与光谱分析,2008,28(7):1612-1616.
[14]栾强,朱蓓薇,徐同宽.荧光光谱法研究左西孟旦与牛血清白蛋白的结合反应[J].分析试验室,2008,27(6):57-60.

