胎盘早剥新生儿临床特征及凝血指标分析*
杨 璐,赵文利,李秋平,许 靖,封志纯△
(1.南方医科大学八一临床医学院,北京 100700;2.北京军区总医院新生儿科 100700)
胎盘早剥是指在胎儿娩出之前胎盘部分或全部从子宫壁剥离,多发生在妊娠20周后或分娩期,起病隐匿,进展快,国外报道发病率为0.49%~1.80%,国内为0.46%~0.21%,占围产儿病死率的10%~20%[1]。早在2003年已有学者关注到胎盘早剥与新生儿预后的相关性[2]。既往研究发现,胎盘早剥新生儿入院时部分是处于高凝状态,但重度胎盘早剥新生儿已处于低凝期或纤溶期,易发生死胎或弥散性血管内凝血(DIC)。本文探讨了60例胎盘早剥患儿的临床特征及凝血功能指标变化,现报道如下。
1 资料与方法
1.1 一般资料 选择2012年8月至2013年1月从南方医科大学八一临床医学院新生儿重症监护病房入院的胎盘早剥新生儿60例作为观察组,同时选取同期入院非胎盘早剥新生儿60例作为对照组。本试验方案经过北京军区总医院伦理委员会批准,入院患儿家长签署知情同意书。
诊断标准:(1)胎盘早剥及分度的诊断标准参考《妇产科学》(第7版),胎盘早剥分型采用国内常用分型标准;(2)新生儿胎龄按母亲末次月经计算,结合超声双顶径进行胎龄评估;(3)新生儿疾病参考《实用新生儿学》(第4版)、《实用早产与早产儿学》,妇产科疾病参考《妇产科学》(第7版)。
纳入标准:(1)观察组符合胎盘早剥的诊断标准;(2)对照组要求入院48h内无其他诊断的非胎盘早剥患儿,因“单纯早产或单纯黄疸”入院,入组前进行肝、肾、心脏、血液系统等功能检查,排除其他疾病;(3)两组胎龄、性别、时龄、出生体质量之间相互配对,差异无统计学意义(P>0.05);(4)进入试验之前要遵循知情、自愿原则,并签署知情同意书。
排除标准:(1)先天畸形、严重宫内感染致生后1周内死亡、先天性遗传代谢病;(2)达换血指标的高胆红素血症;(3)孕妇存在慢性高血压、心脏病、糖尿病、慢性肾炎等并发症;(4)孕母围产期有外科疾病,入院时间超过6h及临床资料记录不全者;(5)孕妇经说明情况后仍不能接受试验,或不愿签署知情同意书者。
1.2 方法
1.2.1 临床观察指标 记录入组新生儿相关临床资料,按设计表格,由双人独立摘录新生儿及产科的临床资料。围产期病史包括:孕妇年龄、多胎、死胎、胎膜早破、分娩方式、胎盘剥离程度、妊娠并发症(妊娠期高血压疾病、妊娠期糖尿病、羊水过多或过少、贫血、DIC)。新生儿病史:胎龄、性别、出生体质量、小于胎龄儿(SGA)、主要疾病和症状[窒息、酸中毒、贫血、吸入综合征、休克、缺氧性心肌损害、新生儿呼吸窘迫综合征(RDS)、DIC、缺血缺氧性脑病(HIE)、坏死性小肠结肠炎(NEC)、高胆红素血症(HI-BIL)]、转归预后情况(住院时间、出院时体质量、治愈率)。
1.2.2 实验室观察指标 检测入组新生儿入院及出院时活化凝血酶原时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB)及D-二聚体(D-D),仪器 TOP全自动血液凝固分析仪(美国),试剂由百泰公司提供。
1.3 统计学处理 采用SPSS17.0软件进行数据分析。计量资料以表示,组间比较采用两独立样本t检验,方差齐性采用t检验,方差不齐采用t′检验,计数资料采用构成比表示,计数资料的均衡性检验采用χ2检验,不符合χ2检验条件的采用Fisher′s精确概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1 围产期病史 观察组有2例重度胎盘早剥的产妇产后发生DIC,1例成功抢救,另1例死亡。两组进行比较,组间胎膜早破的比较差异有统计学意义(P=0.020);孕妇的妊娠期高血压疾病及妊娠糖尿病的比较差异有统计学意义(P<0.05)。两组间其余指标比较差异均无统计学意义(P>0.05)。60例胎盘早剥病例中51例(85%)为轻型,9例(15%)为重型。见表1。

表1 两组的围产期病史比较(n=60)
2.2 新生儿病史 两组进行比较,SGA、窒息、窒息程度(重度窒息)、酸中毒、贫血、电解质紊乱、缺氧性心肌损害、HIE的比较差异有统计学意义(P<0.05),其余各项指标比较差异均无统计学意义(P>0.05)。见表2。
2.3 新生儿预后及转归情况 两组住院时间的比较差异有统计学意义(P<0.05),观察组有1例入院后立即进展为重度DIC,抢救无效死亡。其余各指标比较差异无统计学意义(P>0.05)。见表3。
2.4 两组凝血功能指标比较 两组进行比较,入院时PT、APTT、FIB、D-D比较差异均有统计学意义(P<0.05),观察组PT、APTT、D-D升高,FIB下降。两组间PLT比较差异无统计学意义(P>0.05);经综合治疗后,两组间出院时各项凝血指标比较差异均无统计学意义(P>0.05),均在正常范围内。见表4。
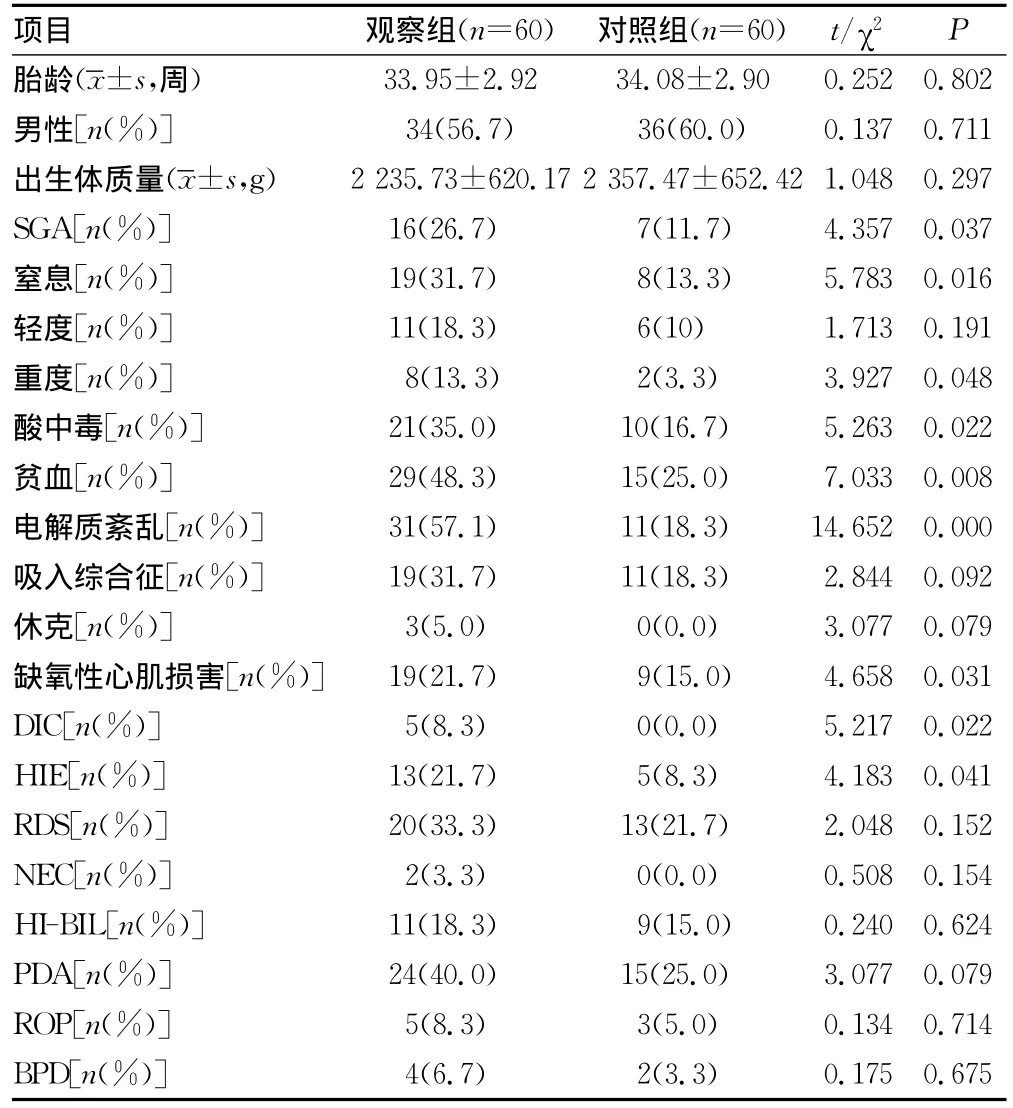
表2 两组新生儿病史比较
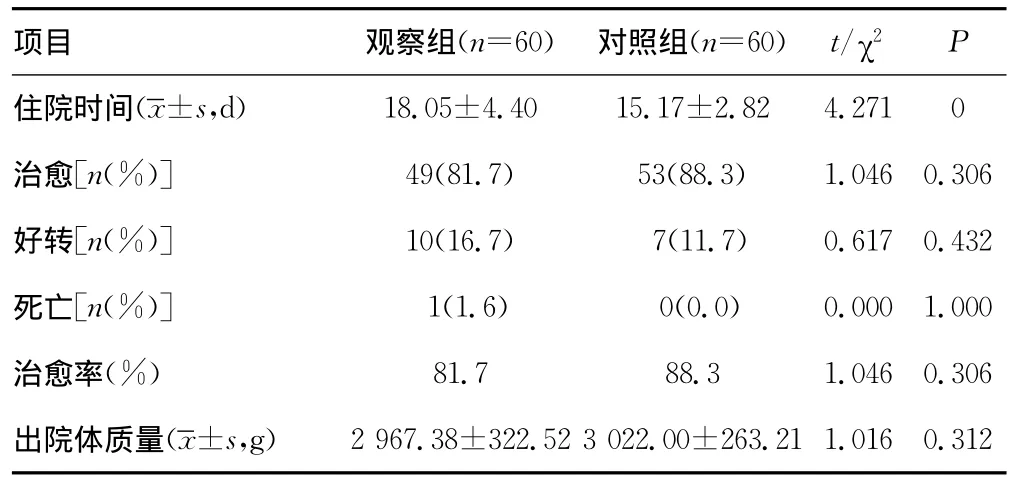
表3 两组新生儿住院时间、治愈率、出院体质量比较
表4 两组凝血功能指标比较(,n=60)

表4 两组凝血功能指标比较(,n=60)
PT(s)APTT(s)FIB(g/L)D-D(mg/L)PLT(×109/L)组别38.92±77.72280.43±71.94对照组 12.15±1.8514.07±8.2944.43±8.0442.68±6.892.67±0.502.74±0.640.23±0.110.24±0.10280.43±71.94288.75±56.56 t 4.316 0.149 7.932 0.567 6.160 0.687 7.977 1.004 0.316 0.704 P 0.000 0.882 0.000 0.572 0.000 0.493 0.000 0.31入院 出院观察组 14.11±2.9814.30±8.2673.55±27.2643.50±8.741.88±0.702.67±0.503.18±2.860.26±0.112入院 出院 入院 出院 入院 出院 入院 出院7 0.753 0.483
3 讨 论
胎盘早剥的高危因素包括妊娠期高血压疾病及糖尿病、胎膜早破、高龄产妇[3]。本研究发现,胎盘早剥产妇年龄偏大且合并妊娠期高血压疾病、妊娠期糖尿病及胎膜早破,多数为轻型胎盘早剥。娩出新生儿窒息率高,重度窒息的比例高,易出现酸中毒,贫血,电解质紊乱,缺氧缺血性损害且凝血功能异常等并发症。入组前已进行了两组间胎龄、性别、时龄、出生体质量的配对,所以胎龄、性别、出生体质量未见明显的统计学差异,并不与既往报道[4]的胎盘早剥儿多为早产儿、低出生体质量儿结论相矛盾。
3.1 围产期高危因素 凡是影响子宫胎盘灌注的因素均可导致胎盘早剥的发生,特别是慢性血管病变[5]。妊娠期高血压疾病是公认的胎盘早剥的最重要的病因,我国发病率为9.4%~10.4%[6]。子宫螺旋小动脉血管重铸,管径狭小,直接影响子宫-胎盘的灌注[7]。这类高危产妇常伴有血液浓缩、高凝状态和纤溶亢进。本研究结果显示观察组的妊娠高血压疾病发生率明显高于对照组(P<0.05),所占比例最高。
妊娠期糖尿病是由于胰岛素相对分泌不足或抵抗引起的以血糖升高的孕期代谢紊乱性疾病,滋养细胞功能和分化异常,胎盘氧化应激失衡能引起缺血缺氧损害,潜在性危害胎儿[8-9]。妊娠期糖尿病孕妇的妊娠期高血压、子痫前期、胎盘早剥以及胎膜早破的发生比例高于健康孕妇,发生如胎盘早剥等多种妊娠不良事件的风险增高。
胎膜早破后羊膜腔感染使大量白细胞积聚浸润,最终导致底蜕膜分离子宫壁[10-11]。本研究中观察组胎膜早破发生率(43.3%)明显高于对照组(23.3%)。胎盘早剥与胎膜早破有一定的相关性。一旦破水,羊水流出使脐带受压或剥离的胎盘小叶血流中断,出现宫内窘迫,增加剖宫产、出生时窒息、酸中毒的发生率。
3.2 新生儿高危因素 本资料中观察组的SGA、窒息、酸中毒、贫血、电解质紊乱、HIE、缺氧性心肌损害的发生率明显高于对照组。胎盘早剥可以追溯至孕早期,表现为一种慢性病理损害,起始是部分胎盘组织未完全浸润,继而胎盘梗死和纤维凝块形成,逐步失去有效交换表面积[12]。胎盘营养转运障碍,宫内营养供给不足,影响胎儿对营养物质的吸收[13]。娩出的胎儿多为低出生体质量儿,小于胎龄儿的比例增加。
胎盘早剥直接导致胎盘急性血供中断,娩出宫外后延续为新生儿窒息。观察组60例患儿中HIE发生率为21.7%,缺氧性心肌损害发生率为31.7%。新生儿脑代谢最旺盛,缺氧对脑组织代谢的影响最大,脑血管自主调节功能障碍、能量代谢障碍、自由基产生过多。心血管系统受累也不在少数,心肌缺氧,无氧酵解过程中酸性代谢产物堆积,心肌细胞能量代谢障碍。观察组出现低钠、低钙、低镁血症等电解质紊乱。窒息缺氧损害导致离子泵失调,离子大量内流,抗利尿激素增加,肾功能受损,甲状旁腺功能降低。
3.3 凝血功能异常 观察组与对照组除PLT外,入院时其余凝血指标均存在显著异常。胎盘早剥组入院时表现为APTT、PT延长,D-D升高,FIB下降,倾向于高凝状态。胎盘早剥使机体发生不同程度的血液学变化,凝血系统障碍,重型胎盘早剥患儿易引发DIC。本研究观察组中有1例重度胎盘早剥者发生DIC后抢救无效死亡,且观察组的凝血系统指标变化明显,与对照组相比,APTT、PT、D-D明显增加(P<0.05),提示高凝期向低凝期转化,启动了纤溶系统。在DIC进程中,通常表现为PLT进行性减低,PT、APTT进行性延长,FIB随着纤溶系统的激活进行性降低,D-D和FDP升高。观察组中60例仅2例发生DIC,但大多数伴发凝血纤溶异常,提示本研究中患儿多数仅为前DIC或DIC早期,一旦有出血征象时,已进入DIC的中晚期,常错过治疗的最佳时期。两组间入院与出院时PLT均在正常范围内,且差异无统计学意义,这可能由于研究样本例数偏少,PLT减低相对滞后,早期未能充分体现诊断价值。
经过综合治疗,胎盘早剥新生儿大多数可达治愈标准,治愈率方面无明显的差别。远期预后缺乏追踪随访资料。本研究中肝素抗凝疗效确切,应用的标准化剂量及使用指征尚未明确,有待通过下一步的临床试验进行确证。
[1]Tikkanen M.Placental abruption:epidemiology,risk factors and Consequences[J].Acta Obstet Gynecol Scand,2011,90(2):140-149.
[2]Ananth CV,Demissie K,Hanley ML.Birth weight discordancy and adverse perinatal outcomes among twin gestations in the United States:the effect of placental abruption[J].Am J Obstet Gynecol,2003,188(4):954-960.
[3]Brosens I,Pijnenborg R,Vercruysse L,et al.The"Great Obstetrical Syndromes"are associated with disorders of deep placentation [J].Am J Obstet Gynecol,2011,204(3):193-201.
[4]Ligi I,Grandvuillemin I,Andres V,et al.Low birth weight infants and the developmental programming of hypertension:a focus on vascular factors[J].Semin Perinatol,2010,34(3):188-192.
[5]Pariente G,Wiznitzer A,Sergienko R,et al.Placental abruption:critical analysis of risk factors and perinatal outcomes[J].J Matern Fetal Neonatal Med,2011,24(5):698-702.
[6]丁俊青.胎盘早剥60例临床分析[J].中国妇幼保健,2010,25(26):3709-3710.
[7]谢图强,何勉,陆兆游.胎盘早剥82例临床分析[J].新医学,2007,38(11):745-747.
[8]Sharp AN,Heazell AE,Crocker IP,et al.Placental apoptosis in health and disease[J].Am J Reprod Immunol,2010,64(3):159-169.
[9]Lappas M,Hiden U,Desoye G,et al.The role of oxidative stress in the pathophysiology of gestational diabetes mellitus[J].Antioxid Redox Signal,2011,15(12):3061-3100.
[10]黄毓丽.胎盘早剥16例临床分析[J].医学信息:上旬刊,2011,24(11):484.
[11]Wathén KA,Sarvela J,Stenman F,et al.Changes in serum concentrations of soluble vascular endothelial growth factor receptor-1after pregnancy[J].Hum Reprod,2011,26(1):221-226.
[12]Evers IM,Nikkels PG,Sikkema JM,et al.Placental pathology in women with type 1diabetes and in a control group with normal and large-for-gestational-age infants[J].Placenta,2003,24(8/9):819-825.
[13]郭惠,黄俊.血栓与止血试验的进展及标准化[J].血栓与止血学,2006,12(3):142-144.

