山梨酸钾对面包上匍枝根霉的抑制作用*
胡春红,胡灵卫,纪秀娥,朱自学,古红梅,肖艳华
1(周口师范学院 生命科学与农学学院,河南 周口,466001)2(商丘医学高等专科学校 基础医学部,河南 商丘,476100)
面包、馒头等富含淀粉质的食物易于被霉菌特别是匍枝根霉污染,导致食物霉变,造成大量的经济损失。相关文献研究表明,一些天然植物提取物[1-2]、或化学物质[3-4]、或生物抗菌剂[5-7]等对霉菌均具有较强的抑制作用。但这些杀菌剂往往存在这样或那样的缺点,如不易获取、价格昂贵、耐药性、二次污染、稳定性差等。因此,寻找一种安全、经济、方便的面包根霉杀菌剂更符合实际需要。
山梨酸(钾)是一种不饱和脂肪酸(盐),在人体内可分解为二氧化碳和水,无残留,安全性好,是联合国粮农组织和世界卫生组织联合向世界各国推荐的食品防腐剂;再加上其价格低廉及具有广普的抑菌效果,因而在食品加工中被广泛应用。本研究以匍枝根霉孢子为实验对象,以山梨酸钾为实验材料,研究不同浓度山梨酸钾对根霉孢子萌发及菌丝生长的抑制作用,同时还改良了根霉固体培养法,以其为食品等行业产品的防腐提供一定的理论依据,并为相关科研提供一定的技术方法。
1 材料与方法
1.1 实验材料
匍枝根霉(Rhizopus stolonifer Vuill )菌种,从发霉的面包上提取纯化获得。
山梨酸钾,购于天津市某化学有限公司。
1.2 实验方法
1.2.1 培养基制备
参考相关资料[8],分别配制马铃薯葡萄糖琼脂(PDA)液体和固体培养基(pH:7.2),高压灭菌后,备用。
1.2.2 倒平板
精确称取一定量山梨酸钾,置上述PDA 液体培养基内,摇匀,配制成含不同浓度的山梨酸钾(0.0、0.2、0.4、0.6、0.8、1.0、1.2 g/100 mL)的PDA 液体培养基。同法,配制含上述相同浓度梯度的山梨酸钾的PDA 固体培养基,并分别倒入无菌培养皿中,并标记为1 ~7 号,每一浓度做3 个平行。
另取标准滤纸分别沾取少量上述含不同浓度的山梨酸钾的液体培养基,贴在上述对应标号(1 ~7号)的培养皿皿盖内,同样方法,再在上面沾一层玻璃纸,盖上皿盖,置超净工作台内,备用。
1.2.3 菌种活化
取匍枝根霉的冻干管在无菌操作台内打开,用移液枪吸取少量的PDA 液体培养基(不含山梨酸钾)注入冻干管内,摇匀,制备菌悬液。用移液枪吸取少量置于PDA 固体培养基(不含山梨酸钾)上,并用涂布棒涂布均匀,置于30 ℃恒温培养箱中培养48 h,如此反复培养菌种3 代,制得活化的根霉。
1.2.4 孢子悬浮液的制备
由于根霉的菌丝较长,长出的孢子部分落到培养皿盖上。在无菌操作台内,用适量的无菌水冲洗培养皿盖内的孢子,轻轻摇匀后,用移液管吸取1 mL 放入无菌的200 mL 三角瓶内,并进行逐级稀释,同时对每个梯度的菌悬液进行平板菌落计数,直至获得合适稀释度的孢子悬液(孢子悬液浓度:3.0 × 102CFU/mL)。
1.2.5 接种与培养
采用无菌操作,用移液枪分别吸取上述孢子悬液0.4 mL,接种到上述1 ~7 号PDA 固体培养基上,并涂布均匀,28 ℃培养1 d。观察并统计根霉孢子萌发情况。然后把平皿倒置培养2 ~3 d,待玻璃纸上布满根霉菌丝后,便可以用于菌丝进一步观察研究。
1.2.6 抑菌测定方法
于上述1 ~7 号培养皿盖上,分别剪取一小块长菌丝的玻璃纸,贴在载玻片上,滴1 ~2 滴乳酸石碳酸棉染色液,制成临时装片,置于电镜下观察菌丝的生长情况,并记录数据和拍照。通过肉眼观察并记录培养皿底内菌落的生长及色泽变化情况等。
1.2.7 数据统计方法
运用SPSS16.0 统计分析软件对实验数据进行统计分析。
2 结果与分析
3.1 不同浓度的山梨酸钾对根霉孢子萌发的影响
由图1 可知,山梨酸钾对根霉孢子的萌发具有明显的抑制作用,且浓度越大,抑制效果越显著,当浓度为1.2 g/100 mL 时,抑制孢子萌发的程度可达90%。

图1 山梨酸钾对根霉孢子萌发情况的影响Fig.1 The influence of potassium sorbate on spore germination of Rhizopus Stolonifer Vuill
3.2 不同浓度的山梨酸钾对根霉菌落形态的影响
山梨酸钾不仅对根霉孢子的萌发具有抑制作用,而且影响根霉早期菌落的形态和大小。用肉眼及放大镜观察发现,根霉孢子萌发具有显著的时间效应:随山梨酸钾浓度增加,孢子萌发速度减慢;当山梨酸钾浓度在0.4 ~0.8 g/100 mL 时,根霉早期菌落(培养1 ~2 d 时的菌落)明显较小,而且由近圆形开始变成不规则形状,且逐渐裂解;当浓度达到1.0 ~1.2 g/100 mL 时抑制作用更明显,几乎无早期菌落长出。随培养时间延长,各浓度下均有菌落长出。选择3 ~6 d 内培养的根霉菌落,对其颜色、形态进行观察和拍照,见图2;用数码测微尺测量菌落高度,记录数据并统计分析和作图,见图3。

图2 山梨酸钾作用下根霉菌落形态特征(图中“%”代表“g/100mL”)Fig.2 Morphological characteristics of Rhizopus stolonifer Vuill colony under potassium sorbate
由图2 知,随山梨酸钾浓度增加,菌落直径均在逐渐减小,根霉菌落的颜色逐渐由白色变成黑色。说明,山梨酸钾抑制根霉菌丝生长并加速其老化衰退,浓度越大,抑制作用越强。
由图3 知,随山梨酸钾浓度增加,根霉菌落高度逐渐降低,当山梨酸钾浓度≥0.8 g/100 mL 时,差异达到显著水平(P <0.05)。由图3 还可以看出,随培养时间延长,各浓度下菌落高度每天增加的数量逐渐降低。这说明,浓度越高,菌丝生长速度越慢,并且山梨酸钾的抑菌效果在短时间内(6 d)有随时间延长而增强的趋势。

图3 山梨酸钾对根霉菌落高度影响的时效性Fig.3 Time-effectiveness of potassium sorbate on colony height of Rhizopus stolonifer Vuill
3.3 不同浓度的山梨酸钾对根霉菌丝生长的影响
在培养根霉3 ~6 d 内,每天进行取样和制作装片,在显微镜(10 ×10)下进行观察和拍照,并用目镜测微尺测量菌丝直径,结果见表1 及图4(菌丝照片)。
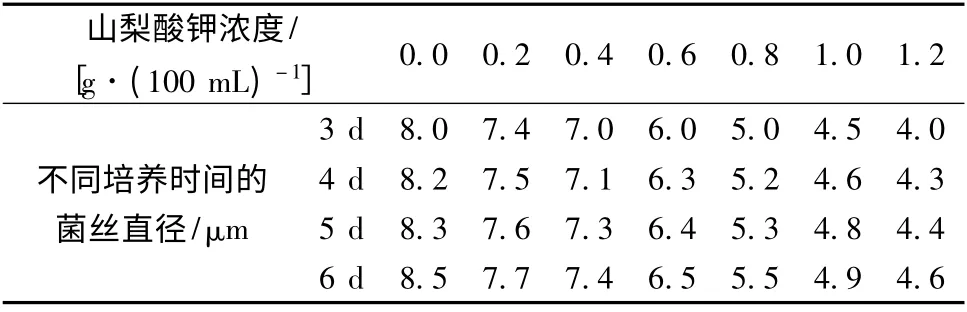
表1 山梨酸钾对根霉菌丝直径影响的时效性Table 1 Time-effectiveness of potassium sorbate on the diameter of Rhizopus hyphae

图4 山梨酸钾作用下根霉菌丝形态观察(图中“%”代表“g/100mL”)Fig.4 Morphological characteristics of Rhizopus hyphae under potassium sorbate
由表1 及图4 知,随着山梨酸钾浓度的增加,根霉的菌丝逐渐变细而弯曲;孢子囊的体积逐渐变小,囊中的孢子数量明显减少。
3 讨论与结论
实验结果表明:山梨酸钾对匍枝根霉孢子萌发和菌落生长均具有明显的抑制作用,甚至加速菌落老化而衰退,且随着山梨酸钾浓度增加这种抑制作用增强。当山梨酸钾浓度为0.8 g/100 mL 时,抑制作用达到差异显著水平,当浓度达到1.2 g/100 mL 时,90%的孢子均不能萌发。分析其抑制作用的机理,认为可能是因为山梨酸钾的主要有效成分是山梨酸,易溶于有机溶剂及醇类物质;而角固醇特别是麦角甾醇是真菌细胞膜的重要组成成份,对确保细胞膜的完整性,膜结合酶的活性,膜的流动性,细胞活力以及细胞物质运输等起着重要作用;山梨酸钾的溶解性使其可顺利穿透细胞膜进入细胞体内,破坏各种膜系统的通透性及干扰膜其他正常生理功能,从而起到抑制真菌生长的作用。另有相关研究报道,许多化学物质或天然植物提取物均可降低麦角甾醇的生物合成及质膜中麦角甾醇的含量,破坏质膜的完整性,并造成氧化损伤,使大量活性氧积累,从而启动氧化损伤式细胞凋亡程序[1,9-10]。本研究结果中山梨酸钾加速菌落老化衰退现象与前人已有相关研究一致。
山梨酸钾属酸性防腐剂,在酸性条件下,对细菌、酵母和霉菌均有明显的抑制作用,抑菌最适pH 值低于5.0 ~6.0[13-14]。而该实验所配制的PDA 培养基其pH 值为7.2,在pH 值近乎中性的环境下山梨酸钾依然表现出了较强的抑菌效果,并且随着培养时间延长,各浓度下菌丝的生长速度减慢,且山梨酸钾浓度越高,抑菌效果增强的趋势越明显。这可能是因为较高浓度的山梨酸钾显著降低了细胞膜中麦角甾醇含量,严重破坏了质膜的完整性,造成微生物代谢产生的大量酸性物质外泄,改变了培养基的环境,从而进一步增强了山梨酸钾的抑菌效果,形成良好的抑菌循环。因此,该实验结果为日常生活、生产中一些物品要求pH 值中性条件下防腐提供参考,也为扩大山梨酸钾的应用范围提供一定的理论资料。综上所述,山梨酸钾是一种更为安全、经济、方便而有效的匍枝根霉杀菌剂。
另外,本实验采用皿盖上贴滤纸和玻璃纸的方法培养真菌,可以观察到原生态的菌丝生长情况,并且操作简单而方便,该方法可为相关领域的科研和教学提供一定的技术资料。
[1] Tian J,Ban X Q,Zeng H,et al. The mechanism of antifungal action of essential oil from dill (Anethum graveolens L.)on Aspergillus flavus[J].PLoS ONE,2012,7(1):e30 147.
[2] Krishnamurthy Y L,Shashikala J. Inhibition of aflatoxin B1 production of Aspergillus flavus,isolated from soybean seeds by certain natural plant products[J].Letters in Applied Microbiology,2006,43(5):469 -474.
[3] Nesci A,Rodriguez M,Etcheverry M. Control of Aspergillus growth and aflatoxin production using antioxidants at different conditions of water activity and pH[J].Journal of Applied Microbiology,2003,95(2):279 -287.
[4] Passone M A,Resnik S L,Etcheverry M G. In vitro effect of phenolic antioxidants on germination,growth and aflatoxin B1 accumulation by peanut Aspergillus section Flavi[J].Journal of Applied Microbiology,2005,99(3):682 -691.
[5] 周启升,孙长坡,张楠,等. 拮抗放线菌$24 的鉴定及其对黄曲霉的抑制作用[J]. 微生物学通报,2009,36(12):1 832 -1 837.
[6] 邱并生. 利用拮抗物生物防治黄曲霉毒素[J]. 微生物学通报,2011,38(11):1 747.
[7] 高雅,丁文,张琦,等. 传统发酵豆瓣中产毒黄曲霉高效拮抗菌的筛选[J]. 微生物学通报,2010,37(3):369 -374.
[8] 刘国生. 微生物学实验技术[M]. 北京:科学出版社,2007:58,84 -87,125.
[9] Arthington Skaggs B A,Lee-Yang W,Ciblak M A,et al.Comparison of visual and spectrophotometric methods of broth microdilution MIC end point determination and evaluation of a sterol quantitation method for in vitro susceptibility testing of fluconazole and itraconazole against trailing and nontrailing Candida isolates[J]. Antimicrob Agents Chemother,2002,46(8):2 477 -2 481.
[10] Arthington Skaggs B A,Warnock D W,Morrison C J.Quantitation of Candida albicans ergosterol content improves the correlation between in vitro antifungal susceptibility test results and in vivo outcome after fluconazole treatment in a murine model of invasive candidiasis[J]. Antimicrob Agents Chemother,2000,44(8):2 081-2 085.
[11]胡春红,葛红莲,李季平,等. 苯甲酸钠和山梨酸钾对大肠杆菌和金黄色葡萄球菌生长的影响[J]. 食品工业科技,2011,32(4):180 -181.
[12]罗傲霜,淳泽,罗傲雪,等. 食品防腐剂的概况与发展[J]. 中国食品添加剂,2005(4):55 -58.

