复方丙酸氯倍他索涂膜剂的质控研究
庞露,陈志科,吕冠欣(.佛山市顺德区慢性病防治中心药剂科,广东佛山58300;.佛山市顺德区药品检验所,广东佛山 58300)
复方丙酸氯倍他索(Clobetasol propionate,CP)涂膜剂是佛山市顺德慢性病防治中心制剂部根据皮肤科临床需要而开发的复方制剂,主要以CP和水杨酸(Salicylic acid,SA)为主药,以聚乙烯醇(Polyvinyl alcohol,PVA17-88)为成膜材料[1],以丙二醇及薄荷油为促渗剂制成。CP为肾上腺皮质激素类药物,具有较强的抗炎、抗瘙痒和血管收缩作用,用于治疗皮肤炎症和瘙痒症等[2]。SA为皮肤科常用的消毒防腐药,价廉但实用性强,根据其使用浓度的不同有抑制细菌和真菌生长、止痒、角质溶解等作用[2]。本制剂涂于皮肤成膜后,产生水合作用促进药物透皮吸收,增强了止痒和角质溶解作用,用于结节性痒疹、角质增厚性皮肤病、皮炎及湿疹的外用疗法,使用方便安全,治疗效果良好。为了加强该制剂的质量控剂,本研究以高效液相色谱法(HPLC)法和紫外分光光度法(UV)法分别测定CP及SA含量,并取得了满意的结果。现报道如下。
1 材料
UltiMate 3000 HPLC仪、UltiMate 3000 DAD检测仪(德国戴安公司);UV-1600型紫外-可见分光光度计(北京瑞利分析仪器公司);TB125D型电子分析天平(北京赛多利斯公司)。
SA(山东新华制药股份有限公司,批号:10091,纯度:99.6%);复方CP涂膜剂(自制,批号:20110420、20110421、20110422、20120626);CP对照品(中国食品药品检定研究院,批号:100302-200001,纯度:99.3%);乙腈为色谱纯,其他试剂均为分析纯,其他辅料均为药用标准。
2 处方与制备
2.1 处方
CP 0.5 g,SA 50 g,薄荷油10 ml,PVA17-88 70 g,80%乙醇400 ml,丙二醇100 g,尼泊金乙酯1 g,纯化水适量共制成1 000 g。
2.2 制备
取PVA17-88 70 g,加入约300 ml纯化水及丙二醇充分浸泡,在水浴条件下加热使其完全溶解;另称取CP、SA用乙醇溶解,加入薄荷油搅匀,在搅拌条件下缓缓加入上述PVA17-88溶液中;最后加入尼泊金乙酯,边加边搅拌,待完全溶解,再加入纯化水至足量,搅匀分装即得。
3 质量控制
3.1 性状
本品为类白色半透明黏稠状液体,微有薄荷特臭。在皮肤涂布干燥后能形成有一定撕裂强度的薄膜。
3.2 鉴别
3.2.1 SA的鉴别。在SA含量测定项下,在299 nm波长处有最大吸收。
3.2.2 CP的鉴别。取本品少许,加乙醇1 ml混合,置水浴上加热2 min,加硝酸(1→2)数滴,摇匀,加硝酸银试液数滴,即显白色沉淀。
3.3 检查
3.3.1 pH值。取本品10 g,置于烧杯中,加蒸馏水100 ml溶解稀释后,搅拌5 min,测定pH值应在6.0~8.0之间。
3.3.2 其他。应符合2010年版《中国药典》(二部)[3]附录涂膜剂项下有关各项规定。
3.4 含量测定
3.4.1 SA的含量测定。(1)供试品溶液的制备:精密称取自制的复方CP涂膜剂0.4 g(约相当于SA 20 mg)置于100 ml量瓶中,用50%乙醇溶解并稀释至刻度,再以移液管量取稀释液5 ml于50 ml量瓶中,以50%乙醇定容并作为供试品溶液。(2)对照品溶液的制备:精密称取于105℃干燥至恒重的SA 20 mg,按上述步骤(1)操作,制得对照品溶液;另精密称量除SA外按处方量配制的阴性样品0.4 g,按“(1)”项下操作,制得阴性对照溶液。(3)测定波长选择:将上述供试品溶液、对照品溶液和阴性对照溶液以50%乙醇为空白,在250~400 nm波长范围内扫描。结果,SA及样品溶液在299 nm波长处有最大吸收,而阴性样品在此处几乎无吸收,与文献报道一致[4]。故可在299 nm波长处直接测定SA的含量。(4)标准曲线的制备:精密称取于105℃干燥至恒重的SA对照品100 mg,按“(1)”项下操作制得对照品的稀释溶液,用移液管精密量取2.0、3.0、4.0、5.0、6.0、7.0 ml分别至25 ml量瓶中,用50%乙醇稀释至刻度,配成浓度为8~28 μg/ml的标准系列溶液;以50%乙醇作为空白,在299 nm波长处测定吸光度。结果,SA浓度在8~28 μg/ml范围内与吸收度呈良好的线性关系。以吸光度(A)为纵坐标、质量浓度(c)为横坐标,进行线性回归,得回归方程为:A=0.024 8c+0.006 6(r=0.999 8)。(5)回收率试验:精密称取复方CP涂膜剂的SA阴性样品0.4 g,置于100 ml量瓶中。分别加入处方量80%、100%、120%的水杨酸对照品,即0.016、0.020、0.024 g。用50%乙醇溶解稀释至刻度,精密量取稀释液5 ml至50 ml量瓶中,用50%乙醇稀释至刻度;以50%乙醇作为空白参比,在299 nm波长处测定吸光度,按回归方程计算回收率。(6)稳定性试验:取上述供试品溶液,以50%乙醇作为空白参比,在299 nm波长处测定吸光度,于0、2、4、6、24 h分别测定SA的吸光度。按上述“(4)”项下回归方程计算其含量。结果表明,SA在24 h内基本稳定,RSD=0.19%(n=5)。(7)重复性试验:精密称取与“(5)”项下制备同一批号的阴性样品0.4 g(相当于SA 0.02 g)共6份,依法操作,以50%乙醇为空白参比,测定吸光度,按上述回归方程计算,测得平均含SA量为52 mg/g,RSD=0.91%(n=6)。(8)精密度试验:取上述对照品溶液,以50%乙醇作为空白参比,在299 nm波长处测定吸光度,按“(4)”项下回归方程计算得其含量RSD=0.17%(n=6)。UV光谱见图1,SA回收率试验结果见表1。
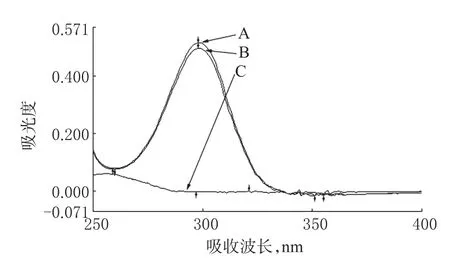
图1 UV光谱图A.SA对照品;B.供试品;C.阴性样品Fig1 UV spectrumA.SAcontrol;B.samples;C.negative samples

表1 SA回收率试验结果(n=9)Tab1 Results of recovery tests of SA(n=9)
3.4.2 CP的含量测定。(1)色谱条件:色谱柱为Agilent TC-C18(150 mm×4.6 mm,5 µm);流动相:乙腈-水(75∶25,V/V),流速:0.6 ml/min;检测波长:240 nm;进样量:10 μl;柱温:35 ℃。(2)溶液的制备:精密称定复方CP涂膜剂1 g(相当于CP 0.5 mg),置于10 ml量瓶中,加80%乙醇溶解并稀释至刻度,作为供试品溶液;取CP对照品适量,加80%乙醇溶解并稀释制成每1 ml含CP 50 μg的溶液作为对照品溶液;另取除去CP外按处方工艺配制的阴性样品1 g,置于10 ml量瓶中,加80%乙醇溶解并稀释至刻度,作为阴性对照溶液。(3)专属性试验:取上述供试品溶液、对照品溶液和阴性对照溶液,分别按“(1)”项下色谱条件进行测定,记录色谱图,可见阴性样品对测定无干扰。(4)标准曲线的制备:精密称取CP对照品10.15 mg,置于50 ml量瓶中,加80%乙醇溶解并稀释至刻度,摇匀。精密吸取1.0、2.0、3.0、4.0、5.0 ml,分别置于10 ml量瓶中,用80%乙醇稀释成20.16、40.32、60.47、80.63、100.8 μg/ml的对照品溶液。精密进样10 μl,以CP质量浓度(c,μg/ml)对峰面积(A)进行回归,得回归方程A=33 623c+14 911(r=0.999 9)。表明CA在20.16~100.8 μg/ml范围内呈良好线性关系。(5)精密度试验:取上述对照品溶液,精密进样10 μl,依法测定,以CP峰面积计算,RSD=0.77%(n=6)。(6)稳定性试验:取上述供试品溶液,在0、2、4、6、12 h分别测定CP峰面积。结果表明,12 h内CP基本稳定,RSD=0.80%(n=5)。(7)重复性试验:取供试品(批号:20110421)6份依法测定其含量,测得平均含CP量为0.525 mg/g,RSD=1.40%(n=6)。(8)回收率测定:分别称取阴性样品1 g,按处方中CP量的80%、100%、120%分别精密加入CP对照品溶液,依法测定并计算回收率。高效液相色谱见图2,CP加样回收率试验结果见表2。
3.4.3 样品测定。取涂膜剂供试品,分别按上述SA和CP的含量测定方法测定,结果见表3。
4 讨论
涂膜剂为复方制剂,用中和滴定法测定SA含量,干扰较大;而SA在紫外光区有最大吸收,且在一定的范围内浓度与吸光度有良好的线性关系,适合医院制剂快速分析[4]。
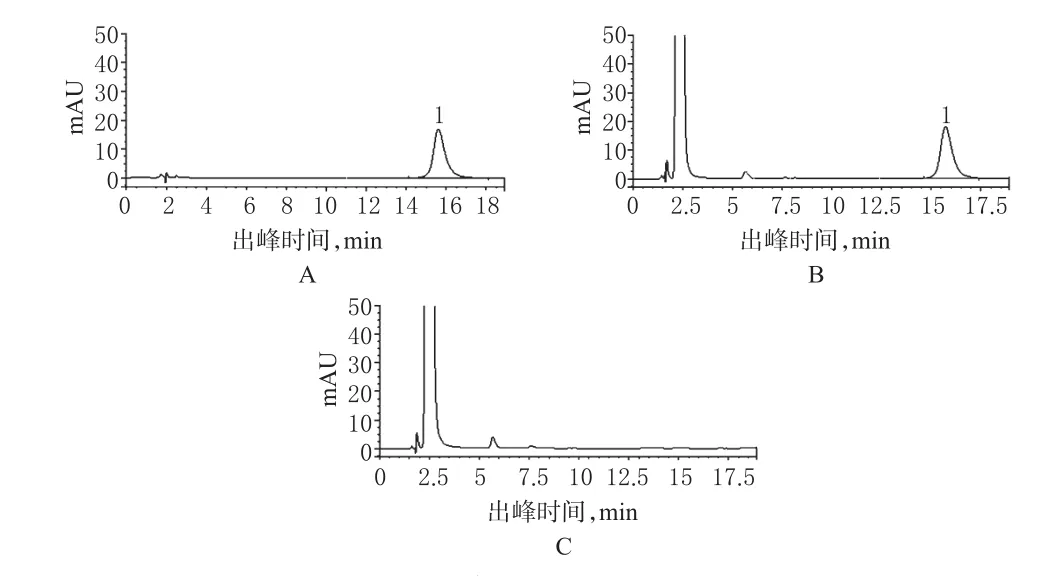
图2 高效液相色谱图A.CP对照品;B.供试品;C.阴性样品;1.CPFig2 HPLC chromatogramsA.CP control;B.samples;C.negative samples;1.CP
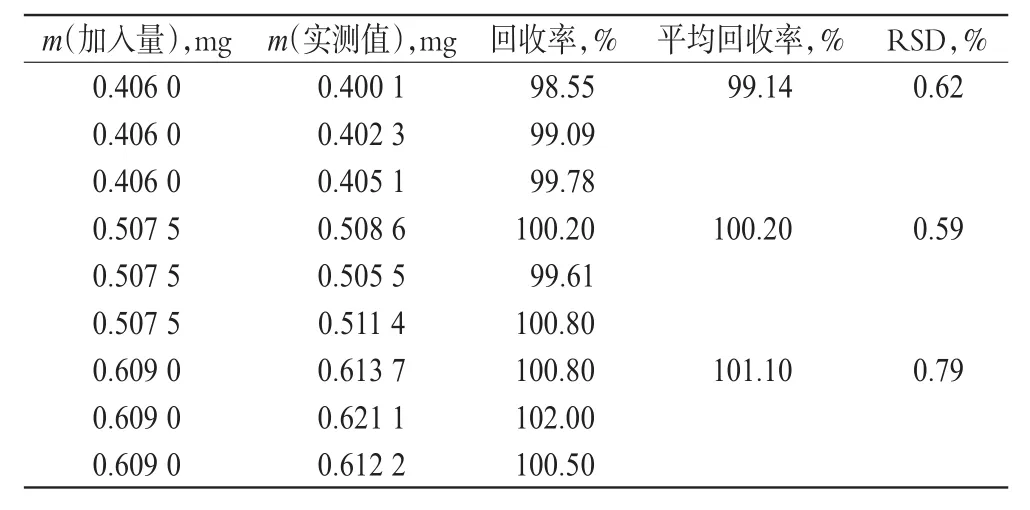
表2 CP加样回收率试验结果(n=9)Tab2 Results of recovery tests of CP(n=9)
在CP含量测定溶剂的选择中,分别用乙腈-水(70∶30,V/V)、无水乙醇试验[5]。由于处方中的辅料PVA17-88在大部分溶剂中易形成沉淀,从而影响其回收率,故本法应用80%乙醇为溶剂,能完全溶解CP又不形成沉淀,既方便又准确。采用流动相乙腈-水不同体积比对空白基质以及CP进行色谱的考察与选择,最后确定乙腈-水(75∶25,V/V)为佳,且随着体积比的减少,CP的峰形会发生改变。取CP对照品溶液,在Ulti-Mate 3000 DAD检测器上进行光谱扫描,结果显示在240 nm波长处有最大吸收,故选择240 m波长作为CP含量测定的检测波长。

表3 样品含量测定结果(n=4)Tab 3Results of content determination of samples(n=4)
复方CP涂膜剂是医院制剂室自己研究开发的外用制剂,本试验建立了制剂的质量标准(处方工艺另文报道)。对CP及SA 2种主药均进行了含量测定,采用高效液相色谱法测定CP的含量;由于水杨酸在处方中含量较大,使用紫外分光光度法测定。经方法学验证本法可满足含量测定要求,适合医院制剂的快速分析,制剂质量可控。
[1]吕慧英,刘建芳,侯艳宁.涂膜剂中成膜材料的研究和应用进展[J].华北国防医药,2009,21(3):30.
[2]陈新谦,金有豫,汤光.新编药物学[M].16版.北京:人民卫生出版社,2007:630、835.
[3]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录18.
[4]吴渝陵,范虹,罗凤琴,等.紫外分光光度法测定水杨酸软膏中水杨酸含量[J].药物鉴定,2006,15(6):19.
[5]李旭梅,祝永明,涂厉标.HPLC法测定丙酸氯倍他索搽剂的含量[J].中国临床药学杂志,2007,16(1):51.

