部分蔷薇属种质资源的白粉病抗性评价1)
王蕴红 王金耀 张启翔 罗 乐 于 超 潘会堂
(北京林业大学,北京,100083)
月季(Rosa spp.)是世界性的重要观赏植物之一。月季白粉病(Podosphaera pannosa)是世界性病害,在月季栽培区均有发生,同时也是温室栽培月季类的最主要真菌病害[1-2]。病情严重时会引起早落叶、枯梢、花蕾畸形或完全不能开放,降低切花产量和观赏性,连年发生则严重削弱植株的长势[3]。培育对白粉病抗性强的月季品种,一直是月季育种的一项重要挑战,但成功者寥寥无几。主要原因在于现代月季品种的基因库中缺乏白粉病高抗性的基因,对抗性机制的了解有限,白粉病病原菌生理小种具有高度多样性和变异性[2],以及缺少筛选抗病性材料的可靠方法[4]。近几十年来,研究者评价了许多蔷薇属资源的白粉病抗性,尤其是月季栽培品种,但是免疫的品种却寥寥无几[4-8]。并且由于白粉病病原菌生理小种多样性,容易发生变异,原来许多高抗病的资源已经失去了其优良的抗性特质,如‘明星’(‘Super Star’)月季[9]。
现代月季品种尽管非常丰富,观赏价值高,但在抗病性等方面仍有不足,急需引入更优良的蔷薇遗传资源[10]。而众多的野生蔷薇属优良种质资源尚未被开发利用,基础研究匮乏。因此,了解以及评价野生蔷薇资源对白粉病的抗性,筛选具有较高抗性甚至免疫的蔷薇属植物种质资源,对培育具有较高抗性的月季新品种具有重要意义。陈俊愉院士曾对新疆的野生蔷薇资源予以高度评价,认为在新疆原产的野生蔷薇中,一些高度抗寒、抗旱、抗病的种类是最有希望和最有价值的月季育种材料[11]。在此背景下,本试验在观察白粉病病原菌侵染过程的基础上,对5种10份新疆野生蔷薇种质资源和4个月季栽培品种进行了白粉病抗性评价,旨在筛选出具有优良抗病基因的新疆野生蔷薇属种质,用于月季新品种的培育工作。
1 材料与方法
供试材料为从新疆不同地域收集的蔷薇属植物(表1),包括4份弯刺蔷薇(Rosa beggeriana)、3份疏花蔷薇(R.laxa)、伊犁蔷薇(R.iliensis)、喀什蔷薇(R.laxa var.kaschgarica)、尖刺蔷薇(R.oxyacantha),以及‘红衣主教’(‘Kardinal’)、‘黑魔术’(‘Black Magic’)、‘桔囊’(‘Ju Nang’)、‘太阳城’(‘Sun City’)4个月季品种。所有蔷薇属原种均以《中国植物志》[12]及《Flora of China》[13]为鉴定依据。
月季栽培品种的供试材料为1 a龄扦插苗,野生蔷薇资源为1 a龄种苗,每盆栽植1株。在供试叶片生长阶段,不使用任何杀菌剂,生长状况良好,无任何病虫害。所有供试材料的叶龄均为30~45 d,置于塑料棚内进行染菌处理。塑料棚内日均温度为21℃,平均相对湿度为78%。

表1 10份野生蔷薇属材料基本信息
月季白粉病菌源采自国家花卉工程技术研究中心(北京林业大学)小汤山种质资源圃内,从染病的盆栽月季植株上收集新鲜的病原菌孢子。
接种方法:接种方法参照李卉的方法[14],从染病的盆栽月季植株上收集新鲜的病原菌孢子,用自来水混合成孢子悬浮液,加入1~2滴吐温20。使用血球计数板,调节孢子密度在104~105个·mL-1。迅速将孢子悬浮液均匀喷洒在供试植株叶片上,喷雾的剂量为60 mL·m-2。全部喷洒完毕后,再将喷有同等剂量清水的对照植株放入。试验采用完全随机区组设计,每品种处理12株。设置30株作为对照。
白粉病病原菌侵染过程观察:参照Achuo et al.[15]的方法,以‘黑魔术’为观察材料,在接种病原菌后的第24、48、72、96、120 h 分别采集5 枚叶片,固定液V(无水乙醇):V(冰醋酸)=3∶1,固定20 h后,流水冲洗4 h,之后置于保存液V(乳酸):V(甘油):V(水)=1∶1∶1内,放入冰箱内于4℃保存。观察时制作成临时装片,用染色液(每10 mL蒸馏水中加入苯胺蓝0.02 g,使用前以2倍体积的无水乙醇稀释)染色。
白粉病抗性评价:病情调查(分级标准见表2)时间为从可以清晰观察到病症(接种后4d)起,直至易感病植株几乎完全染病(接种后15d前后)为止(图1)。
根据公式计算出群体发病的病情指数、相对病情指数及相对抗性指数[7-8,14]。
此两例仅见于《齐》,《周》无,且都与“不”连用,构成双重否定,表强调,“靡”主要在先秦两汉使用,此时期不太盛行。
病情指数=Σ(病级株数×病级)/(株数总和×发病最重级)×100%。
相对抗性指数=1-相对病情指数。
相对病情指数=品种病情指数/对照品种病情指数(病情指数最高者为对照品种)。
抗病程度分为免疫(I)、高抗(HR)、中抗(MR)、中感(MS)、高感(HS)5类,相对抗性指数分别为 1.00、0.80 ~0.99、0.40 ~0.79、0.20 ~0.39 和0.20 以下。

表2 月季白粉病病情分级标准

图1 月季白粉病病情分级示意图
病情发展过程分析:参照Yan的方法[4],观察并记录从喷洒孢子悬浮液到初次有病症可见的时间,即潜伏时间LP(latent period)。每24 h观测1次,并计算病情级别的发展速率RSD(rate of symptom development)。病情级别的发展速率等于接种病原菌后第11 d的病情级别数与初次有病症可见到侵染后第11 d的时间间隔的比率。
2 结果与分析
2.1 白粉病病原菌侵染过程观察
从图2中可看出,接种白粉病病原菌后,‘黑魔术’叶片上的白粉病菌菌丝数量随着接种后的时间延长而逐渐增加。病原菌孢子在接种后24 h开始萌发;48 h后长出菌丝;72 h后形成的菌丝数量明显增多,形成次生菌丝体;96 h后大量的菌丝形成,开始以丝状连接在一起;接种120 h后,大量分生孢子梗出现,此时叶片上出现了肉眼可见的病斑。结果表明,白粉病病原菌侵染叶片的过程在接种后96~120 h即可完成。
2.2 白粉病抗性评价

图2 病原菌在月季品种‘黑魔术’叶片表面的生长过程

表3 供试材料的白粉病抗性表现
方差分析(表4)表明,各供试材料白粉病抗性在区组间的差异不明显,而不同的供试材料表现出的白粉病抗性具有极显著的差异。

表4 供试材料白粉病抗性方差分析
2.3 病情发展过程分析
侵染后的第11 d起,二次侵染愈加明显。随着侵染强度的增加,不同供试材料间抗性差别评价的准确性有所降低。因此,选择供试材料第11 d的病情级别作为分析比较依据[4]。
2.3.1 白粉病的潜伏时间
从表5可知,白粉病在供试材料上潜伏时间较多分布在5、6、8 d(各4份种质材料)。潜伏期为7 d的材料只有2个,占供试材料总数的14.29%。月季栽培品种的白粉病病原菌潜伏期多数为5~6 d,而野生蔷薇种质的白粉病病原菌潜伏期多数为7~8 d。白粉病的潜伏时间越久,表明白粉病病原菌菌丝生长缓慢。这表明,病原菌和寄主的识别以及抗病材料的抗病反应会因材料的不同而有所差异。
2.3.2 供试材料的病级
从表5可知,接种病原菌后的第11 d,供试材料病级在0.01~0.50的分布最多(7个),其次为分布在2.01~2.50 的(3 个)。其中,病情级别在0.01 ~0.50的材料占供试材料总数的50%。
病级越高,表明感染白粉病的程度越重,白粉病抗性越差。供试材料中,尖刺蔷薇、疏花蔷薇1号、弯刺蔷薇2号的病情级别最低,分别为0.08、0.13和0.14;‘红衣主教’、‘黑魔术’的病情级别较低,分别为0.30和0.44;‘桔囊’、‘太阳城’的病情级别较高,分别为2.00和2.08;伊犁蔷薇、弯刺蔷薇1号的病情级别最高,分别为2.23和2.37。
2.3.3 病级的发展速率
从表5可知,供试材料病级的发展速率最多分布在0~0.10(6个),其次分布在 0.30~0.40(4个)。其中病级的发展速率在0~0.10的材料占供试材料总数的42.86%。病情发展速率越快,表明白粉病病原菌菌丝生长的速度越快,材料的白粉病抗性也就越差。
供试材料中,病情级别发展速率最快的为弯刺蔷薇1号(0.42),最慢的为尖刺蔷薇(0.02),其余的发展速率由大到小的顺序为:‘太阳城’(0.38)、伊犁蔷薇(0.37)、弯刺蔷薇 3号(0.35)、‘桔囊’(0.33)、疏花蔷薇 3 号(0.08)、‘黑魔术’(0.07)、‘红衣主教’(0.05)、弯刺蔷薇 2 号(0.04)、疏花蔷薇1 号(0.04)。

表5 供试材料的病情表现
3种病情指标的方差分析(表6)表明,各供试材料在白粉病的潜伏时间、病级和病级的发展速率3方面的差异均达到极显著水平。
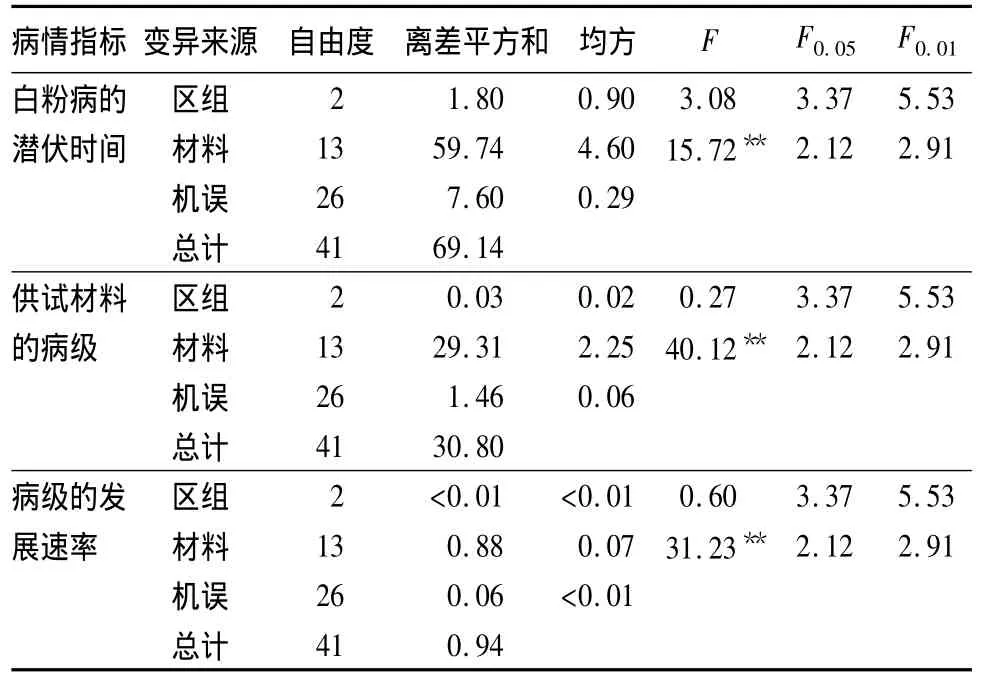
表6 3种病情指标的方差分析
3 结论与讨论
白粉病病原菌侵染叶片的过程在接种后96~120 h即可完成。当条件适宜时,病菌经72 h即可完成其无性循环,在田间则需时7~10 d[17]。这种差异可能是由于试验环境温湿度的差异造成的,也就意味着白粉病病原菌侵染过程极易受到外界环境条件的影响。不同供试材料的白粉病潜伏时间也有差异,原因可能是病原菌和寄主的识别以及材料的抗病反应时间不同造成的,也导致了病情发展的速率不同。病情发展速率越快,代表着材料的抗病性越差,白粉病越容易扩散、蔓延。因此,需要进一步试验探明月季白粉病侵染过程中病原与植物互作的关键时期,这样有助于探讨植株对白粉病抗性存在差异的原因。
中国原产的蔷薇属植物有82种,约占全世界总数的41%,是野生蔷薇的主要分布区之一。而新疆分布的蔷薇属资源在全国范围内仅次于云南、四川,位居第三[18],在西北地区位居首位,是西北抗逆蔷薇资源最丰富的地区之一[16]。然而,目前国内尚未有人对分布于新疆的野生蔷薇属资源进行白粉病的抗性评价。资源利用的盲目性会导致育种效率低,人力、物力的严重浪费。因此,开展野生蔷薇属资源抗性评价,可以为培育具有抗白粉病的月季新品种提供选择亲本的依据。
对收集、保存的10份新疆蔷薇属野生资源和4个月季品种进行了白粉病抗性评价,其中弯刺蔷薇2号、尖刺蔷薇表现出了很高的白粉病抗性,且表现均优于供试的月季品种,说明了新疆野生蔷薇属资源中包含着重要的抗白粉病种质资源,可以作为优良亲本用于现代月季新品种的培育工作,以期得到观赏性状优良、具有较高抗病性的月季新品种。本试验中,弯刺蔷薇4个不同群体的白粉病抗性差异较大,其中弯刺蔷薇2号为高抗材料,弯刺蔷薇3号和弯刺蔷薇4号为中抗材料,而弯刺蔷薇1号为高感材料。即同一野生种的不同株系表现出了抗病的异质性,此现象同样普遍存在于小麦[19]和葡萄[20]的野生种中。
[1] Horst R K.Compendium of rose diseases[M].St Paul Minn:The American Phytopathological Society Press,1983:1-50.
[2] Linde M,Debener T.Isolation and identification of eight races of powdery mildew of roses(Podosphaera pannos Wallr.Fr.)de Bary and the genetic analysis of the resistance gene Rpp1[J].Theor Appl Genet,2003,107:256-262.
[3] 李怀方.园艺植物病理学[M].北京:中国农业大学出版社,2001.
[4] Yan Zifu,Oene D,Theo W P,et al.Assessment of partial resistance to powdery mildew(Podosphaera pannosa)in a tetraploid rose population using a spore-suspension inoculation method[J].European Journal of Plant Pathology,2006,114:301-308.
[5] Atkiss L.Disease resistant rose varieties[J].American Rose Annual,1978,63:99-104.
[6] 黄善武,葛红.月季抗病资源及抗病遗传[J].中国花卉盆景,1992(10):14.
[7] 张喜萍,许修宏,龚束芳.月季抗白粉病资源的筛选[J].东北林业大学学报,2002,30(6):93-94.
[8] 张颢,杨秀梅,王继华,等.云南蔷薇属部分种质资源对白粉病的抗性鉴定[J].植物保护,2009,35(4):131-133.
[9] Spencer D M.The Powdery Mildews[M].London:Academic Press,1978:429.
[10] 刘永刚,刘青林.月季遗传资源的评价与利用[J].植物遗传资源学报,2004,5(1):87-90.
[11] 陈俊愉.从中国选育出更多月季新品来[J].花木盆景(花卉园艺),1997(1):10-11.
[12] 中国科学院中国植物志编辑委员会,中国植物志:第37卷[M].北京:科学出版社,1985:368-406.
[13] Wu Zhengyi,Raven P H,Hong D Y.Flora of China:Volume 9,Rosaceae[M].Beijing:Science Press,2003:46-434.
[14] 李卉.月季抗白粉病育种初步研究[D].北京:北京林业大学园林学院,2010.
[15] Achuo E A,Audenaert K,Meziane H,et al.The salicylic aciddependent defence pathway is effective against different pathogens in tomato and tobacco[J].Plant Pathology,2004,53:65-72.
[16] 罗乐.西北三省及北京野生蔷薇属种质资源调查引种及月季抗白粉病育种研究[D].北京:北京林业大学园林学院,2011.
[17] 张斌,李安答.月季白粉病的发生及防治研究进展[J].贵州农业科学,2009,37(11):95-97.
[18] 刘士侠,丛者福.新疆蔷薇[M].乌鲁木齐:新疆科技卫生出版社,2000.
[19] 陈尚安,董玉琛,周荣华,等.小麦野生近缘植物抗病性鉴定[J].中国农业科学,1990,23(1):54-59.
[20] 贺普超,王跃进,王国英,等.中国葡萄属野生种抗病性的研究[J].中国农业科学,1991,24(3):50-56.

