水分胁迫对蛇莓、娟毛匍匐委陵菜抗氧化保护酶系统的影响
张迎新 李长海 周玉迁
(黑龙江省森林植物园(黑龙江省森林经营研究所),哈尔滨,150040)
近年来由于气候变化的影响,各个地区雨水分布发生了很大的改变。过旱或过涝等极端天气不断出现,对植物生长有着巨大影响,甚至导致死亡。在自然界中,植物细胞通过各种途径产生活性氧自由基。在正常的情况下,植物细胞内自由基的产生与清除处于动态平衡状态,自由基对植物体不会产生不良影响。但由于某种环境或自身的原因,如环境中水分过多或过少时就会打破这种动态的平衡,产生无法清除的自由基离子,使植物细胞受到伤害以至死亡[1]。植物在受到水分胁迫时,活性氧的积累使植物体内细胞中生物的活性氧物质(ROS)含量迅速上升。当水分胁迫达到一定程度时,导致膜质过氧化,并使细胞膜受到损伤,最终造成细胞伤害乃至死亡,因而活性氧物质的影响是一个重要的因素[2-3]。而细胞中清除活性氧保护酶系统的存在和活性的增强是细胞免于伤害或抗性增强的主要原因之一。细胞内的保护酶系统主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等[4]。超氧化物歧化酶和过氧化物酶是分解活性氧物质的重要酶类。笔者选取在北方地区生长良好,对水分条件要求不高,且已大量应用的两种地被植物蛇莓(Duchesnea indica)和娟毛匍匐委陵菜(Potentilla reptans L.)作为研究对象,采取两种极端水分条件,即持续的自然干旱和持续的覆水条件,研究不同水分胁迫对其保护酶系统的影响,探讨其对水分的适应性能力,为两种植物的利用提供理论依据。
1 试验地基本概况
试验地设在黑龙江省森林植物园。其地处黑龙江省哈尔滨市,属于寒温带半湿润季风性气候。海拔高为146m。地理坐标为东经126°38'22.13″~126°38'56.55″,北纬 45°41'22.62″~ 42'37.50″。本区是典型的东北地区温带、寒温带森林植被区系。结冰期达5个月之久。平均无霜期150 d左右。年平均气温3.6℃,年大于等于10℃积温为2 757.8℃,年大于0℃积温为3 080℃。极端最高气温达39.3℃。极端最低气温为-41.4℃,1月平均气温为-17.5℃,7月平均气温为21℃。年平均降水量为560.9 mm,降水主要集中在7、8月份。相对湿度为68%。区域内冬季多西北风,夏季多西南和东南风,平均风速3.8 m/s。年平均日照时数为2 636.9 h,年平均相对湿度为65%。最深冻土层为1.7 m。
2 材料与方法
材料 试验在黑龙江省森林植物园温室塑料大棚中进行。选取移栽3年生的生长健壮的两种地被植物蛇莓(Duchesnea indica)、绢毛匍匐委陵菜(Potentilla reptans L.)各150株,分别栽植于以腐殖土为基质的塑料桶中(21 cm×24 cm)培养。8月初,每个种选取生长相近的健壮苗木90盆移入塑料温室大棚中,正常养护管理15 d左右。
试验设计 在试验前7 d对所有的植株进行浇水处理,使每盆土壤处于饱和含水状态。然后设3种处理:A——对照、B——自然干旱、C——覆水,设3个区组3次重复。
A——对照(CK):给对照处理的植株正常浇水管理,使其不受水分胁迫;
B——自然干旱:对自然干旱处理的植株不浇水,并且做防雨处理,使其处于干旱胁迫状态,以研究其耐旱性;
C——覆水:对覆水处理的植物及时灌水,水面始终高于土面1~2 cm,使植物处于水涝胁迫状态,以研究其耐涝性。
于胁迫 0、5、10、15、20 d 上午 7:00—8:00,在试验植株上选取成熟健壮叶片置于冰盒内,测定各项生理指标。
土壤含水量保持的状态采用WET(英国)三参数仪测定,然后根据每天的失水量,补充相应失去的水分,使其保持设定的含水量。试验期间,大棚内白天温度20~35℃,夜间15~20℃,日平均光照强度750 μmol·m-2·s-1。
试验指标测定 超氧化物岐化酶(SOD)活性采用氮蓝四唑法(NBT)[5]测定;过氧化氢酶(CAT)活性采用紫外吸收法[6]测定;过氧化物酶(POD)活性采用愈创木酚显色法[7]进行测定。
3 结果与分析
3.1 水分胁迫对蛇莓、娟毛匍匐委陵菜叶片内超氧化物歧化酶(SOD)活性的影响
超氧化物歧化酶(SOD)能够催化超氧化物阴离子自由基(O-2)的歧化作用,保护膜结构的完整性,从而使植物在一定程度上忍耐水分胁迫[8]。在水分胁迫初期,蛇莓在覆水和干旱胁迫下SOD值的变化很大,明显高于对照,并且在两种条件下变化基本同步(表1)。说明蛇莓耐水分胁迫能力较强,无论在干旱或覆水胁迫条件下,SOD活性都具有很好的保护作用,使蛇莓能承受极端水分条件的时间较长。
在覆水和干旱胁迫条件下的整个试验中,绢毛匍匐委陵菜叶片的SOD活性与正常水平相比变化不显著,只是略高于对照值(表2)。在水分胁迫的前期和后期,SOD值对干旱的反映要比覆水条件下明显,并均高于正常水平的对照值。在干旱条件下,绢毛匍匐委陵菜保持SOD活性的能力相对较强,耐干旱能力优于耐水淹能力。说明绢毛匍匐委陵菜对水分胁迫有较强的适应性,能承受长时间的干旱或覆水胁迫。

表1 不同水分状况下蛇莓的SOD值
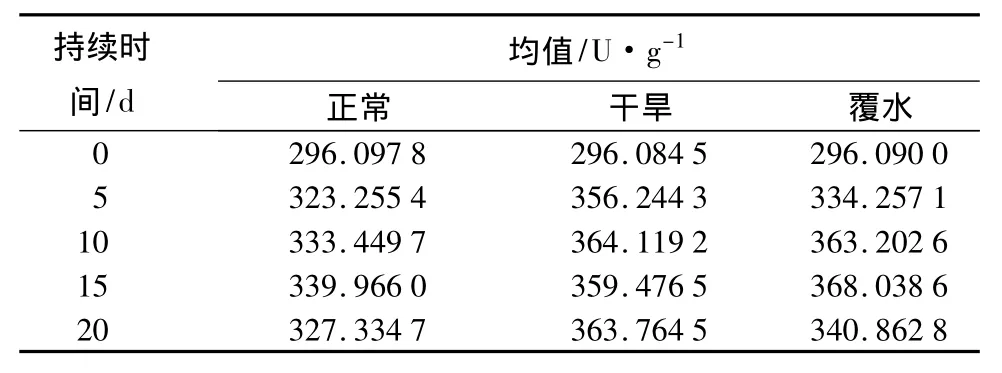
表2 不同水分状况下绢毛匍匐委陵菜的SOD值
3.2 水分胁迫对蛇莓、娟毛匍匐委陵菜叶片内过氧化氢酶(CAT)活性的影响
过氧化氢酶(CAT)也是细胞内抗氧化防御酶之一,在清除自由基系统中的作用是阻止生物自由基连锁反应的进一步发生,从而起到酶防御系统的保护作用。在干旱性胁迫下,蛇莓的CAT值低于对照,但降幅不明显(表3)。在覆水胁迫下,蛇莓的CAT值在前期低于对照,到中期后迅速上升并达到峰值,且增幅十分明显,以后又下降且低于对照,导致蛇莓耐水淹的能力有所下降。总体上,蛇莓CAT活性对水分胁迫的适应性较强,能够承受长时间的干旱或覆水胁迫,且耐水淹性强于耐旱性。

表3 不同水分状况下蛇莓的CAT值
绢毛匍匐委陵菜与对照相比,在干旱胁迫下其CAT值均高于对照,增幅逐渐增大,末期达到最大(表4)。在覆水胁迫下,绢毛匍匐委陵菜CAT值前期比对照低,后期又比对照高,降幅和增幅都十分明显,说明绢毛匍匐委陵菜对水分胁迫的适应性较强,能够承受长时间的干旱或覆水胁迫,其耐旱性强于耐涝性。
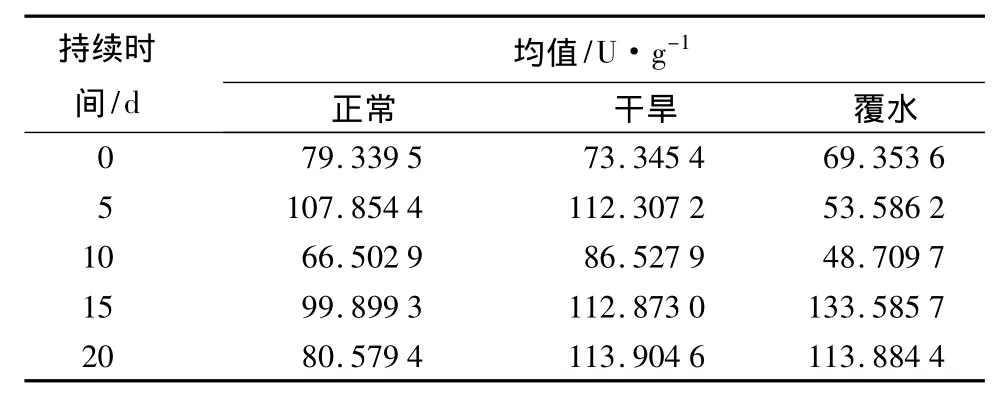
表4 不同水分状况下绢毛匍匐委陵菜的CAT值
3.3 水分胁迫对蛇莓、娟毛匍匐委陵菜叶片内过氧化物酶(POD)活性的影响
过氧化物酶(POD)能清除植物体内过多的H2O2,可使细胞免遭膜脂过氧化作用引起的伤害[9]。试验的两种地被植物POD活性在水分胁迫下都存在下降趋势,并且十分剧烈,只是在一定时期内活性有少量的提高(表5、表6)。蛇莓叶片中的POD活性,在胁迫中期水淹条件下的值大于干旱条件下的值,而后期在干旱条件下的值大于水淹条件的值。由此可以说明,POD活性对蛇莓的影响随时间的变化有不同的反映。在水淹的中后期,绢毛匍匐委陵菜叶片中的POD活性值明显较大,说明POD酶活性对绢毛匍匐委陵菜耐水淹的影响大于其耐干旱的影响。从蛇莓和绢毛匍匐委陵菜都具有很强的抗水分胁迫能力上看,在胁迫前期,POD的活性值较小,清除植物体内过多H2O2的能力较弱;在胁迫的中、后期,随着POD活性值的增加,清除能力也渐逐增加,但仍没有超过对照,说明POD不是主要的酶防御系统,起重要防御作用的是其它的酶系统。

表5 不同水分状况下蛇莓的POD值

表6 不同水分状况下绢毛匍匐委陵菜的POD值
4 结论与讨论
当发生水分胁迫时,植物体内存在清除活性氧自由基的SOD、POD、CAT等保护酶,会在一定程度上保护细胞膜[10]。但在水分过多或过少的胁迫条件下,对植株来说酶系统反应有差异。水分胁迫下,植物体内的SOD活性与植物的抗氧化能力呈正相关关系,轻度或短期水分胁迫下植物SOD活性呈上升趋势,而在严重或长期胁迫条件下则出现下降趋势[11]。水分胁迫促使植物产生活性氧自由基,当活性氧自由基超过一定限度时,就会打破产生与消除活性氧自由基的平衡,就会诱导植物保护酶活性的提高,以有效地清除活性氧来恢复平衡状态,使细胞免于伤害或减轻伤害[12-14]。本研究得出的结论也证明了这一点,且在相同的水分胁迫条件下,不同的植物对水分胁迫的反应也不同。在相应的覆水和干旱胁迫条件下,对蛇莓、绢毛匍匐委陵菜SOD活性的影响基本同步,且蛇莓反应明显强于绢毛匍匐委陵菜。蛇莓耐水淹和耐干旱的能力基本相同。在干旱时,绢毛匍匐委陵菜随着胁迫时间的延长体内SOD活性逐渐增大,且均明显高于正常水平;在水淹的后期,则随着胁迫的加重而逐渐降低,说明其耐干旱的能力强于耐水淹。水分胁迫下,蛇莓和绢毛匍匐委陵菜的CAT活性值随处理时间的不同而出现了明显的分化。蛇莓的CAT活性先上升,以后逐渐下降,与对照相比基本变化不大,说明可能在水分胁迫的前期,酶系统中CAT起主要防御作用,但随着胁迫的加剧,CAT的防御作用逐渐衰弱,处于次要地位,防御能力也在衰弱。绢毛匍匐委陵菜的CAT活性值在胁迫初期并没有马上提高,而是在后期有一个较大的增加,尤其是在覆水条件下的表现更为明显,即说明酶活性越高,消除活性氧自由基的能力也越强,植物的抗逆性也越强。所以,绢毛匍匐委陵菜的耐水淹能力要强于耐干旱能力。总体上,在水分胁迫的初期,植物体内保护酶受到活性氧自由基的诱导,活性上升,清除自由基能力提高,但随着水分胁迫的加剧,保护酶系统就会被破坏而使其活性下降,植株对活性氧自由基和过氧化物的防御能力减弱,其减弱的速度越慢,则抗性越强。植物保护酶系统的作用是一个多种酶共同作用的结果。不同种类的酶,其介入作用的时期以及介入的强度均不同。植物对水分胁迫的抗性能力可能是一种或几种酶起到主导作用,而其他的酶只起到辅助作用,甚至不起作用。
在酶系统对水分胁迫影响的反应方面,蛇莓和绢毛匍匐委陵菜耐水分胁迫的酶系统中,SOD、CAT活性对蛇莓、绢毛匍匐委陵菜的影响较大,而POD活性影响很小。POD活性不是主要的防御酶系统,起重要防御作用的是其它的酶系统。随着胁迫的加剧,蛇莓在SOD活性方面的数据都好于绢毛匍匐委陵菜,而从CAT和POD活性方面的数据看,对这两种植物影响程度的差别不大。
[1] 彭立新,束怀瑞,李德全,等.水分胁迫对苹果属植物抗氧化酶活性的影响研究[J],中国农业生态学报,2004,12(3):44-46.
[2] McCord J M,Fridovich I.Superoxide dismutase:an enzymic function for erythrocuprein(hemocuprein)[J].Journal of Biological Chemistry,1969,244(22):6049-6055.
[3] Tambussi E A,Bartoli C G,Beltrano J,et al.Oxidative damage to thylakoid proteins in water-stressed leaves of wheat(Triticum aestivum)[J].Physiol Plant,2000,108(4):398-404.
[4] 王贺正,马均,李旭毅,等.水分胁迫对水稻结实期活性氧产生和保护系统的影响[J].中国农业科学,2007,40(7):1379-1387.
[5] 曹锡清.脂质过氧化对细胞与机体的作用[J].生物化学和生物物理进展,1986(2):17-23.
[6] Giannopolitis C N,Ries S K.Superoxide dismutase purification and quantitative relationship with water-soluble protein in seedlings[J].Plant Physiol,1977,59(2):315-318.
[7] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[8] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004.
[9] 熊正英,薛晓龙,洪尼宁,等.水分胁迫对水、旱稻幼苗SOD活性的影响[J].陕西师大学报:自然科学版,1990,18(3):61-64,69.
[10] Rosen G M,Ranckman E J.Spin trapping of superoxide and hydroxyl radical[J].Methods Enzymol,1984,105:198-209.
[11] 李少锋,李志辉,刘友全,等.水分胁迫对椿叶花椒抗氧化酶活性等指标的影响[J].中南林业科技大学学报,2008,28(2):29-33.
[12] 林桂芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧化物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.
[13] 彭立新,吴迪,李慧,等.水分胁迫对沙枣幼苗抗氧化酶活性的影响[J],天津农学院学报,2007,14(1):1-4.
[14] 欧毅,王进,吴天强,等.水分胁迫对桃形李叶片含水量、质膜透性和抗氧化酶活性的影响[J].西南农业学报,2007,20(5):982-985.

