膜分离制备红松松塔多糖的研究
张曜武,冯雪
(青岛科技大学 化工学院,山东 青岛 266042)
松科植物红松(Pinus koraiensis Sieb.et Zucc)松塔中含有萜类及多糖等多种重要天然成分[1],药理研究结果显示松塔多糖具有调节免疫机能、抑制肿瘤以及抗氧化、抗菌等诸多功效[2],具有良好的应用前景。
与水提醇沉法等多糖制备的传统方法相比,膜分离制备技术具有许多明显优势[3],本研究中尝试将膜分离技术用于红松松塔多糖制备,文献中尚未见有同类工作报道。实验中重点考察了微滤过程中料液温度、操作压力和料液浓度等对膜通量的影响,并通过正交实验确定了最佳微滤条件;由于多糖的不同分子量组分常呈现不同活性[4],因此本实验中还采用了不同截留分子量的超滤膜对红松松塔多糖进行分级制备,获得了不同分子量的红松松塔多糖,及其分子量分布的大致规律,以期为后续活性研究和工业化开发提供参考。
1 材料与仪器
1.1 材料
红松松塔(产地:东北地区)、酚酞指示液、氢氧化钠、硫酸、苯酚、亚硫酸钠、酒石酸钾钠、3,5-二硝基水杨酸、盐酸(以上试剂均为分析纯)。
1.2 仪器
FA1004N型电子天平(上海精密科学仪器有限公司),SHZ-III式循环水真空泵(上海亚荣生化仪器厂),TGT-16C型台式高速离心机(上海安亭科学仪器厂),RE-52型旋转蒸发仪(上海亚荣生化仪器厂),LD-800粉碎机(长沙市岳麓区常宏制药机械设备厂),电热鼓风干燥箱(天津市泰斯特仪器有限公司),0.2μm中空纤维微滤膜(天津膜天膜科技股份有限公司),截留分子量分别为6kDa、10kDa、50 kDa、100kDa的中空纤维超滤膜(天津膜天膜科技股份有限公司)。
2 实验方法与结果
2.1 红松松塔多糖含量的测定
本实验采用DNS比色法进行红松松塔多糖含量测定。
2.1.1 标准曲线绘制
取105℃恒重过的葡萄糖50mg,加适量水溶解,转移至100mL容量瓶中,稀释,摇匀,定容,即得葡萄糖对照品溶液(0.5mg/mL)。精密量取0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1mL 的 葡 萄 糖对照品溶液放入10mL具塞试管中,加水使成2mL,分别精密加入DNS显色液2.5mL混匀,在沸水浴中加热7min,取出,立即用流冷却至室温,加水3mL摇匀,用相应试剂做空白,在490nm测吸光度。以葡萄糖浓度(mg/mL)为横坐标(浓度0.0000~0.06667mg/mL),以吸光度为纵坐标绘制490nm标准曲线、得出回归方程标准曲线见图1。滴,用40%氢氧化钠溶液调节至微红色,转移至50mL容量瓶中,定容即得。
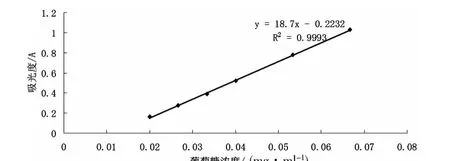
图1 DNS法标准曲线
(2)单糖溶液的制备。精密量取经过超滤处理的截留液5mL,置于10mL容量瓶中,加酚酞指示液1滴,摇匀,用1%氢氧化钠溶液调节至微红色,稀释、定容即得。
(3)含量测定。取总糖溶液、单糖溶液各2mL,分别精密加入DNS显色液2.5mL混匀,在沸水浴中加热7min后,立即用流水冷却至室温,加水3mL摇匀,用相应的试剂做空白,在490nm测吸收度A。多糖含量计算公式如下:

式中:n1、n2分别为各自的稀释倍数。
2.2 红松松塔多糖微滤制备工艺研究
红松松塔多糖制备工艺见图2。首先经过滤等预处理步骤除去提取液中尘埃、粗纤维等杂质,随后微滤除去胶质等大分子物质,得到含红松松塔多糖的微滤渗出液,再经超滤除去其中的小分子物质,所得截留液即为浓缩的多糖提取液。膜分离过程中,按照公式J=V/(S·t)计算膜通量,其中t为膜分离时间,h;J为膜通量,L/m2·h;V为t时间内透过液的体积,L;S为有效膜面积,m2。

图2 红松松塔多糖制备工艺路线
2.2.1 影响微滤效果的主要因素考察
(1)料液浓度对膜通量的影响。在0.08MPa、常温条件下,将不同浓度的红松松塔提取液进行微滤处理,料液浓度对膜通量的影响见图3。
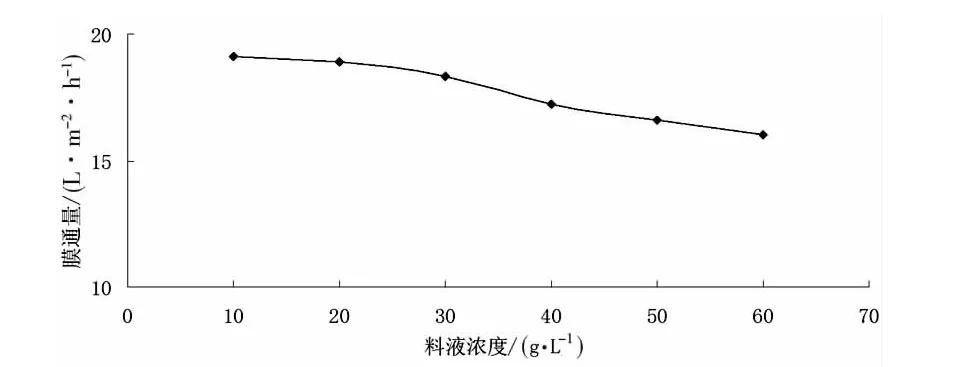
图3 料液浓度对膜通量的影响
2.1.2 红松松塔多糖样品含量测定
(1)总糖溶液的制备。取经过超滤处理的截留液2.5mL,加水2.5mL、6mol/L盐酸溶液15mL,在沸水浴中加热30min,用流水冷却后加酚酞指示液1
由图3可知,随着初始料液浓度的增大,膜通量减小。这是因为随着初始料液浓度的增大,料液粘度增大,导致浓差极化严重;此外,初始料液浓度增大,溶质吸附在膜表面,阻塞膜孔,造成通量下降。
(2)操作压力对膜通量的影响。常温下对20g/L的红松松塔多糖提取液进行微滤,压力对膜通量的影响见图4。

图4 压力对膜通量的影响
由图4可知,随着压力的增大,膜通量显著增大。这是因为压力增大使得溶液通过滤膜的推动力增大。压力继续增大,浓差极化严重,使有效的传质推动力下降导致膜通量增长变缓。
(3)料液温度对膜通量的影响。在0.08MPa,对20g/L的红松松塔提取液进行微滤,料液温度对膜通量的影响见图5。
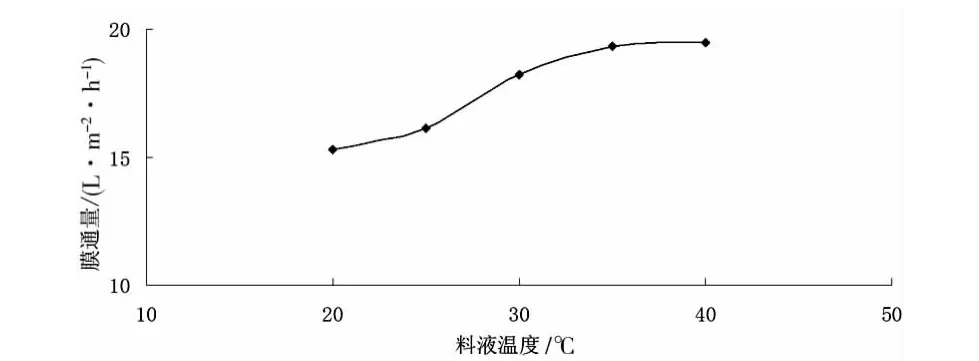
图5 料液温度对膜通量的影响
由图5可知,在一定范围内,膜通量随温度的升高而呈上升趋势。这是因为升高温度可使溶液粘度下降、扩散系数增大,而浓差极化减小,故膜通量增大。当温度升高到一定程度后,膜通量增加趋势趋于平缓,且温度过高还会导致滤膜性能和溶液理化性质的改变。
2.2.2 正交实验优选微滤工艺
采用正交实验考察料液温度t、操作压力MPa、料液浓度C 3个因素对膜通量的影响,每个因素取3个水平,因素水平见表1。本研究选择L9(34)表,实验结果见表2。

表1 微滤因素水平表

表2 正交实验结果
由表2可知,微滤最佳条件为A3B1C3,即料液温度40℃、料液浓度25g/L、操作压力0.10MPa。由极差可以得出结论:影响微滤膜通量的主要因素中,操作压力对膜通量的影响最大,其次为料液浓度,料液温度对膜通量影响最小。
2.2.3 工艺验证实验
按工艺条件A3B1C3进行3组重复实验,结果见图6。

图6 微滤过程膜通量变化曲线
由图6可知,该三组实验中膜通量理想,只有小幅度下降,说明该优化方案合理、可行。
2.3 红松松塔多糖超滤制备方法及其分子量分布研究
2.3.1 红松松塔总多糖的制备
将微滤渗出液经截留分子量为6kDa的超滤膜进行分离,所得浓缩液经减压蒸发得到总多糖固形物,测定其中总多糖含量,实验结果见表3。

表3 超滤前后总多糖含量对比
由表3可知,超滤纯化后的样品中多糖含量提高了约4倍,纯化效果明显。
2.3.2 不同分子量红松松塔多糖的制备
在0.10MPa、常温条件下选用截留分子量分别为100kDa、50kDa、10kDa、6kDa的超滤膜对上述微滤透过液依次进行超滤分离,得到分子量>10万、5万~10万、1万~5万、6000~1万等4段不同组分,测定各段的多糖含量,得出红松松塔多糖分子量分布结果,见图7。

图7 红松多糖分子量分布
由图7可知,分子量>10万的组分占红松松塔总多糖的9.5%,5万~10万之间的占70.2%,1万~5万之间的占3.2%,6000~1万的占17.1%。
3 结论
以上实结果表明,微滤过程的适宜操作条件为:料液浓度25g/L、操作压力0.10MPa、料液温度40℃,其中影响膜通量的主要因素为操作压力,其次是料液浓度和温度。微滤渗出液再经截留分子量为6kDa的超滤膜纯化后,多糖含量可由7.20%,提高到35.16%,纯化效果显著。
本实验中还测得红松松塔多糖分子量分布如下:分子量>10万的占9.5%,5万~10万之间的占70.2%,1万~5万之间的占3.2%,6000~1万的占17.1%,这些不同分子量的各组分样品正在进行后续活性研究。
[1]Sakagami H,Takeda K,MakinoY,et al.Partial purification of novel differentiation-inducing substances(s)from hot water extract of Japanese pine cone[J].Jep.J.Cancer Res,1986,77(1):59-61.
[2]王智航,张永红,于婉婷,等.红松松塔、松子壳研究进展及在畜牧业中应用可行性分析[J].国外畜牧学——猪与禽,2009,29(4):88-89.
[3]叶晓,俞军,易剑平,等.利用膜法分离姬松茸多糖的研究[J].食品科技,2006(2):44-46.
[4]Misaki A,Kishida E,Kakuta M,et al.Carbohydrate and Carbohydrate Polymers[M].ATL Press.Mount Prospect,Illinois USA,1993:116-129.

