花粉壁发育相关基因的研究进展*
马伯军,刘程捷,陈析丰,程祝宽
(1.浙江师范大学化学与生命科学学院,浙江金华 321004;2.中国科学院遗传与发育生物学研究所,北京 100101)
花粉壁作为植物细胞的一种防御结构,在花粉发育和受精过程中起着重要的作用[1].花粉壁可维持花粉的空间结构及抵抗外界环境对花粉的伤害[2];花粉的发育需要完整的花粉壁,否则会阻碍花粉的发育,导致花粉囊内花粉的降解[3];花粉壁上的蛋白质还能与柱头表面蛋白发生相互作用,参与花粉与柱头之间的识别[4].花粉壁是所有植物细胞壁和类型中最复杂的一种[5].目前,比较一致的观点是将花粉壁分为外壁和内壁:外壁主要由孢粉素构成,结构上又可分为外壁外层和外壁内层,其中外壁外层包含覆盖层、柱状层、含油层及基层;内壁由纤维素、果胶、构成疏水蛋白及水解酶等组成,其组分与植物的细胞壁相类似[5-6].花粉壁的发育须经历初生外壁的形成、外壁的形成及内壁的形成,并与花药中一个至关重要的结构——绒毡层的发育密切相关[6].绒毡层位于花粉囊壁最内层,从花粉母细胞形成时出现,在四分体时期细胞开始凋亡,最后在花粉成熟前完全消失[7],它可向花药室中分泌大量的碳水化合物、多种酶及脂类等物质,为小孢子发育提供所需的营养或构成花粉壁的重要成分[8-9].
因此,花粉壁的形成和发育非常复杂,涉及大量营养物质的合成与运输,其过程受一系列基因及信号转导的调控.目前,关于花粉壁发育的遗传与分子方面的研究已有许多报道.本文综述了近年来对花粉壁发育相关基因的克隆及其功能研究的最新进展,初步探讨了花粉壁发育的分子机理.
1 初生外壁形成的相关基因
花粉壁的发育从四分体时期开始,在减数第2次分裂结束后,小孢子细胞表面会形成一层由蛋白质、胼胝质及酸性多糖类等物质组成的致密纤维结构,这层特殊的结构被称为初生外壁,随着初生外壁的形成,小孢子花粉细胞膜也会形成褶皱结构[10].目前,已在拟南芥(Arabidopsis thaliana)中发现了多个参与初生外壁形成的基因.拟南芥AtDEX1基因编码一种植物特有的钙结合蛋白,AtDEX1可与花粉表面的细胞膜连接,介导初生外壁外小孢子花粉表面的形成.在atdex1突变体中,花粉壁初生外壁与野生型相比变得较薄,无法观察到表面的前柱状层结构,且形成时期也变迟,导致孢粉素在花粉表面的沉积变得杂乱无章[11].拟 南 芥 AtHKM 是 一 种 与 MS1(Male Sterile 1)同源的蛋白,作为转录调控因子,AtHKM是花粉壁发育过程中不可缺少的分子信号,调控着初生外壁的发育.athkm突变体的花粉壁初生外壁变薄,且一般不能包裹整个小孢子花粉,导致外壁结构的不规则[12].拟南芥AtRPG1基因编码一种细胞膜定位的MtN3家族蛋白,该蛋白可能与小孢子花粉细胞膜的褶皱结构的产生及细胞膜结构完整性的维持有关.atrpg1突变体由于初生外壁形成缺陷,孢粉素不能正常沉积,从而导致花粉壁形态结构的异常[13].拟南芥AtNEF1蛋白是一种维持质体完整结构的相关蛋白,atnef1突变体的初生外壁也是不形成典型的外壁外层结构,但与atdex1,atrpg1及athkm1不一样,atnef1突变体中孢粉素前体不沉积在不完整的初生外壁及花粉细胞膜上,而是以聚合物形式围绕在小孢子周边[14].由此可见,AtNEF1的功能丧失导致了孢粉素前体沉积效应的完全消失.拟南芥AtTDE2基因编码一种参与油菜素内酯合成的相关蛋白,attde2突变体的孢粉素前体刚开始并不沉积在花粉表面,而是随机分布在花粉囊中,但随着时间的推移,孢粉素最终还是能够聚集到初生外壁上,形成正常的花粉壁及可育的花粉,说明油菜素甾醇类物质也直接或间接地参与了孢粉素前体在初生外壁上的沉积[15].拟南芥 AtNPU基因编码一类多糖类物质跨膜转运蛋白,研究证明,AtNPU与初生外壁及小孢子花粉细胞膜表面褶皱结构的形成有关,其很有可能是与初生外壁多糖类物质的运输相关.与atnef1类似,在atnpu突变体中,孢粉素前体也是以聚合物形式围绕在小孢子周边,而不沉积在花粉细胞表面[16].
2 花粉壁外壁形成的相关基因
在四分体时期,随着初生外壁的形成,绒毡层中合成的孢粉素前体开始沉积在小孢子花粉表面,这个过程将持续到囊泡期.到囊泡期,由于孢粉素的积累,在花粉表面形成了外壁的柱状层、覆盖层及基层结构;同时,在基层内层边上会形成一层被锇酸染色较深的纤维状物质,即外壁内层结构[17].
孢粉素的合成需经过多种调控因子及修饰酶的共同作用.绒毡层线粒体三羧酸循环(tricarboxylic acid cycle,TAC)产生的乙酰辅酶 A(acetyl-CoA)被运输到质体,在酯酰辅酶A还原酶FAR(fatty acyl-CoA reductase,FAR)等酶的催化下形成十二碳月桂酸或进一步加工成长链脂肪酸(long-chain fatty acids,LCFA)或超长链脂肪酸(very long-chain fatty acids,VLCFA),Vioque 等[18]曾证明其中FAR与扁豆(Pisum sativum L.)叶表面油脂类物质的形成有关,主要参与由乙酰辅酶A到脂肪酸链的形成过程.除FAR外,表面蜡质缺失蛋白(eceriferum,CER)也与植物体内超长链脂肪酸的形成相关.从Rice eFP Browser数据库(http://www.bar.utoronto.ca/efprice/cgi-bin/efp-Web.cgi)中可以看到,OsCER1基因在水稻幼穗里的表达量极高,因此,OsCER1极有可能参与了孢粉素前体中超长链脂肪族衍生物的合成.拟南芥中AtCER1和AtCER3以复合体的形式参与脂肪酸链的合成过程,同时细胞色素CYTB5s以辅酶的形式参与该复合体功能的发挥[19].拟南芥FLP1蛋白结构与CER家族蛋白有相似之处,拟南芥flp1不育突变体与CER家族不育突变体中花粉壁的表型很相似,拟南芥FLP1也很有可能参与超长链脂肪酸衍生物的生物合成过程[20].拟南芥AtWDA1编码一类内质网特异表达的脂肪酸去饱和酶,可以催化脂肪酸衍生物的脱羧反应,在atwda1突变体内可以观察到绒毡层细胞质中有脂质体的积累,说明AtWDA1可能还与孢粉素前体的运输相关[21].
在孢粉素前体合成过程中,脂肪酸链的修饰需要在质体、内质网等多种细胞器中进行,而脂肪酸链在跨膜运输前需要先经过加工,以脂肪酸-辅酶A的形式进行跨膜转运,此修饰过程需要酰基辅酶A合成酶ACOS5(acyl-CoA synthetase 5)的参与[22].细胞色素P450是一类参与许多生物合成途径的氧化酶,在绒毡层细胞中,脂肪酸-辅酶A进入内质网后,需要在细胞色素 P450(cytochrome P450)家族蛋白的催化下被羟基化,其中:中链脂肪酸(medium-chain fatty acids,MCFA)由CYP703A2催化;C16和C18等长链脂肪酸则由CYP704B2负责羟基化;而超长链脂肪酸由何种酶修饰目前尚不清楚[7,23].MS2 是一类脂肪酰-酰基载体(fatty acyl-acyl carrier protein ACP reductase)还原酶,羟基化的脂肪酸被ACOS5酰基化后运送出内质网,再在MS2作用下去酰基化,形成的脂肪醇则作为孢粉素前体成分[24].同时,脂肪酰-酰基载体复合物也可以在聚酮合酶(polyketide synthases)PKSA及PKSB作用下脱酰基,并催化形成孢粉素成分中的酚醛类物质及烷基吡喃酮等物质[25].
孢粉素前体是在绒毡层中合成加工的,其最终将被运送到花粉表面成为花粉壁的主要组成成分.目前,对于孢粉素前体从绒毡层到小孢子表面的具体运输方式的了解还不够确切,但是在整个运输过程中,需要一类跨膜运输蛋白ABC转运蛋白的参与[26].ABC转运蛋白广泛存在于生物体内,它们结合并水解ATP(腺嘌呤核苷三磷酸)释放能量,从而实现物质的跨膜运输.已有的研究证明,ABC转运蛋白 G家族的AtABCG26及OsABCG15分别参与拟南芥和水稻孢粉素前体的运输,其功能的丧失将导致绒毡层内合成的孢粉素前体无法正常运送到小孢子花粉表面.在电镜观察下,atabcg26和osabcg15突变体绒毡层内有物质的异常积累,花粉表面呈光滑状,花粉壁无正常的覆盖层和柱状层结构,由于花粉壁结构的缺陷,导致花粉发育无法正常进行,并最终影响植物的育性[27-31].另外,AtABCG11参与拟南芥表面脂质物质的运输,但在atabcg11功能缺失突变体中,植株花粉发育也出现异常,可能与孢粉素前体的运输相关[32-33].除ABC转运蛋白以外,一类富含甘氨酸的蛋白GRP(glycine-rich protein)也与孢粉素前体的运输相关.土豆中LeGRP92在四分体时期和小孢子花粉发育早期出现在初生外壁表面.LeGRP92蛋白的亲水结构域与初生外壁表面结合,而疏水结构则可以结合孢粉素前体,从而介导孢粉素前体在出生外壁上的沉积.当LeGRP92表达水平降低时,虽然孢粉素仍可以在花粉表面沉积,但外壁的精细结构明显发生了变化,最终导致植株的育性下降[34].
孢粉素前体从合成到运输过程中参与的蛋白及各种蛋白的功能可以大致概括如图1所示:线粒体中经三羧酸循环产生的乙酰辅酶A在质体中经FAR等酶的催化形成中链脂肪酸,进而可以继续进行碳链的加长,形成长链、超长链脂肪酸;脂肪酸经ACOS5酯化修饰后可能经WDA1等的运输进入内质网;脂肪酸链在内质网中可以在WDA1,FLP1及CER家族蛋白的作用下再次加长;内质网中的脂肪酸的加工还包括由细胞色素类氧化酶进行羟基化形成脂肪醇,其中CYP704A2等酶负责中链脂肪酸的氧化,长链脂肪酸则由CYP704B2等羟基化,形成的脂肪醇复合物可以经MS2还原酶去酰基形成脂肪醇,此外还可以经聚酮合酶PKSA或PKSB加工成为酚醛类物质.孢粉素前体由绒毡层细胞内到花粉囊内小孢子细胞表面的运输过程由多种蛋白介导,其中ABC转运蛋白参与了孢粉素前体从绒毡层细胞内向花粉囊的分泌,而GRP蛋白参与结合花粉囊内游离的孢粉素前体,并引导其在初生外壁上的沉积(见图1).但由于孢粉素前体从绒毡层到花粉囊再到花粉表面的运输过程中涉及多种蛋白的参与,其具体机制还有待进一步的研究来证明.
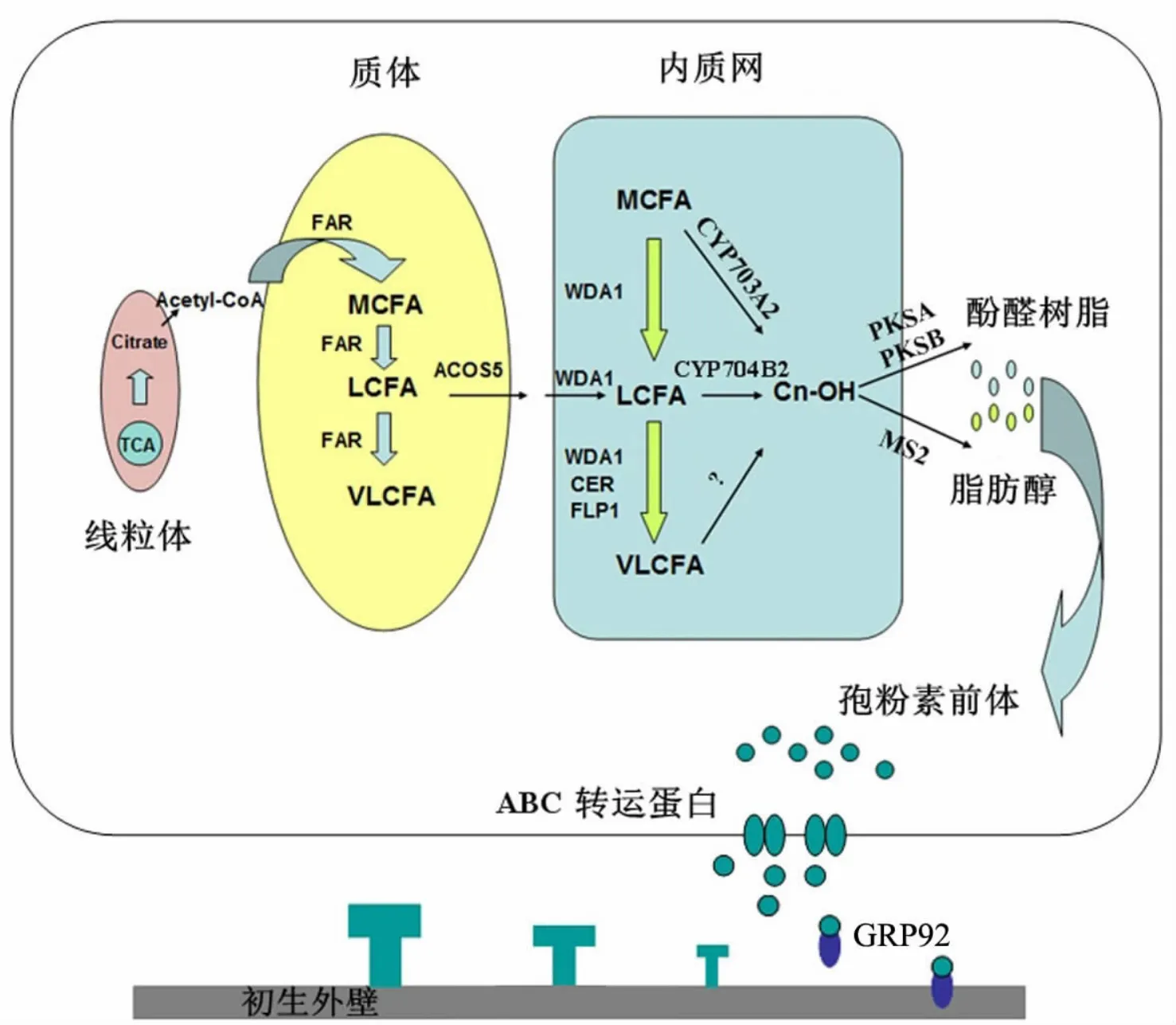
图1 绒毡层细胞中孢粉素前体的形成机制
3 花粉壁内壁形成的相关基因
花粉壁内壁的发育发生在外壁发育之后,其主要由纤维素、果胶及内壁蛋白所组成.近些年,对拟南芥和水稻中 atusp,atrgp1,atrgp2,atfla3,osrip1及osgt1等花粉壁内壁发育突变体的研究发现,在该类突变体中,花粉的外壁结构通常并无异常,且其突变表型发生在小孢子有丝分裂以后[35-39].
AtUSP蛋白与核苷核糖的生物合成相关,其产物可以作为糖基转移酶的底物,参与糖化物的生物合成[35].AtRGP1和AtRGP2基因编码一类转运蛋白,它们可以结合细胞质中的核苷核糖,并将其运输至内质网和高尔基体中以用于糖蛋白的合成.AtRGP1和 AtRGP2存在功能上的冗余,在atrgp1,atrgp2单突变体中,花粉壁内壁发育均无异常,只有在双突变体中才会出现花粉壁的异常[36].阿拉伯半乳聚糖是一类糖基化的细胞壁蛋白,它们是花粉壁内壁的主要成分之一,拟南芥一个相关基因FLA3(fascilin-like arabinogalactan ptotein 3)被RNAi抑制表达后,由于阿拉伯半乳聚糖的合成出现障碍,导致转基因植株的内壁无法正常形成[37].OsRIP1编码一种含WD40重复序列的核定位蛋白,在osrip1突变体内,花粉粒中内壁变薄,且淀粉颗粒的合成也受到影响[38].OsGT1是一种定位于高尔基体的核糖转移酶,可能介导AtUSP类似蛋白产物的糖基转移,与糖蛋白的合成相关,在花粉发育后期可以看到osgt1突变体中花粉外壁的结构完全正常,但无内壁的形成,且花粉粒中淀粉含量也下降,最终也导致花粉败育[39].虽然花粉壁内壁的具体功能目前还不清楚,但通过前人的研究结果,可以得知花粉壁内壁同样与花粉的形成与发育密切相关.
4 小 结
花粉壁的发育是个复杂且意义重大的生物学过程.花粉壁发育过程中,初生外壁主要为孢粉素的沉积提供一个支撑结构,目前对初生外壁的研究还较少.拟南芥的研究表明,DEX1,NEF1,HKM,RPG1,TDE2及NPU等蛋白参与了初生外壁的形成,其中:HKM作为一种转录因子,调控着初生外壁的发育;而NPU则作为一种运输蛋白,可能与初生外壁组分的运输相关.相对而言,目前对于花粉壁外壁的研究较多,FAR,CER,WDA1,ACOS5,CYP703,CYP704,FLP1,MS2,PKSA,PKSB等酶参与了孢粉素前体合成过程中脂肪酸及脂肪酸衍生物的加工,其中WDA1可能还与脂肪酸族物质的运输相关;另外,GRP蛋白及ABCG家族的AtABCG26,OsABCG15等参与了孢粉素前体从绒毡层到花粉表面的运输过程.花粉壁内壁形成过程中涉及多种糖蛋白的代谢相关蛋白,包括 USP,RGP,FLA3,RIP1及 GT1 等,其中:USP 与核糖的形成相关,其产物可作为GT1等糖基转移酶的底物;RGP蛋白负责聚集细胞质中的核糖,并将其运送到高尔基体中,以用于糖蛋白的合成;而FLA3则与内壁成分中阿拉伯半乳聚糖的合成相关.
由于花粉壁结构和组成成分较为复杂,且许多与花粉壁发育相关的基因还未被克隆,花粉壁形成过程中需要绒毡层细胞与花粉细胞之间大量的物质交流,其过程是怎样调控的?物质运输是怎样介导的?以及花粉壁不同结构部分有怎样的作用?等等.这些机制需要在细胞学、生物化学、分子生物学和遗传学等方面进行更深一步的研究与探讨.
[1]石晶,梁婉琪,张大兵.植物花粉壁的发育[J].植物生理学通讯,2007,43(3):588-592.
[2]Meuter-Gerhards A,Riegert S,Wiermann R.Studies on sporopollenin biosynthesis in Cucurbita maxima(DUCH.).Ⅱ.The involvement of aliphatic metabolism[J].J Plant Physiol,1999,154(4):431-436.
[3]Scott R J,Spielman M,Dickinson H G.Stamen structure and function[J].Plant Cell,2004,16(suppl 1):S46-S60.
[4]Zinkl G M,Zwiebel B I,Grier D G,et al.Pollen-stigma adhesion in Arabidopsis:a species-specific interaction mediated by lipophilic molecules in the pollen exine[J].Development,1999,126(23):5431-5440.
[5]Blackmore S,Wortley A H,Skvarla J J,et al.Pollen wall development in flowering plants[J].New Phytol,2007,174(3):483-498.
[6]Ariizumi T,Toriyama K.Genetic regulation of sporopollenin synthesis and pollen exine development[J].Annu Rev Plant Biol,2011,62:437-460.
[7]Morant M,Jorgensen K,Schaller H,et al.CYP703 is an ancient cytochrome P450 in land plants catalyzing in-chain hydroxylation of lauric acid to provide building blocks for sporopollenin synthesis in pollen[J].Plant Cell,2007,19(5):1473-1487.
[8]Goldberg R B,Beals T P,Sanders P M.Anther development:basic principles and practical applications[J].Plant Cell,1993,5(10):1217-1229.
[9]Piffanelli P,Ross J H E,Murphy D J.Biogenesis and function of the lipidic structures of pollen grains[J].Sex Plant Reprod,1998,11(2):65-80.
[10]Heslop-Harrison J.Wall development within the microspore tetrad of Lilium longiflorum[J].Can J Bot,1968,46(10):1285-1292.
[11]Paxson-Sowders D M,Dodrill C H,Owen H A,et al.DEX1,a novel plant protein,is required for exine pattern formation during pollen development in Arabidopsis[J].Plant Physiol,2001,127(4):1739-1749.
[12]Ariizumi T,Hatakeyama K,Hinata K,et al.The HKM gene,which is identical to the MS1 gene of Arabidopsis thaliana,is essential for primexine formation and exine pattern formation[J].Sex Plant Reprod,2005,18(1):1-7.
[13]Guan Yuefeng,Huang Xueyong,Zhu Jun,et al.RUPTURED POLLEN GRAIN1,a member of the MtN3/saliva gene family,is crucial for exine pattern formation and cell integrity of microspores in Arabidopsis[J].Plant Physiol,2008,147(2):852-863.
[14]Arilzumi T,Hatakeyama K,Hinata K,et al.Disruption of the novel plant protein NEF1 affects lipid accumulation in the plastids of the tapetum and exine formation of pollen,resulting in male sterile in Arabidopsis thaliana[J].Plant J,2004,39(2):170-181.
[15]Ariizumi T,Kawanabe T,Hatakeyama K,et al.Ultrastructural characterization of exine development of the transient defective exine 1 mutant suggests the existence of a factor involved in constructing reticulate exine architecture from sporopollenin aggregates[J].Plant and Cell Physiology,2008,49(1):58-67.
[16]Chang Haishuang,Zhang Cheng,Chang Yuhua,et al.No primexine and plasma membrane undulation is essential for primexine deposition and plasma membrane undulation during microsporogenesis in Arabidopsis[J].Plant Physiol,2012,158(1):264-272.
[17]Gabarayeva N,Grigorjeva V,Rowley J R,et al.Sporoderm development in Trevesia burckii(Araliaceae).Ⅱ.Post-tetrad period:Further evidence for the participation of self-assembly processes[J].Review of Palaeobotany and Palynology,2009,156(1/2):233-247.
[18]Vioque J,Kolattukudy P E.Resolution and purification of an aldehyde-generating and an alcohol-generating fatty acyl-CoA reductase from pea leaves(Pisum sativum L.)[J].Archives of Biochemistry and Biophysics,1997,340(1):64-72.
[19]Bernard A,Domergue F,Pascal S,et al.Reconstitution of plant alkane biosynthesis in yeast demonstrates that Arabidopsis ECERIFERUM1 and ECERIFERUM3 are core components of a very-long-chain alkane synthesis complex[J].Plant Cell,2012,24(7):3106-3118.
[20]Ariizumi T,Hatakeyama K,Hinata K,et al.A novel male-sterile mutant of Arabidopsis thaliana,faceless pollen-1,produces pollen with a smooth surface and an acetolysis-sensitive exine[J].Plant Mol Biol,2003,53(1/2):107-116.
[21]Jung K H,Han M J,Lee D Y,et al.Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development[J].Plant Cell,2006,18(11):3015-3032.
[22]De Azevedo S C,Kim S S,Koch S,et al.A novel fatty Acyl-CoA synthetase is required for pollen development and sporopollenin biosynthesis in Arabidopsis[J].Plant Cell,2009,21(2):507-525.
[23]Li Hui,Pinot F,Sauveplane V,et al.Cytochrome P450 family member CYP704B2 catalyzes the ω-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice[J].Plant Cell,2010,22(1):173-190.
[24]Chen Weiwei,Yu Xiaohong,Zhang Kaisi,et al.Male Sterile2 encodes a plastid-localized fatty acyl carrier protein reductase required for pollen exine development in Arabidopsis[J].Plant Physiol,2011,157(2):842-853.
[25]Kim S S,Grienenberger E,Lallemand B,et al.LAP6/POLYKETIDE SYNTHASE A and LAP5/POLYKETIDE SYNTHASE B encode hydroxyalkyl alpha-pyrone synthases required for pollen development and sporopollenin biosynthesis in Arabidopsis thaliana[J].Plant Cell,2010,22(12):4045-4066.
[26]Pighin J A,Zheng Huanquan,Balakshin L J,et al.Plant cuticular lipid export requires an ABC transporter[J].Science,2004,306(5696):702-704.
[27]Choi H,Jin J Y,Choi S,et al.An ABCG/WBC-type ABC transporter is essential for transport of sporopollenin precursors for exine formation in developing pollen[J].Plant J,2011,65(2):181-193.
[28]Qin Peng,Tu Bin,Wang Yuping,et al.ABCG15 encodes an ABC transporter protein,and is essential for post-meiotic anther and pollen exine development in rice[J].Plant and Cell Physiology,2013,54(1):138-154.
[29]Quilichini T D,Friedmann M C,Samuels A L,et al.ATP-binding cassette transporter G26 is required for male fertility and pollen exine formation in Arabidopsis[J].Plant Physiol,2010,154(2):678-690.
[30]Dou Xiaoying,Yang Kezhen,Zhang Yi,et al.WBC27,an adenosine tri-phosphate-binding cassette protein,controls pollen wall formation and patterning in Arabidopsis[J].J Integr Plant Biol,2011,53(1):74-88.
[31]Kuromori T,Ito T,Sugimoto E,et al.Arabidopsis mutant of AtABCG26,an ABC transporter gene,is defective in pollen maturation[J].J Plant Physiol,2011,168(16):2001-2005.
[32]Bird D,Beisson F,Brigham A,et al.Characterization of Arabidopsis ABCG11/WBC11,an ATP binding cassette(ABC)transporter that is required for cuticular lipid secretion[J].Plant J,2007,52(3):485-498.
[33]Ukitsu H,Kuromori T,Toyooka K,et al.Cytological and biochemical analysis of COF1,an Arabidopsis mutant of an ABC transporter gene[J].Plant and Cell Physiology,2007,48(11):1524-1533.
[34]McNeil K J,Smith A G.A glycine-rich protein that facilitates exine formation during tomato pollen development[J].Planta,2010,231(4):793-808.
[35]Schnurr J A,Storey K K,Jung H J,et al.UDP-sugar pyrophosphorylase is essential for pollen development in Arabidopsis[J].Planta,2006,224(3):520-532.
[36]Drakakaki G,Zabotina O,Delgado I,et al.Arabidopsis reversibly glycosylated polypeptides 1 and 2 are essential for pollen development[J].Plant Physiol,2006,142(4):1480-1492.
[37]Li Jun,Yu Miao,Geng Lingling,et al.The fasciclin-like arabinogalactan protein gene,FLA3,is involved in microspore development of Arabidopsis[J].Plant J,2010,64(3):482-497.
[38]Han M J,Jung K H,Yi G,et al.Rice Immature Pollen 1(RIP1)is a regulator of late pollen development[J].Plant and Cell Physiology,2006,47(11):1457-1472.
[39]Moon S,Kim S R,Zhao G,et al.Rice glycosyltransferase1 encodes a glycosyltransferase essential for pollen wall formation[J].Plant Physiol,2013,161(2):663-675.

