氟尿嘧啶Gemini表面活性剂囊泡的制备及其体外释放研究
魏 军 张春燕 姚庆强
(1.济南大学山东省医学科学院医学与生命科学学院,山东济南 250012;2.济宁医学院药学院,山东济宁 272000;3.山东省医学科学院药物研究所,山东济南 250012)
非离子表面活性剂囊泡(niosome,以下简称囊泡)结构组成与脂质体相似[1],既可以用来包裹亲水性药物,又可以用来包裹亲脂性药物,且化学性质相对稳定,因此在药物输送领域,囊泡成为近几年国内外研究的热点[2-10]。但总体来说,囊泡对水溶性药物的包封率偏低[4-10],因此如何提高非离子表面活性剂囊泡对水溶性药物的包封率一直受到人们的极大关注[11-13]。Gemini表面活性剂具有两个亲水基和两个疏水基,具有较高的表面活性和生物安全性,在一定条件下可形成囊泡[14],且与传统表面活性剂表现出很好的协同效应。由于双子表面活性剂的特殊结构,且形成的囊泡具有较脂质体更高的稳定性,因此该类表面活性剂在医药领域具有十分广阔的应用前景,然而关于Gemini表面活性剂囊泡载药体系的透皮吸收的相关研究还少见报道。本研究利用非离子Gemini表面活性剂为囊材,以亲水性药物氟尿嘧啶为模型药物,考察Gemini表面活性剂囊泡对水溶性药物氟尿嘧啶的包封作用及其体外释放行为的影响,旨在开发新型囊材,得到对水溶性药物包封率高且稳定存在的囊泡体系,为药物的传输及缓释提供依据。
1 实验部分
1.1 仪器
760CRT紫外可见分光光度计(上海精密科学仪器有限公司);pH酸度计(上海康仪仪器有限公pHS-3C);78HW-1型恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司);JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司);ZRS-8G智能溶出试验仪(天津大学无线电厂);Zetasizer3000HS激光粒度分析仪(英国Malvern公司)。
1.2 试剂
氟尿嘧啶原料药(北京亚希尔化工科技有限公司);氟尿嘧啶化学对照品(中国药品生物制品鉴定所);Span 60(天津市天大化工实验厂);胆固醇AR(浙江昌海生物有限公司);三氯甲烷AR(江苏南京中山集团公司化工厂);甲醇分析纯(天津市永大化学试剂有限公司);磷酸氢二钠AR(天津市瑞金特化学品有限公司);磷酸二氢钠AR(天津市天河化学试剂厂);磷酸二氢钾AR(天津市天河化学试剂厂);氢氧化钠AR(天津市天河化学试剂厂)。
1.3 实验动物
健康家兔2只,雌雄不限,由济宁医学院动物房提供。
2 实验方法
2.1 氟尿嘧啶标准曲线的绘制
2.1.1 氟尿嘧啶的紫外光谱图 准确称取氟尿嘧啶标准品0.01 g,用pH 5.0的磷酸盐缓冲液溶解并定容至10 ml,得浓度为1.0㎎/ml的氟尿嘧啶溶液,用TU-1901双光束紫外可见分光光度计进行光谱扫描,结果见图1。由光谱扫描曲线可知,氟尿嘧啶在266 nm处有最大吸收,空白溶液在这一波长处无影响吸收,因此选定266 nm为检测波长。
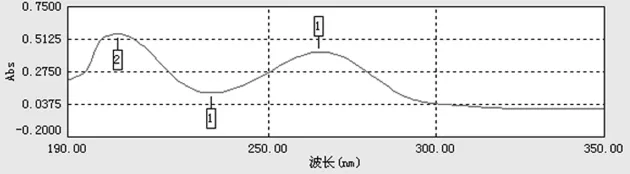
图1 氟尿嘧啶的光谱扫描图
2.1.2 氟尿嘧啶的标准曲线的绘制 称量12.5 mg氟尿嘧啶标准品,用磷酸盐缓冲液(pH 5.0,20 mmol/L)溶解,并用25 ml棕色容量瓶定容,得1.0 mg/ml氟尿嘧啶溶液。用1 ml刻度移液管分别量取 0.1,0.2,0.3,0.4 ml于 10 ml棕色容量瓶中定容至刻度,过滤后于226 nm波长处,测定其紫外吸收,得吸光度数据。由吸光度对浓度做图,见图2。
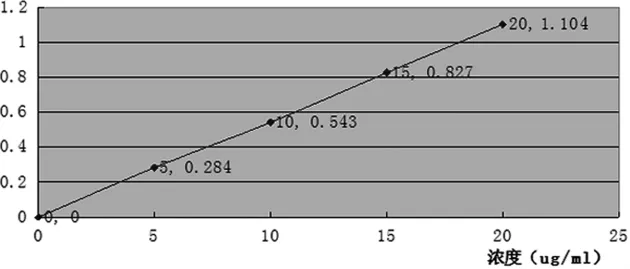
图2 氟尿嘧啶的标准曲线
由图2可见,在0~20 μg/ml范围内,氟尿嘧啶吸光度与浓度间存在良好的线性关系,其标准曲线方程为:Y=0.0550X+0.0014(R2=0.9998)。
2.2 囊泡的制备
2.2.1 囊泡处方 水相:磷酸盐缓冲液(pH 6.86,5 mmol/L)溶解氟尿嘧啶得氟尿嘧啶溶液。油相:氯仿∶甲醇=2∶1混合溶剂20 ml溶解Span60、Gemini表面活性剂、胆固醇。
2.2.2 空白囊泡的制备 表面活性剂与胆固醇溶于20 ml油相后,于60℃水浴中旋转蒸发,缓慢抽真空,蒸干后再真空抽10 min左右。抽真空后成的膜以均匀透明为佳。加入20 ml PBS缓冲液,于60℃水浴中水化1 h。随后常温水浴超声5 min。(超声功率400 W,间隔 3 s,工作3 s。)
2.2.3 氟尿嘧啶载药囊泡的制备 取氧氟尿嘧啶用PBS溶解,配制不同浓度药物溶液,表面活性剂与胆固醇溶于20 ml油相后,于60℃水浴中成膜后,加入20 ml药物溶液,于60℃水浴中水化1 h。随后常温水浴超声5 min。(超声功率400 W,间隔3 s,工作 3 s。)
2.3 囊泡粒径及ξ电位测定
将囊泡混悬液放入ZS 90型马尔文 zetasizer Nano样品池中,于25℃条件下以光散射法检测粒径、粒度分布、均一度,测试角度为90度。将囊泡混悬液装入U型样品池中于相同温度下检测ξ电位。
2.4 稳定性实验
将制成的OFLO囊泡混悬液分成几份贮存在冰箱上层(4℃),分别于制得囊泡后(记为第1天)、3天、7天后取样检测其包封率。
2.5 包封率测定
采用透析法检测囊泡对5-FU的包封率。透析前将醋酸纤维膜(分子量10000~14000)浸泡在PBS中1 h(确保整个膜的完全润湿)。取1 ml制得的5-FU囊泡混悬液放进透析袋内,然后将透析袋转移到25 ml PBS中。接收液中用磁粒子(转速约150 r/min)搅拌。分别于 0.5,1.0,1.5,2.0,2.5,3.0,3.5,4 h 取透析液测定游离药物吸光度,计算得到药物的累积释放率。结果表明在搅拌2 h时,释放曲线出现平台,说明游离药物扩散基本达到平衡,选取搅拌时间为2 h进行囊泡样品的透析。
于第2小时取出5 ml透析液,并用PBS定容至10 ml,在紫外分光光度计上检测溶液在266 nm(5-FU的最佳吸收波长)的吸光值。根据标准工作曲线式将测得的吸光值(Y)计算成对应的浓度(C,μg/ml)。
载药囊泡包封率(encapsulation efficiency,EE)。EE%=(W总-W游离)/W总×100%=W包/W总×100%。其中,W总为药物总量,W游离为游离药物量。
2.6 囊泡的体外释放实验
量取制备好的囊泡混悬液及游离药物溶液(两者所含总药量相等)装入透析袋中,放入装有250 ml人工胃/肠液的智能溶出仪中,透析袋置于搅拌浆的下端,设定温度为37℃,转速为50 r/min,模拟体内环境进行药物缓释性实验。于1~12 h每小时取样1次,吸取释放液5 ml,同时补充5 ml人工胃/肠液。测定释放液的吸光度,根据吸光度与浓度间关系式,从而求得氟尿嘧啶的累积释放量。
3 结果与讨论
3.1 Gemini表面活性剂对囊泡粒度分布的影响
固定 Span60、CHOL 用量(Span 60:65 nmol,CHOL:58 nmol),考察不同 Gemini表面活性剂的量(分别为 0,10,30,60,80,100,130,160 nmol)对囊泡粒度分布的影响,结果见表1,图3。
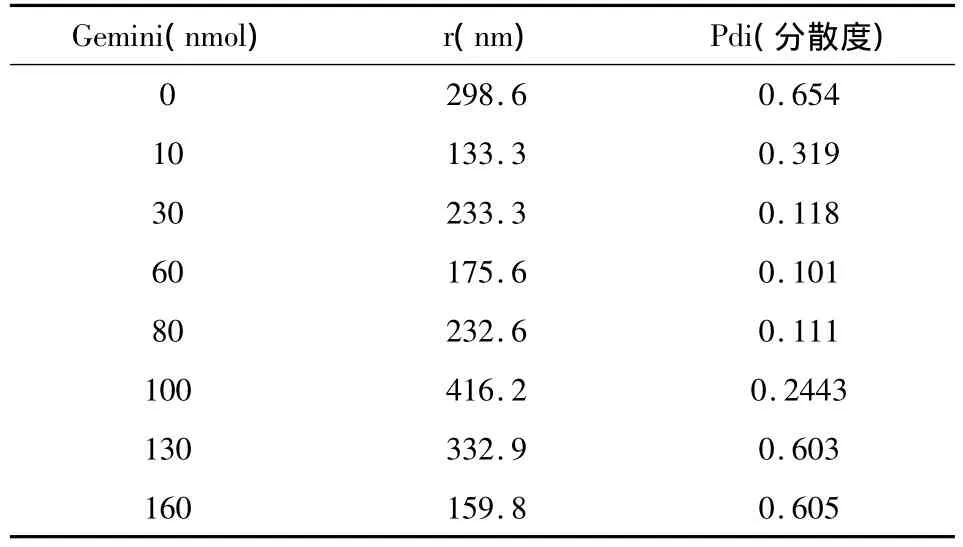
表1 Gemini表面活性剂用量对囊泡粒径大小的影响

图3 含有Gemini的囊泡粒径分布图
由表1可见,Gemini表面活性剂对囊泡的粒度大小影响不显著,但对粒度分布具有较显著的影响。加入Gemini表面活性剂后,当Gemini表面活性剂浓度较低时,随着Gemini表面活性剂浓度的升高,囊泡Pdi值明显变小,说明双子表面活性剂的加入,增加了囊泡体系的均匀度。但当Gemini表面活性剂浓度增加到一定程度时,其Pdi值反而增加,即Gemini表面活性剂浓度过高时,囊泡粒度分布均匀性又有所下降。这可能是Gemini表面活性剂具有较强的分散能力,在低浓度时与传统表面活性剂表现出良好的协同效应,起到良好的成囊作用,增加了囊泡膜的紧密程度,从而增加了其粒度分布的均匀性。当浓度过高时,由于Gemini表面活性剂的强分散能力,使其与Span及胆固醇之间的协同成膜能力降低,增加了囊泡的多分散性。
3.2 Gemini表面活性剂对囊泡zeta电位的影响
固定 Span60、CHOL 用量(Span 60:65 nmol,CHOL:58 nmol),考察不同 Gemini表面活性剂的量(分别为 0,10,30,60,80,100,130,160 nmol)对囊泡zeta电位的影响,结果见表2,图4。

表2 Gemini表面活性剂用量对囊泡zeta电位的影响
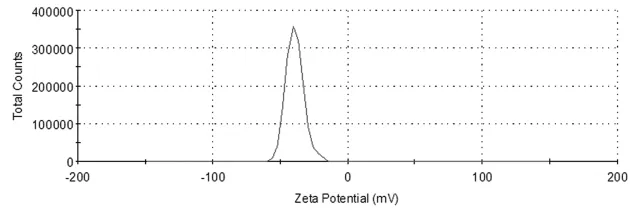
图4 含Gemini表面活性剂囊泡zeta电位测量结果
由表2可见,Gemini表面活性剂的加入在一定程度上降低了囊泡表面的电荷量,但其zeta电位并未随Gemini浓度的变化出现大幅度改变。这可能是由于Gemini表面活性剂的特殊结构,其介电常数将与其它非离子表面活性剂明显不同,从而影响了囊泡与分散介质界面间电荷的分布,故而影响了囊泡表面的zeta电位。
3.3 Gemini表面活性剂对囊泡包封率的影响
Gmini表面活性剂用量对囊泡包封率的影响结果见表3。

表3 Gemini表面活性剂对囊泡包封率的影响
由表3可见,当Gemini表面活性剂浓度较小时,随着Gemini表面活性剂浓度的升高,囊泡的包封率增大。这可能是Gemini表面活性剂在低浓度时与传统表面活性剂表现出良好的协同效应,起到良好的成囊作用,增加了囊泡膜的紧密程度,从而增加了其包封率。当浓度过高时,由于Gemini表面活性剂的强分散能力,使其与Span80及胆固醇之间的协同成膜能力降低,包封率随Gemini表面活性剂浓度的增加反而略有降低。
3.4 药物浓度对包封率的影响
改变氟尿嘧啶浓度对Gemini表面活性剂囊泡包封率的影响结果见图5。
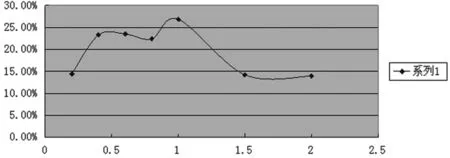
图5 药物浓度对包封率的影响
在氟尿嘧啶浓度较低时包封率随氟尿嘧啶的浓度增加而上升,而在更高浓度时包封率又开始下降。这是因为在低浓度时,囊泡捕获药物分子的概率较小,因此随着药物浓度的增加,囊泡捕获药物分子的概率也增加,包封率随之增加。但是在同样的条件下产生的囊泡的数目是一定的,它对药物分子的包封能力也是一定的,所以随着药物浓度的继续增加,包封率反而下降。
由图5可知,当药物浓度为1.0 mg/ml时,可得到最大的包封率,故将这一浓度定为后期使用浓度。
3.5 水化体积的影响
固定Gemini表面活性剂、Span60、CHOL的量,改变水相体积(分别取 6,9,15,20,25 ml),考察不同水相体积对囊泡性质的影响。水化体积对包封率的影响结果,如图6。

图6 水化体积对囊泡包封率的影响
由图6可知,水化体积较小时,包封率随体积的增加逐渐增大,当水化体积为20 ml时,包封率有最大值。水化体积继续增加,囊泡的包封率反而降低。这可能是因为水化体积过高,将导致体系中表面活性剂浓度过低,水化形成的囊泡较少。最佳水相体积为20 ml。
综合上述实验结果可知,囊泡的最佳处方组成为:Gemini 80 nmol,Span 65 nmol,胆固醇 58 nmol,药物浓度1 mg/ml,水化体积为20 ml。
3.6 稳定性实验
将制成的氟尿嘧啶囊泡混悬液分成几份贮存在冰箱上层(4℃),分别于制得囊泡后(记为第1天)、3天、7天后取样测其包封率。结果见图7。
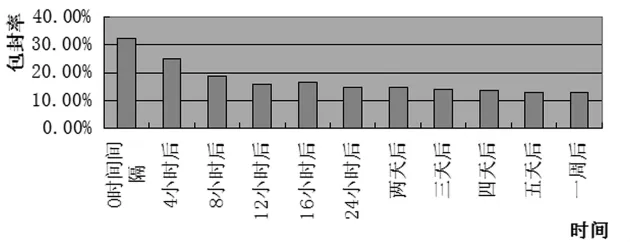
图7 囊泡稳定性实验结果分析
由图7可见,囊泡混悬体系的包封率随放置时间的延长而逐渐降低,但降低的幅度并不大,且超过24 h后,囊泡的包封率基本不再随放置时间的延长而降低。
只是由于随着放置时间的延长,囊泡包封的药物会发生部分的渗漏,因此将导致包封率的下降,但由于Gemini表面活性剂的加入,增加了囊泡的稳定性及可能增加囊泡膜的紧密程度,故药物渗漏程度较低,当时间较长时,可能是由于膜内外药物浓度差变小,故测得的包封率基本不再发生变化。
3.7 囊泡的体外释放性研究
囊泡在不同pH条件下的体外释放结果,见图8,9。

图8 囊泡在模拟胃液中的释放度测定
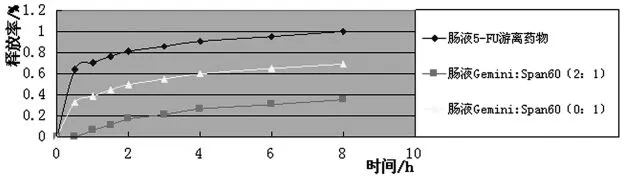
图9 囊泡在模拟肠液中的释放度测定
由图8,9可见,游离5-FU溶液和不加Gemini表面活性剂的囊泡在模拟肠液中释放较快,2 h累释放量分别为80%和50%左右,游离5-FU溶液在8 h时基本透出完全。含有Gemini表面活性剂的载药囊泡体系在模拟胃液和模拟肠液中的释放速率明显低于游离药物及Span类脂囊泡载药体系,进一步说明了Gemini表面活性剂类脂囊泡的稳定性及膜的紧密程度,包载于非离子Gemini表面活性剂囊泡体系中的药物在模拟肠液及模拟胃液中具有明显的缓释作用及较好的pH稳定性。
4 结论
4.1 由Gemini表面活性剂、Span60、胆固醇制备氟尿嘧啶的最佳处方为:Gemini表面活性剂80 nmol、Span60 65 nmol、胆固醇58 nmol,药物溶液浓度为1 mg/ml,水化体积为 20 ml。
4.2 Gemini表面活性剂可明显改善囊泡体系的均匀度,增加对水溶性药物的包封率,增加囊泡的稳定性,对电位及粒度大小影响不显著。
4.3 Gemini表面活性剂载药囊泡体系在模拟体液中具有明显的缓释作用,因此Gemini表面活性剂可作为缓释制剂的囊材,有着潜在的应用价值。
[1] Donatella Paolino,Donato Cosco,Rita Muzzalupo,et al.Innovative bola-surfactant niosomes as topical delivery systems of 5-?uorouracil for the treatment of skin cancer[J].International Journal of Pharmaceutics,2008,353:233 –242.
[2] 张景力,张志荣.紫杉醇磁性非离子表面活性剂囊泡的研制及其质量评价[J].中国医院药学杂志,2001,21(8):454 -455.
[3] 杜美菊,凌翠霞,李娜,等.类脂囊泡作为头孢噻肟钠药物载体的研究[J].化学研究与应用,2006,18(6):635 -637.
[4] Lexander T A,Florence A T.Pharmaceutical and biological characterization of doxorubicin-polymer conjugate entrapped insorbitan monostearate Span60 niosomes[M].Colincetal:Harwood A-cademy Publishers,1995:239 - 253.
[5] Jain C P,Vyas S P.Lymphatic delivery of noisome encapsulated methotrexate[J].Pharmazie,1995,50:367 - 368.
[6] Parthasarthi G,Udupa N,Umadevi P,et al.Niosome encapsulated of vincristine sulfate:improved anticancer activity with reduced toxicity in mice[J].Journal of Drug Targeting,1996,34:124 -133.
[7] Jain CP,Vyas SP.Preparation and characterization of noisomes containing rifampicin for lung targeting[J].Microencapsulation,1995,12(4):401- 407.
[8] Luan L B,Zhu J B,Yu W P,et al.Studies on the preparation of camptothecin niosomes[J].Acta Pharmaceutica Sinica,2002,37(1):59- 62.
[9] Yoshioka T,Horence A T.Preparation and properties of vesicles(niosomes)of sorbitan monoester(Span20,40,60 and 80)and sorbitan trimester(Span85)[J].Int J Pharm,1994,105:1 - 6.
[10] Yan H Y,Hao Y M,Zhao F L,et al.The non-ionic surfactant vesicles encapsulating drugs cefazolin sodium[J].Chemistry,2002,7:467 - 471.
[11] Liu C Y,Li L,Qiu F.Effects of Salt Concentration and Structure of Lipid Molecules on the Bending Rigidity of Multi-Component Charged Membranes[J].Acta Chimica Sinica,2010,68(13):1325-1330.
[12] 甘盈盈.磷脂囊泡和非离子囊泡的生成与融合[D].扬州大学,2009.
[13] Liu J L,Zhu G L,Liu H C.Study on the properties of vesicles in aqueous solution of perf luorinated surfactant[J].Journal of Northeast Normal University,2002,34(2):55 -58.
[14] Hangyi Liang,Chuanzhong Wang,Jianbin Huang.The research on the vesicle formation and transformation in novel Gemini surfactant systems,Colloids and Surfaces A:Physicochem[J].Eng Aspects,2003,224:213 -220.

