3-硝基酪氨酸人工抗原的合成与鉴定
彭方毅,杨海艳,姜海蓉,徐建建,伍 娟,周 欢,袁兵占
(1.重庆理工大学药学与生物工程学院,重庆 400054;2.重庆市江津区中心医院,重庆 402260)
3-硝基酪氨酸(3NT)是机体在氮氧化物存在的条件下氧化损伤的一种特殊形式,非常稳定[1],常常在病理状态下伴随活性氧和活性氮的增加而产生,是活性氮(RNS)对蛋白酪氨酸残基氧化修饰的产物,也是体内RNS形成的重要生物标志物[2-3]。目前,3NT的检测方法主要有高效液相色谱法[4-6]及气相与质谱联用法等,但这些方法需要对样品进行处理,较为复杂,费时费力,且影响检测的准确性[7-8],重复性差,灵敏度低,缺乏选择性,不适用于现场大量样本的快速检测。因此,人们迫切需要一种简便、快速、廉价及适合多样品同时检测的技术[9]。将3NT与载体蛋白的偶联物作为免疫原,制备针对3NT的抗体,采用免疫学方法,如ELISA、Western blot、免疫组化和免疫沉淀等,为超微量检测3NT开辟了新的途径。该技术特异性强,灵敏度高,简单快速,且成本低廉,样品不需要前处理,可同时测定大量的实验与对照组样品,被广泛应用于生物、化工、医学、环境、农业等领域[10]。本研究采用戊二醛法,将3NT与卵白蛋白进行偶联,再用紫外扫描法和聚丙烯酰胺电泳法对其进行鉴定,用BCA法测定二者结合物的质量体积分数,并测得结合物的偶联率,免疫小鼠,获得效价高且敏感的抗3NT抗体,为建立特异性的检测3NT的酶联免疫吸附法奠定基础。
1 材料与方法
1.1 材料
3NT合成于北京中科亚光生物科技有限公司;戊二醛购自SIGMA-ALORICH公司;卵白蛋白(OVA)购自Thermo公司;GelCode Blue Stain Reagent染色液、0.2% 溴酚蓝、10%TEMED、低分子量蛋白标准购自BIO-RAD;BCA试剂盒购自pierce公司;其余试剂为分析纯。实验动物为SPF级6周龄雌性BALB/C小鼠;紫外分光光度计、SDSPAGE电泳仪、酶标仪由北欧生物科技(北京)有限公司提供。
1.2 实验方法
1.2.1 免疫抗原的制备(戊二醛法)
① 取 600 μL OVA(5 mg/mL)与 1.5 mL 3NT(2mg/mL)溶液混匀,于4℃冷却。② 加21 μL 25%戊二醛,于4℃下反应2 h。③ 室温下加入事先配制好的 0.4 M 乙醇胺(0.5M NaCO3)106 μL,2 h后终止反应。④将反应液在1×PBS缓冲液中透析,至少进行5次换液。取出3NT与OVA的结合物溶液,于-20℃冰箱冷藏保存。
1.2.2 免疫抗原的鉴定
①紫外分光光度法:采用透析用PBS调零,同时设有OVA、3NT对照,对经透析后的3NT与OVA结合物在190~350 nm的波长下进行紫外扫描,通过比较载体蛋白在交联前后的图谱变化进行初步分析,判断3NT是否与载体蛋白OVA偶联。②聚丙烯酰胺凝胶电泳法(SDS-PA GE电泳)[11-12]:其中分离胶的体积分数为 12% ,浓缩胶的体积分数为5%。③ 偶联率的测定:卵白蛋白含量测定用BCA法,具体步骤见文献[13],用酶标仪测定吸光度。测出标准曲线,再对结合物与OVA在波长280 nm处吸光度的差值进行计算,其中3NT在PBS中的摩尔消光系数ε=A(280)/CL=8 100 cm-1M-1。
1.2.3 多抗血清(pAb)的制备
用上述3NT与OVA的偶联物免疫6周龄雌性BALB/C小鼠6只,免疫剂量每只30 μg,每只0.2 mL,皮下注射4~6点。首免时,用生理盐水定容免疫原,与等量FCA混合,充分乳化;加强免疫时,将FCA改FIA混合,乳化,共免疫4次,每2周免疫1次,并采血,分离血清,于 -20℃保存备用。
1.2.4 抗血清的鉴定
采用上述血清进行效价测定和竞争抑制实验。抗血清效价测定采用间接ELISA法。首先,用PBS-BTE将包被抗原稀释到10 ng/mL,加到96孔酶标板(Streptavidin coated MTP)上,每孔100 uL,20℃温育,并震板1 h,洗涤5次后拍干(下同);用PBS-BT将抗血清梯度浓度稀释加到板孔中,每孔100 uL,20℃温育1 h,洗涤;用 PBS-BT 1∶10000稀释二抗(羊抗鼠),每孔 100 uL,20℃ 温育1 h,洗涤;再加入TMB底物溶液,每孔50 uL,避光温育15 min;最后每孔加入100 uL 2mol/L的硫酸溶液终止反应,酶标仪上测定450处吸光值。其中空白对照(BC)为 PBS-BT溶液,阴性对照(NC)为小鼠免疫前所采的阴性血清。阳性孔判定:待测孔OD450值大于等于NC OD450值的2.1倍(P/N≥2.1),阳性孔的血清最大稀释度即为抗血清的效价[14]。
2 结果与分析
2.1 通过颜色判断偶联是否成功
3-硝基酪氨酸是有颜色的物质。主要是物质当中的硝基为发色团,能加深色原体的颜色,且本身呈黄色;而原载体蛋白OVA中无硝基的存在,为无色液体。本实验在完成透析前后反应体系均呈浅黄色,说明偶联成功。
2.2 紫外扫描
载体蛋白(OVA)、3-硝基酪氨酸和二者结合物的紫外扫描结果见图1。
OVA在波长280 nm处有最大吸收峰,3-硝基酪氨酸在277 nm波长处有最大吸收峰,而两者结合物的最大吸收峰在270 nm,明显不同于载体蛋白与半抗原的吸收曲线。在抗原合成过程中,经过透析后已经基本上把反应中残留的小分子物质从蛋白溶液中除去,而紫外图谱显示经透析过后的蛋白特征吸收峰明显发生红移,说明载体蛋白上偶联上了3NT,证明人工抗原合成成功。

图1 卵白蛋白、三硝基酪氨酸及二者结合物的紫外光谱
2.3 电泳
图2显示,OVA条带在43KD左右,而3NT与OVA结合物的条带明显比43KD大,且成一区域性条带,进一步说明偶联成功。

图2 3NT与OVA结合物的SDS-PAGE电泳图
2.4 标准曲线
卵白蛋白含量测定的标准曲线如图3所示。
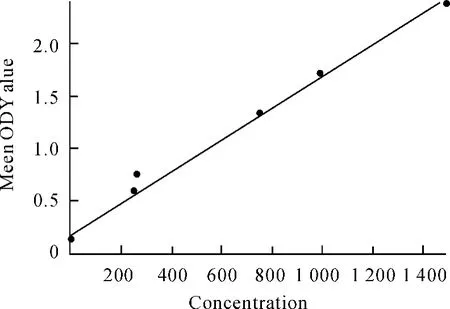
图3 标准曲线
由标准曲线可得 A=0.16,B=0.001 52。结合物的两复孔值分别为OD1=1.437,OD2=1.454。代入公式C=(OD-A)/B得到稀释过的结合物溶液的蛋白质浓度C=0.847 mg/mL,而结合物溶液的蛋白质浓度为0.847 ×2=1.69 mg/mL,为计算3NT的偶联率提供了数据。
由紫外扫描图谱知,A280(结合物)=1.5,A280(OVA)=0.645,而 OVA 浓度 =0.847 mg/mL,OVA摩尔分子量为43 000。代入公式

可得3-硝基酪氨酸的偶联率为5.4。
2.5 抗血清的效价测定
由间接ELISA法测定6只小鼠血清,测得其中2只(348#与358#)抗血清的效价分别为1∶80 000与1∶27 000,结果见表1,说明被免疫的这2只小鼠产生了抗体。
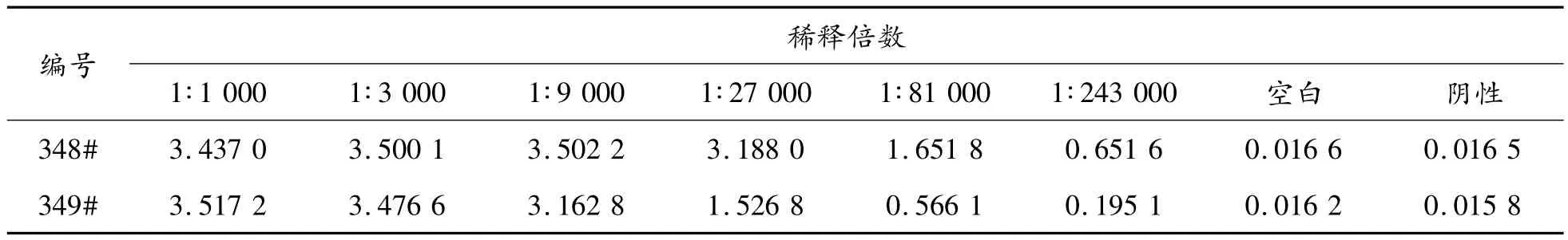
表1 间接ELISA测小鼠血清效价
3 讨论
本实验采用戊二醛法将大分子量的载体蛋白OVA与小分子的半抗原3-硝基酪氨酸连接,得到完全抗原3NT-OVA结合物,紫外光谱扫描结果及SDS-PAGE电泳表明3-硝基酪氨酸偶联成功。计算得到3-硝基酪氨酸与OVA的偶联率为5.4,为进一步建立酶联免疫吸附法测定人体内3-硝基酪氨酸含量提供了合适的免疫原。
用紫外分光光度法测定的半抗原与载体蛋白的偶联数目一般比它的实际值低,可能是因为本实验所测3-硝基酪氨酸的偶联数目是在假定其在波长280 nm的摩尔消光系数和3NT-OVA结合物在同一波长的摩尔消光系数相同的前提下计算出来。且在用紫外分光光度法扫描时,最初发现蛋白与结合物在20 μg/mL的浓度下扫描时,二者波峰均不明显,甚至未出现波峰,产生原因可能是浓度太低,紫外无法扫描,增大浓度即可改变此现象。
综上所述,本研究成功合成了3NT人工抗原,免疫BALB/C小鼠后制备出高效价、敏感的pAb,为抗3NT单克隆抗体(mAb)的进一步研制、免疫学分析方法的建立奠定了基础。
[1]Ryberg H,Caidah L K.Analyt Techno l Biomed Life Sci[J].J Chromatogr B,2007,851(1/2):160 -171.
[2]Crow J P,Ischiropoulos H.Detection and quantification of nitrotyrosine residues in proteins:In vivo marker of peroxynitrite[J].Meth Enzymol,1996,269:185 - 194.
[3]Halliwell B.What nitrates tyrosine Is nitrotyrosine specific as a biomarker of peroxynitrite formation in vivo[J].FEBS Lett,1997,411:157 -160.
[4]付彩芳,高秀杰.高效液相色谱法测定阿奇霉素颗粒的含量[J].临床医药实践杂志,2008(19):1020-1022.
[5]胡阳,倪辉,吴光斌,等.高效液相色谱法测定乳制品中三聚氰胺的含量[J].集美大学学报:自然科学版,2010(1):36-38.
[6]刘成红.高效液相色谱法测定生乳灵中哈巴俄苷[J].中国新药杂志,2011(2):184-186.
[7]Shigenaga M K,Lee H H,Blount B C,et al.Inflammation and NOX-induced nitration:Assay for 3-nitrotyrosine by HPLC with electrochemical detection[J].Proc Natl Acad Sci USA,1997,94:3211 -3216.
[8]Greenacre S A B,Ischiropoulos H.Tyrosine nitration:localization,quantification,consequences for protein function and signal transduction[J].Free Rad Res,2001,34:541-581.
[9]高宏斌,许艇,李季.免疫分析方法在拟除虫菊酯类农药残留检测中的应用进展[J].农业环境科学学报,2006,25(z):425 -428.
[10]周培,陆贻通.农药残留的酶联免疫检测技术研究进展[J].农药,2002,41(3):9 -11.
[11]何钟佩.农作物化学控制实验指导[M].北京:北京农业大学出版社,1993:60-68.
[12]RENSON C,DEGAND G,MAGHUIN - ROGISTER G.Determination of sulpham ethazine in animal tissues by enzyme immunoassay[J].Analytica Chimica Acta,1993,275:323-328.
[13]Bainor A,Chang L,McQuade T J.Bicinchoninic acid(BCA)assay in low volume[J].Analyltical Biochem,2011,410(2):310.
[14]刘媛,刘贤进,于向阳.玉米赤霉醇人工抗原合成及其多克隆抗体的制备[J].分析科学学报,2006,22(1):1-4.

