新药AD-08对两种痴呆动物模型学习记忆障碍和海马乙酰胆碱酯酶活性的影响
左 亮,原冬冬,张 媛,王 琴,陶 亮
(中山大学中山医学院药理学教研室,广东广州 510080)
阿尔采末病(Alzheimer’s disease,AD)又称为老年痴呆,是一种常见的神经退行性疾病,在80岁以上的老人中发病率高达40%[1-2]。其主要表现为渐进性记忆障碍、认知功能障碍等神经精神症状,严重影响患者的社交、职业与生活功能。AD典型的病理变化包括大脑组织中老年斑的形成,神经元纤维缠结并伴随胆碱能神经元丢失[3]。AD发生时脑内的胆碱能神经元数量减少,导致乙酰胆碱含量的下降,该学说是目前较为公认的AD的发病机制之一[4],也是AD治疗获得有限疗效的重要基础。迄今为止国内外批准用于AD治疗的药物不多,代表药物为胆碱酯酶抑制剂多奈哌齐,其机制主要是通过抑制脑中胆碱酯酶而抑制乙酰胆碱降解,增加局部乙酰胆碱浓度改善神经递质的传递功能。但是多奈哌齐的疗效维持时间短;随着病程的进展,当功能完整的胆碱能神经元渐趋减少时,多奈哌齐的作用也逐渐减弱。此外,多奈哌齐在临床上已使用多年,长期使用会产生耐药性;因此,开发新的能有效治疗AD的药物十分重要。AD-08是我们对多奈哌齐的化学结构进行基团改造、合成的具有自主知识产权的新型化合物。前期的实验证明,AD-08具有脂溶性好,可有效透过血脑屏障,在脑内浓度为血浆中的8倍;并且在体外抑制乙酰胆碱酯酶(AChE)的效价是抑制丁酰胆碱酯酶效价的50倍以上。因此,我们认为该化合物具有较好的开发前景,并有可能成为治疗AD的新型药物。本研究在动物痴呆模型上,初步研究了AD-08对痴呆动物学习记忆能力的改善作用,以及对大脑海马组织AChE活性的影响,为AD-08的进一步开发提供依据。
1 材料与方法
1.1 试剂与仪器 Aβ1-42(货号A9810)购自Sigma公司;多奈哌齐和AD-08均由国内某知名药企提供;乙酰胆碱酯酶试剂盒购自南京建成生物工程研究所。Morris水迷宫测试系统购自淮北正华生物仪器设备有限公司;大鼠脑立体定位仪(NARISHIGE SN-3型)购自日本成茂公司;酶标仪购自美国biotek公司;微量进样器(规格5 μl)购自上海高鸽工贸有限公司。
1.2 动物与分组 健康成年♂ SD大鼠48只,质量(200±20)克,SPF级,批号 SCXK(粤)2008-0002,广东省医学实验动物中心提供,APP/PS1双转基因小鼠40只,具有相同遗传背景的正常对照小鼠8只,♂(3月龄),由南京大学国家遗传工程小鼠资源库提供,许可证号SCXK(苏)2010-0001。两种动物均随机分为分成正常组、模型组、阳性药(多奈哌齐)对照组、AD-08低、中、高剂量组,每组8只。正常组SD大鼠于侧脑室注射生理盐水5 μl;阳性药对照组和AD-08各剂量组于侧脑室注射Aβ1-42蛋白5 μl(10 μg)。大鼠术后灌胃给药,多奈哌齐和AD-08均用生理盐水溶解。给药剂量分别为:多奈哌齐3 mg·kg-1、AD-08 低剂量组0.7 mg·kg-1、中剂量组 3.5 mg·kg-1、高剂量组 7 mg·kg-1,给药容量为每100 g体质量1 ml;每日1次,共给药8 d。APP/PS1双转基因小鼠养至6月龄,正常对照组及模型组灌胃给予相应剂量的药物溶剂(生理盐水);多奈哌齐组和AD-08各组分别按体重给与相应剂量的药物:多奈哌齐1 mg· kg-1、AD-08低剂量组1 mg·kg-1、中剂量组 5 mg·kg-1、高剂量组 10 mg·kg-1,每天1次,共给药1个月。
1.3 Aβ1-42的配制[5]0.1 mg Aβ1-42溶于 50 μl生理盐水,稀释为 2 mg·L-1,37℃恒温箱孵育 5 d,-20℃冰箱保存,切忌反复冻融。
1.4 痴呆动物模型的建立[6]大鼠腹腔注射400 mg·kg-1的水合氯醛麻醉。将麻醉的大鼠固定于大鼠脑立体定位仪上,定位参照George Paxinos和Charles Watson合著的第5版大鼠脑立体定位图谱,定位方法:前囟向后1.08 mm,中线旁开2.5 mm,硬脑膜下3.7 mm。用微量进样器注射,每只大鼠注射5 μl Aβ1-42(2 mg·L-1),缓慢注射,注完留针10 min以保证其充分弥散,缓慢撤针,缝合消毒。
1.5 Morris水迷宫实验 实验方法参照文献[7-8],并作适当地修改。实验时间总共 5 d,以定位航行、空间探索为指标。定位航行实验连续进行4 d,观察和记录实验动物寻找并爬上平台所需时间,即潜伏期。最后1 d(d 5)进行空间探索实验,记录动物第1次到达原平台位置的时间、穿越原平台的次数以及在目标象限活动的时间百分比。
1.6 AChE活性测定 Morris水迷宫测试结束后,将动物断头、取出大脑;迅速分离海马,按所取海马的重量,加9倍重量的生理盐水制备脑组织匀浆,3 500 r·min-1离心10 min;取上清液置于 -20℃冰箱保存。根据南京建成生物工程研究所提供的乙酰胆碱酯酶活性测试盒的说明书测定乙酰胆碱酯酶活性;用考马斯亮蓝法进行蛋白定量。
1.7 数据的分析与统计 采用Sigma Plot 10.0统计软件对结果进行分析,所有数值均采用±s表示,分析方法采用Student's t-test。
2 结果
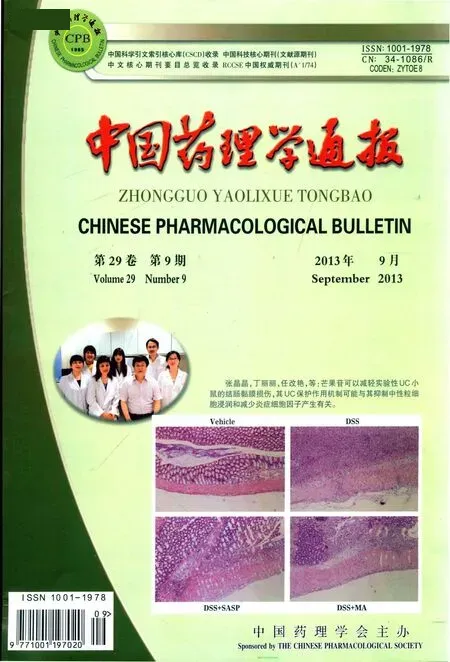
2.1 定位航行实验 定位航行实验结果见Tab 1、2。结果表明,各组实验动物找到平台的时间(即潜伏期),随着训练进程而逐渐缩短。模型组从训练d 3开始,动物的潜伏期延长,与正常组比较差异有统计学意义(P<0.05)。而给予AD-08和多奈哌齐后,SD大鼠和APP/PS1双转基因小鼠的潜伏期均明显减少,与模型组比较差异有统计学意义(P<0.05)。
Tab 1Effects of AD-08 on escape latency in rats(±s,n=8)
Tab 1Effects of AD-08 on escape latency in rats(±s,n=8)
*P<0.05 vs AD group
Group Day 1 Day 2 Day 3 Day 4 Control 76.23 ±5.35 54.64 ±6.12 33.16 ±5.46* 24.77 ±3.35*AD 80.33 ±5.59 65.13 ±5.45 64.81 ±5.02 60.28 ±4.25 Donepezil 79.91 ±5.46 52.47 ±5.85 35.49 ±4.45* 21.49 ±4.68*AD-08 0.7 mg·kg-1 74.27 ±5.91 65.92 ±5.28 36.28 ±4.75* 28.67 ±5.19*AD-08 3.5 mg·kg-1 74.11 ±5.81 58.09 ±4.52 31.00 ±4.83* 22.15 ±5.03*AD-08 7 mg·kg-1 80.04 ±5.28 64.31 ±5.21 36.85 ±5.21* 24.29 ±5.12*
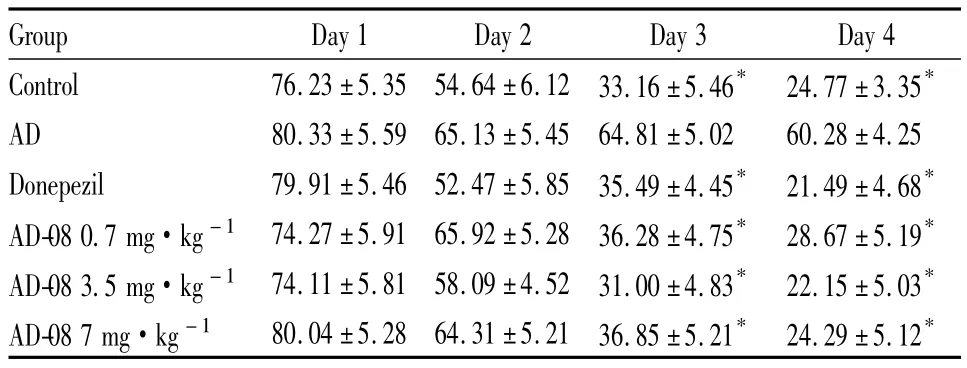
Tab 2 Effects of AD-08 on escape latency in APP/PS1 mice(±s,n=8)
Tab 2 Effects of AD-08 on escape latency in APP/PS1 mice(±s,n=8)
*P<0.05 vs AD group
Group Day 1 Day 2 Day 3 Day 4 Control 53.16 ±5.19 34.23 ±4.15* 32.20 ±4.06* 29.21 ±3.61*AD 67.30 ±7.02 58.21 ±6.58 52.54 ±7.06 51.63 ±6.01 Donepezil 61.12 ±6.12 42.44 ±5.35 39.20 ±6.28* 29.43 ±6.16*AD-08 1 mg·kg-1 60.56 ±5.94 41.82±6.87 31.80±5.29* 24.84±4.30*AD-08 5 mg·kg-1 47.60 ±6.47 53.39±7.46 48.49±8.33 26.12±7.55*AD-08 10 mg·kg-1 54.49 ±6.50 36.34 ±5.31* 30.70 ±4.67* 28.70 ±5.12*
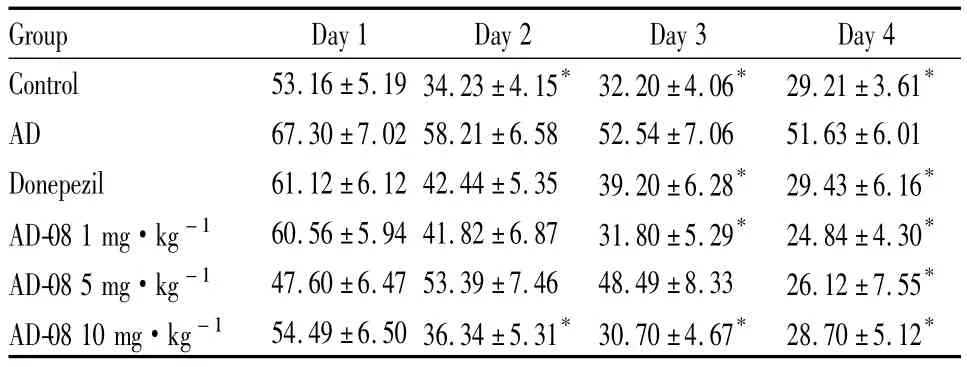
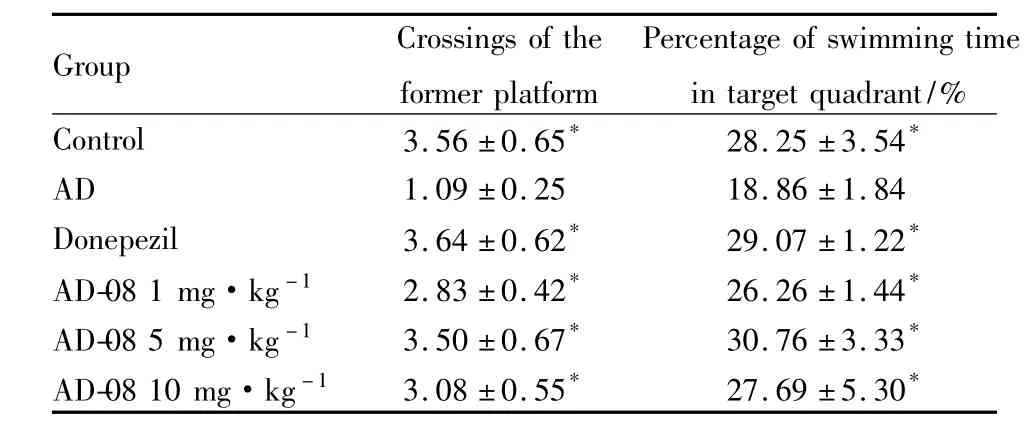
2.2 空间搜索实验 空间探索实验结果见Tab 3、4。结果显示:模型组动物穿越平台位置的次数,以及在目标象限活动时间的百分比明显少于正常组(P<0.05);而给予AD-08多奈哌齐后,SD大鼠和APP/PS1双转基因小鼠穿越平台位置的次数增多,在目标象限活动时间的百分比升高,与模型组比较差异有统计学意义(P<0.05)。定位航行实验和空间探索实验的结果表明,AD-08能够明显的改善痴呆动物的空间学习记忆能力。
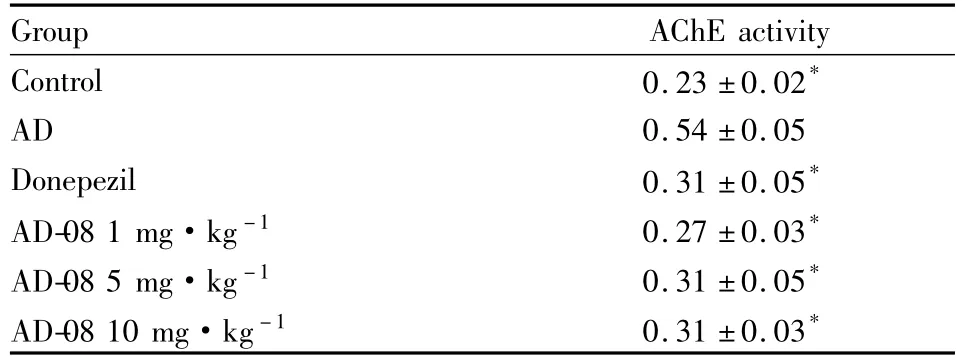
2.3 AChE活性测定 Tab 5、6的结果显示,侧脑室注射Aβ1-42蛋白的痴呆模型大鼠和APP/PS1双转基因小鼠海马组织中的AChE活性与正常对照组相比明显升高(P<0.05);给予AD-08和多奈哌齐后,上述模型动物海马组织的AChE活性明显低于模型组(P<0.05)。
Tab 3 Results of spatial probe test on rats treated by Aβ1-42(±s,n=8)
Tab 3 Results of spatial probe test on rats treated by Aβ1-42(±s,n=8)
*P<0.05 vs AD group
Group Crossings of the former platform Percentage of swimming tim in target quadrant/%Control 3.75 ±0.75* 27.80 ±1.87 e*AD 0.88 ±0.30 19.78 ±1.61 Donepezil 3.13 ±0.61* 25.83 ±1.98*AD-08 1 mg·kg-1 3.00 ±0.33* 26.94 ±2.11*AD-08 5 mg·kg-1 3.88 ±0.35* 25.72 ±1.29*AD-08 10 mg·kg-1 3.13 ±0.44* 26.61 ±1.64*
Tab 4Results of spatial probe test on APP/PS1 mice(±s,n=8)
Tab 4Results of spatial probe test on APP/PS1 mice(±s,n=8)
*P<0.05 vs AD group
Group Crossings of the former platform Percentage of swimming tim in target quadrant/%Control 3.56 ±0.65* 28.25 ±3.54 e*AD 1.09 ±0.25 18.86 ±1.84 Donepezil 3.64 ±0.62* 29.07 ±1.22*AD-08 1 mg·kg-1 2.83 ±0.42* 26.26 ±1.44*AD-08 5 mg·kg-1 3.50 ±0.67* 30.76 ±3.33*AD-08 10 mg·kg-1 3.08 ±0.55* 27.69 ±5.30*
Tab 5 Effect of AD-08 on acetylcholinesterase activity in rats(±s,n=8)

Tab 5 Effect of AD-08 on acetylcholinesterase activity in rats(±s,n=8)
*P<0.05 vs AD group
Group AChE activity Control 0.33 ±0.04*AD 0.66 ±0.07 Donepezil 0.34 ±0.04*AD-08 0.7 mg·kg-1 0.32 ±0.06*AD-08 3.5 mg·kg-1 0.30 ±0.02*AD-08 7 mg·kg-1 0.31 ±0.05*
Tab 6 Effects of AD-08 on acetylcholinesterase activity in APP/PS1 mice(±s,n=8)
Tab 6 Effects of AD-08 on acetylcholinesterase activity in APP/PS1 mice(±s,n=8)
*P<0.05 vs AD group
Group AChE activity Control 0.23 ±0.02*AD 0.54 ±0.05 Donepezil 0.31 ±0.05*AD-08 1 mg·kg-1 0.27 ±0.03*AD-08 5 mg·kg-1 0.31 ±0.05*AD-08 10 mg·kg-1 0.31 ±0.03*
3 讨论
由于AD的发病机制至今尚未被阐明,目前还没有能够通过制止神经元退行性病变来治疗AD的药物;现在临床上应用的抗AD药物主要有胆碱酯酶抑制剂(如多奈哌齐、石杉碱甲、利斯的明)、谷氨酸受体拮抗剂(如美金刚)以及改善脑循环和脑代谢的药物(如尼莫地平、脑复新等)。本研究在不同痴呆动物模型上评价了新型化合物AD-08对痴呆动物学习记忆的影响。我们的研究结果表明,AD-08能够明显改善痴呆模型动物的学习记忆能力,其作用与多奈哌齐相似;同时发现,AD-08的作用机制可能与抑制乙酰胆碱酯酶的活性有关。
AD典型的病理变化包括老年斑的形成,神经元纤维缠结并伴随胆碱能神经元的丢失[9]。Aβ淀粉样蛋白是老年斑的主要成分之一。沉积的Aβ蛋白对神经元有毒性作用,可损害胆碱能神经元而导致学习记忆能力下降。我们采用的侧脑室注射Aβ蛋白的方法是目前临床前药效学评价的经典模型[10]。APP/PS1双转基因小鼠是在APP蛋白的第670位和671位的氨基酸发生双突变以及PS1基因的第9个外显子敲除后得到的AD模型;通过基因突变和敲除,导致Aβ产生增多,能够模拟AD患者的大部分的病理特征,是一种评价AD治疗药物疗效的可靠模型[11]。研究表明[12],Aβ 蛋白沉积可造成胆碱乙酰转移酶活性降低,引起Aβ沉积周围的胆碱能神经元减少,进而导致记忆损伤。Aβ也可作用于胆碱能神经元末梢,通过抑制胆碱的摄取而减少乙酰胆碱合成,从而使大脑海马和皮质释放的乙酰胆碱减少。此外,Aβ可降低丙酮酸脱氢酶的活性,减少葡萄糖和糖原摄取,加速胆碱能神经元变性。葡萄糖代谢降低还使乙酰辅酶A生成减少,使乙酰胆碱合成受阻,进而导致胆碱能神经元和海马神经元功能减退甚至死亡。因此,能够增强大脑胆碱能神经功能的药物可以改善Aβ沉积引起的学习记忆障碍[13]。
AD-08是经过筛选得到的一种具有较好开发价值的新型化合物;它是根据多奈哌齐的化学结构改造合成的。在筛选过程中发现,该化合物脂溶性好,生物利用度高,并且能有效透过血脑屏障,在体外对乙酰胆碱酯酶具较高的选择性。其不良反应少,长期使用对肝脏影响小,这些优点使其有可能成为治疗AD的新型药物,具有重要的研究价值。本研究发现,在两种痴呆动物模型,3个实验剂量的AD-08均能改善痴呆动物的学习记忆功能,并能明显降低模型组脑组织中AChE的活性;AD-08的上述作用与相同剂量的多奈哌齐相似。本研究的结果提示,AD-08对Aβ蛋白沉积引起的痴呆动物学习记忆功能的改善作用可能是通过抑制大脑AChE活性,增强胆碱神经元功能产生的。
[1] Zeitzer J M,David R,Friedman L,et al.Phenotyping apathy in individuals with Alzheimer disease using functional principal com-ponent analysis[J].Am J Geriatr Psychiatry,2013,21(4):391-7.
[2] 张 瑶,冯天骄,张占军,.黄芩素对抗阿尔采末病及改善学习记忆能力的研究进展[J].中国药理学通报,2010,26(3):294-7.
[2] Zhang Y,Feng T J,Zhang Z J,et al.Progress in research of Baicalein affecting Alzheimer’s disease and improving learning and memory of brain[J].Chin Pharmacol Bull,2010,26(3):294 - 7.
[3] Van der Linden M.The myth of Alzheimer disease[J].Rev Med Suisse,2013,9(371):244 -5.
[4] Schneider L S.Alzheimer disease pharmacologic treatment and treatment research[J].Continuum(Minneap Minn),2013,19(2 Dementia):339-57.
[5] Maatuk N,Samson A O.Modeling the binding mechanism of Alzheimer's Abeta(1)-(4)(2)to nicotinic acetylcholine receptors based on similarity with snake alpha-neurotoxins[J].Neurotoxicol,2013,34:236 -42.
[6] 孙祎敏,郝宏强,孔卫娜,等.侧脑室注射rAAV-HIF-1a基因治疗AD模型大鼠的研究[J].南方医科大学学报,2010,30(12):2711-4.
[6] Sun H M,Hao H Q,Kong W N,et al.Effect of intracerebroventricular injection of rAAV-HIF-1α on hippocampal neuronal apoptosis in a rat model of A1zheimer disease[J].J Southern Med Univ,2010,30(12):2711 -4.
[7] Gallagher J J,Minogue A M,Lynch M A.Impaired performance of female APP/PS1 mice in the Morris water maze is coupled with increased Abeta accumulation and microglial activation[J].Neuro degener Dis,2013,11(1):33 -41.
[8] 李爱萍,赵 慧,李 韶,等.不同鼠种在Morris水迷宫学习记忆行为中的种属差异[J].中国行为医学科学,2005,14(1):29-31.
[8] Li A P,Zhao H,LI Y,et al.Species differences of muridae in the learning and memory behavior in morris water maze[J].Chin J Behav Med Sci,2005,14(1):29 - 31.
[9] Vanhoutte G,Pereson S,Delgado Y,et al.Diffusion kurtosis imaging to detect amyloidosis in an APP/PS1 mouse model for Alzheimer's disease[J].Magn Reson Med,2013,69(4):1115 -21.
[10]冯 松,何煦昌,白东鲁,等.Aβ蛋白分泌酶抑制剂研究进展[J].化学进展,2004,16(5):791 -6.
[10] Feng S,He X C,Bai D L,et al.Studies of secretase inhibitors of amyloid-β protein[J].Prog Chem,2004,16(5):791 -6.
[11] Liu C C,Kanekiyo T,Xu H,et al.Apolipoprotein E and Alzheimer disease:risk,mechanisms and therapy[J].Nat Rev Neurol,2013,9(4):184.
[12] Bellucci A,Luccarini I,Scali C,et al.Cholinergic dysfunction,neuronal damage and axonal loss in TgCRND8 mice[J].Neurobiol Dis,2006,23(2):260 -72.
[13] Zeng X,Wang T,Jiang L,et al.Diazoxide and cyclosporin A protect primary cholinergic neurons against beta amyloid(1-42)induced cytotoxicity[J].Neurol Res,2013,35(5):529 -36.
- 中国药理学通报的其它文章
- 乙酰胆碱在大鼠海马CA1区痛觉调制中的作用