辛辣组分对高良姜提取物抗菌活性的影响
(广东医学院广东省天然药物研究与开发重点实验室,广东湛江 524023)
高良姜(Alpinia officinarumHance)为十大广药之一,具有温中散寒,理气止痛等功效。近年来报道高良姜提取物具有抑菌、抗癌、抗氧化和清除自由基等多种重要药理活性[1],其黄酮类药用资源堪比银杏叶,所富含的高良姜素被认为是蜂胶的主要活性成分[2-4]。但高良姜十分辛辣,在医药、保健食品等方面的应用和剂型选择上受到限制。本文分离提取出高良姜中的辛辣组分,对分离前后各部分的抗菌作用进行评价和比较,探讨辛辣组分的分离对高良姜抗菌活性的影响,为高良姜活性成分保健食品的组方和调味品特色开发提供科学参考。
1 材料与方法
1.1 材料
1.1.1 仪器
LC-10Avp型高效液相色谱仪:日本,岛津;旋转蒸发仪:上海申生科技有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司;超声清洗仪:上海必能信超声有限公司;砂芯漏斗(250 mL,直径70 mm)。DL-CJ-2F实验医用超净工作台:哈尔滨市东联电子技术开发有限公司北京分公司;隔水式电热恒温培养箱:上海跃进医疗器械厂;自动台式灭菌器:山东新华医疗器械股份有限公司。
1.1.2 原料与试剂
高良姜:人工种植3年,采于广东徐闻龙塘镇八角村;乙腈、甲醇、四氢呋喃(HPLC级):美国TEDIA试剂公司;其它试剂均为分析纯;二苯基庚烷A对照品(Diaryl-heptanoid A,DHA):广东医学院广东省天然药物研究与开发重点实验室纯化;注射用双黄连冻干粉针剂:哈药集团中药二厂,批号0611008;硅胶G高效薄层板、HF254薄层层析硅胶(200目~300目):青岛海洋化工产品。
金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、白色念珠菌均由广东医学院病原生物学实验室提供。采用MH培养基培养金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌(培养24 h),采用沙保培养基培养白色念珠菌(培养48 h)。
1.2 方法
1.2.1 高良姜提取物的制备
取高良姜根茎的干燥粉末(40目),以乙酸乙酯超声提取3次(室温,30 min/次),提取液减压浓缩,制备成浸膏,得总提取物;浸膏以 72%乙醇∶石油醚(1∶1,体积比)萃取,分取含水乙醇层和石油醚层;含水乙醇层减压浓缩制得提取物Ⅰ。采用减压硅胶柱层析(VLC)对提取物Ⅰ作进一步分离。
1.2.2 减压硅胶层析柱的制备[5]
250 mL砂芯漏斗中装入薄层层析硅胶(200目~300目),在真空泵减压条件下装柱,形成直径10 cm、高5.5 cm的柱床。在减压条件下以石油醚活化硅胶柱,并以流动相前沿平行度检测装柱质量。抽干石油醚后即可上样。
1.2.3 辣味成分的分离
称取10 g提取物Ⅰ,用丙酮为溶剂分散于薄层层析硅胶中,干法上样。选用石油醚-乙酸乙酯体系为洗脱剂,洗脱剂中乙酸乙酯的含量(V/V)依序为30%、33.3%、35%、36%、36.3%、36.6%、38%、39%、40%、41%、42%、100%,每个配比的洗脱剂洗脱1倍柱床体积、并抽干,共得12个馏分。分别收集洗脱液并浓缩,以薄层色谱(Thin-layer chromatogram,TLC)检测分离效果,并对各组分的辣味进行感官检测。合并36.6%~39.0%馏分为辛辣组分,其余部分合并为非辛辣组分。非辛辣组分标记为提取物Ⅱ,辛辣组分标记为提取物Ⅲ。
1.2.4 纸片琼脂扩散法抑菌试验[6]
以双黄连注射液为阳性对照,采用抑菌圈法测定提取物Ⅰ、Ⅱ和Ⅲ的抗菌活性。菌株选用金黄色葡萄球菌、枯草芽孢杆菌白色念珠菌、大肠杆菌4种,提取物药液设3浓度水平3平行,同时作丙酮和蒸馏水作空白对照。用无菌棉拭沾取菌液在MH琼脂平板(白色念珠菌用沙保琼脂平板)表面作均匀密集划线,3 min~5 min后用无菌镊子将含有药液的滤纸片紧贴于涂菌琼脂表面上。将平板置于37℃生化培养箱中,分别培养24 h和48 h。以上步骤均在无菌条件下操作。测定各样品的抑菌圈直径,计算平行样的平均值。药液浓度和抑菌圈测定结果如表1。
1.2.5 试管二倍稀释法测定MIC
根据抑菌实验的结果,选取敏感菌测定各药液的最低抑菌浓度。
1)供试液配制:以95%乙醇将提取物Ⅰ、Ⅱ和Ⅲ分别配制成100、72、28 mg/mL3个浓度的供试液;双黄连粉针剂用蒸馏水配制为8 g/mL的供试液。
2)药物浓度倍比稀释取110支试管排成10排,每排11支试管,每种药物2排(2个平行)。另取2支试管用作“肉汤”和“待测菌生长”对照。每排第1支试管中加入5.7 mL的MH肉汤,每排第2支试管为空管,其余各管内加入2 mL的MH肉汤。在每排第1支试管分别中加入0.3 mL药液,混匀后从中吸取2 mL分别加入第2、3支试管中,混匀后从第3支试管中吸取2 mL加入第4支试管,依次对倍稀释至11管;同时乙醇阴性对照。
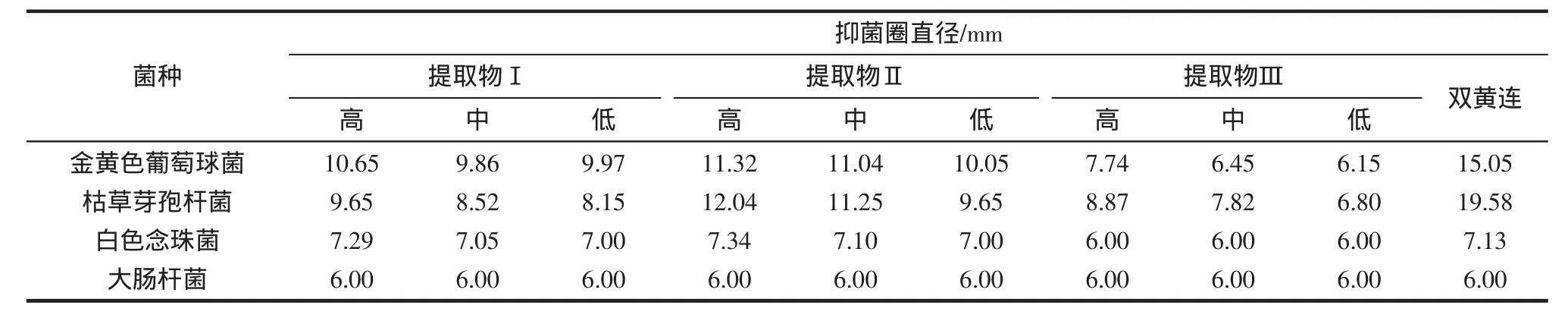
表1 高良姜提取物对4种菌株的抑菌圈直径Table 1 Diameter of antibacterial circle of extracts from Galangal for 4 bacteria mm
3)待测菌悬液的制备:挑取孵育18 h~24 h的平板上数个菌落于3 mL~5 mL生理盐水管中,校正浓度至0.5麦氏比浊标准(约108 cfu/mL)。
4)每排第1支试管及肉汤对照除外,其余各管分别加入40μL菌悬液,使最终细菌接种量为106 cfu/mL。放在37℃恒温箱培养24 h(白色念珠菌48 h)后观察,以无肉眼可见菌生长的最低药物浓度为该药的最低抑菌浓度(MIC),结果见表2。
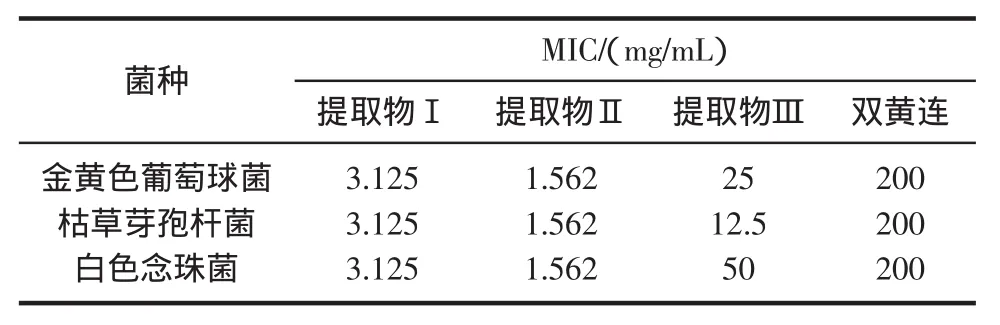
表2 高良姜提取物对3种菌株的MICTable 2 MIC of extracts from Galangal for 3 bacteria
1.2.6 MBC的测定
MIC测定后,将未见菌生长各管培养物混匀后,吸取0.1 mL于MH琼脂平板(白色念珠菌用沙保琼脂平板)上,涂布均匀,每个样品平行2份,置37℃恒温箱培养24 h(白色念珠菌48 h)后观察结果,以菌落平均数少于5个的最低药物浓度为该药的最低杀菌浓度(MBC),结果见表 3。
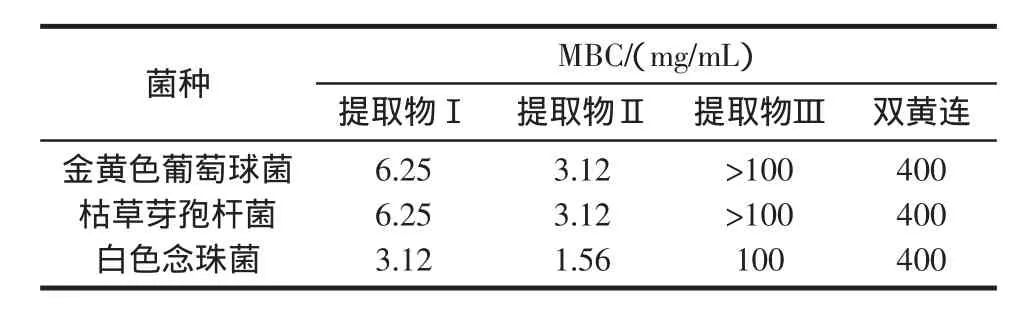
表3 高良姜提取物对3种菌株的MBCTable 3 MBC of extracts from Galangal for 3 bacteria
2 结果与讨论
2.1 分离效果评价
2.1.1 TLC检测
以1.2.3项下得到的12个洗脱液进行薄层色谱分离检测。取样 5 μL 点板,以氯仿∶甲醇=99∶1(体积比)展开、5%香草醛-浓硫酸显色,薄层色谱图如图1。
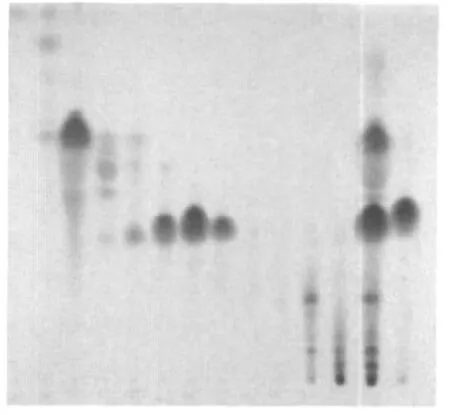
图1 VLC分离组分的薄层色谱图Fig.1 TLC Chromatogram of fragments eluted from VLC
图中色谱轨道由左到右1~12道为VLC洗脱流份,石油醚-乙酸乙酯体系中乙酸乙酯的含量依序为30%、33.3%、35%、36%、36.3%、36.6%、38%、39%、40%、41%、42%、100%(体积分数)。第13道为提取物Ⅰ,第14道为DHA(二苯基庚烷A,辣味成分对照品)。
2.1.2 提取物的HPLC检测
将提取物Ⅰ、Ⅱ和Ⅲ以甲醇制成每毫升相当于0.1g生药的试液,过0.45μm滤膜;同时以甲醇配制100 μg/mL二苯基庚烷A对照品溶液,进行HPLC检测。液相色谱条件:DiamonsilC18色谱柱(250mm×2.0mm,5.0 μm);流动相A为0.1%醋酸-水、流动相B为乙腈-甲醇-四氢呋喃(15∶40∶45);色谱程序为:0~20 min,39%B~61%B;20 min~30 min,61%~100%B;30 min~40 min,100%~100%B;0~19 min,280 nm;19 min~40 min,345 nm;流速0.2 mL/min,柱温35℃,进样体积5 μL。色谱图如图2。
图2中的a、b、c、d四张图对比表明,提取物Ⅰ中的辣味成分得到了较好的分离,提取物Ⅲ(辣味组分)主峰的保留时间与二苯基庚烷A对照品一致,提取物Ⅲ主峰的归一化面积比近90%。
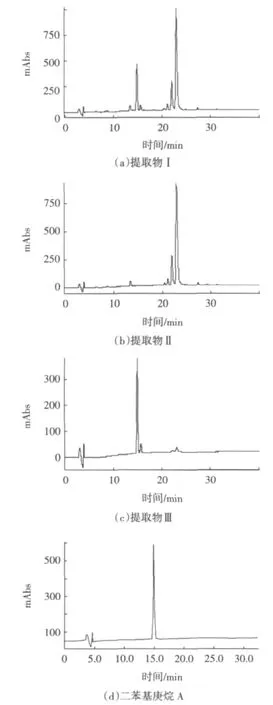
图2 高良姜提取物的色谱图Fig.2 HPLC chromatogram of extracts
2.2 抗菌活性评价
利用VLC从高良姜提取物中分离出的不同部位对4种菌株的抑菌圈、MIC和MBC实验结果表明,脱除辣味成分的高良姜提取物Ⅱ对革兰氏阳性菌(金葡,枯草)和真菌(白色念珠菌)均具有明显的抑制作用,且其抗菌作用强于双黄连(其MIC和MBC均小于双黄连200 mg/mL和400 mg/mL)、且呈剂量依赖性。提取物Ⅱ的抗菌作用强于提取物Ⅰ,提取物Ⅲ(辛辣组分)的抗菌作用最弱。
3 结论
减压硅胶柱层析(VLC)制备色谱每次可洗脱所选流动相下Rf值大于0.5的组分。每次洗脱后抽干,可以根据目标成分机动选择流动相的配比,也可以逐步改变流动相比例实现梯度洗脱。该方法突出了被分离组分之间分配系数上的差异,受色谱峰扩散影响小,可间歇操作,因而具有简捷、高效的特点,特别适用于天然产物目标成分的分离制备[7]。
高良姜提取物Ⅰ富含黄酮类和二苯基庚烷类等芳香类活性成分,从中分离出辣味部位(提取物Ⅲ)后的高良姜提取物Ⅱ,对金黄色葡萄球菌,枯草芽孢杆菌及白色念珠菌仍有较强的抑菌和杀菌作用,活性与提取物Ⅰ基本相当、且活性呈剂量依赖性。本实验表明,对所试的4个菌株,辣味部位(提取物Ⅲ)非高良姜抗菌活性的主要成分。
[1] 吕玮,蒋伶活.高良姜的化学成分及药理作用[J] .中国药业,2006,15(3):19-21
[2] 范可武,孟宪惠,徐文豪.银杏叶中黄酮含量的季节性变化[J] .中草药,1997,28(4):211-212
[3] 邓亦峰,冯丽娜,罗辉.反相高效液相色谱法测定不同月份高良姜中高良姜素的含量[J] .中国药学杂志,2010,45(20):79-82
[4] 王小平,林励,陈振霖,等.HPLC法测定不同产地蜂胶中高良姜素的含量[J] .中药材,2007,30(5):560-562
[5] Harwood L M.‘Dry Flash’Column Chromatography[J] .Aldrichimica Acta,1985,18(1):25
[6] 徐叔云,卞如濂,陈修.药理实验方法学[M] .2版.北京:人民卫生出版社,1991:1340-1350
[7] SWILLIAM PELLETIER,HITESH P CHOKSHI,HARIDUTT K DESAI.Separation of diterpenoid alkaloid mixtures using vacuum liquid chromato-graphy[J] .Journal of natural products,1986,49(5):892-900

