滚环扩增阳离子共轭聚合物均相检测microRNA
成永强,贾海莲,唐志远,赵晶晶,李正平
(河北大学 化学与环境科学学院,药物化学与分子诊断省部共建教育部重点实验室,河北 保定 071002)
microRNA(miRNA)是细胞内源性非蛋白编码的小分子RNA(19~24个碱基)[1],其表达水平与人类重大疾病密切相关[2].miRNA 现已成为一种新的生物标记物应用于癌症等重大疾病的早期诊断和治疗[3].例如,研究发现miR221在结肠癌、人脑胶质母细胞瘤等多种细胞中过表达,因此,miR221分析对与其相关疾病的诊断和治疗具有重要意义[4].但是,由于miRNA 分子小、含量低,许多同源miRNA 序列相似度高,仅差1~2个碱基,因此,高灵敏度的miRNA 检测一般需要特异、高效的扩增技术[5].
滚环扩增(rolling circle amlification,RCA)是近年来出现的一种高效的扩增技术,它以寡聚核苷酸为引物,以单链环状DNA,即锁式探针(Padlock Probe,PLP)为模板,在具有顶替作用DNA 聚合酶的作用下实现DNA 的高效扩增,生成包含若干质量复序列的DNA 长链产物[6].RCA 技术应用于miRNA 检测具有显著的优点:恒温扩增,不需要热循环;特异性好,小分子miRNA 正好可以作为环形DNA 探针成环的模板,并且所用的酶连接反应可精确识别单碱基错配;扩增产物为上百个串联重复序列的长链DNA,能同时结合几百个特异标记探针,检测信号集中[7].但是,利用标记探针检测经常需要固相的分析模式,需要多步杂交和洗涤,步骤繁琐.当前,RCA 均相检测miRNA 多采用荧光染料与DNA 产物相结合并产生强荧光进行检测[8].但由于荧光染料与溶液中的DNA 和RNA 都能结合,在实际样品分析时易使检测的背景值偏高.
本文中,为了降低RCA 反应均相检测miRNA 的背景值,提高检测的灵敏度,同时克服标记探针固相分析的不足,笔者首先使荧光标记探针与长链DNA 产物杂交,然后,加入阳离子共轭聚合物(catiomic conjugated polymer,CCP),其与DNA 产物可通过静电力作用结合,同时与杂交的荧光标记探针发生高效的荧光共振能量转移(fluorescence resonance energy ransfer,FRET)[9];未杂交的单链荧光标记探针应用Exo I水解成单核苷酸,其与CCP相互作用力弱,不能发生有效的FRET,无需分离和洗涤步骤,可实现RCA 扩增miRNA 的均相、特异检测.方法与非特异荧光染料相比,可有效降低均相检测miRNA 的背景值.
1 材料与方法
1.1 仪器和试剂
F4500荧光分光光度计(Hitachi,日本);2720 Thermal Cycler(Applied Biosystems,USA);Phi29 DNA 聚合酶、ExoΙ(Epicenter Biotechnologies,USA);T4RNA ligase2(New England Biolabs,USA);实验选用miR221作为研究的目标miRNA,所有合成的寡聚核苷酸引物及miR221序列(表1)、脱氧核苷三磷酸的混合物(dNTPs)、Ribonuclease Inhibitor和焦碳酸二乙酯(DEPC)处理水购自大连宝生物科技有限公司(Takara,Dalian);4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid(HEPES)购自Sigma.所用阳离子共轭聚合物(CCP)为poly[(9,9-bis(6-N,N,N-trimethylammonium)hexyl)fluorenylenephenylenedibromide](PFP)购自常州欣宏科生物化学有限公司.实验所用试剂均为分析纯,实验用水为DEPC处理过的超纯灭菌水.

表1 实验所用寡聚核苷酸引物及miRNA序列(5′-3′)Tab.1 Sequences of probes and miRNA used in the experiments(5′-3′)
1.2 实验方法
1.2.1 锁式探针的连接成环反应
在200μL的PCR 管中加入0.5μL 的10×T4RNA Ligase2缓冲溶液,其中含有500mmol/L Tris-HCl,pH 为7.5,20mmol/L的MgCl2,10mmol/L 的二硫苏糖醇(DTT),4mmol/L 的ATP.再加入1μL的200nmol/L的PLP 探针溶液,0.5μL的40U/L Ribonuclease Inhibitor,适量的miR221溶液,加DEPC处理水至6μL,加热到55℃保存3min.然后在37℃保持20min.加入3U 的T4RNA Ligase2,0.5μL的10×T4RNA Ligase2缓冲溶液和DEPC处理水至终体积为10μL,于37 ℃连接成环50min.反应完后,在溶液中加入40U 的ExoⅠ,于37 ℃保持60min,在80 ℃温育15min,以失活ExoⅠ.
1.2.2 RCA 反 应
在连接反应溶液中,加入10μL 的Phi29DNA 聚合酶反应溶液,其中包括:200mmol/L 的Tris-HCl,250mmol/L的KCl,50mmol/L 的MgCl2,25mmol/L 的(NH4)2SO4,20mmol/L 的DTT,1.25mmol/L的dNTPs,30U 的phi29DNA 聚合酶,在30 ℃下进行RCA 反应4h,于75 ℃温育5min,失活phi29DNA聚合酶.
1.2.3 RCA 产物的荧光检测
取RCA 产物9μL,加入2μL的2μmol/L荧光标记DNA 探针,混匀后在70 ℃下保持3min,于37 ℃杂交45min.反应完后加入20U 的ExoΙ,在37 ℃保持60min,80 ℃温育15min,失活ExoⅠ.
在500μL的离心管内加入194μL 的HEPES溶液(25mmol/L,pH=7.8),4μL 的杂交产物和2μL的15μmol/L PFP溶液,总体积为200μL.应用F-4500荧光分光光度计在激发波长为380nm,扫描波长为400~600nm 下进行测量.
2 结果与讨论
2.1 RCA 反应均相检测miRNA 原理
利用滚环扩增反应结合阳离子共轭聚合物荧光共振能量转移均相检测miRNA 的原理如图1所示.设计的PLP探针首先以目标miRNA 分子(miR221)为模板,在T4RNA ligase2的作用下连接成环.T4RNA ligase2在以miRNA 为模板连接DNA 探针时具有很好的特异性[7],而且能高效地催化连接3′端有2 个RNA 碱基修饰5′端磷酸化修饰的DNA 引物[10].因此,为了提高连接效率,设计PLP 探针的3′端有2 个RNA 碱基修饰.未成环的线性PLP探针用ExoΙ降解,以防止其影响后面的RCA 和标记探针的杂交反应.当加入Phi29DNA 聚合酶反应溶液,miRNA 分子可直接作为引物引发RCA 反应,生成具有上百重复序列的长链DNA 产物.然后,在RCA 产物溶液加入与长链DNA 产物序列互补的荧光素标记探针,使其充分杂交.而溶液中未杂交的过量荧光素标记探针利用ExoΙ降解成单核苷酸分子.当在产物溶液中加入阳离子共轭聚合物(PFP)时,由于其阳离子骨架可与核酸分子通过强静电力结合,并且长链的共轭分子结构具有特殊的光学和电化学性能,具有优良的光捕获性质和信号放大能力[11],PFP 与荧光标记的DNA 产物通过静电力作用相结合,能发生强烈的荧光共振能量转移(FRET).而被降解的荧光素标记单核苷酸分子电荷小,其与PFP作用较弱,距离较远,二者之间不能发生有效的FRET.因此,根据FRET 效率的大小可以实现RCA 扩增miRNA 的均相检测.
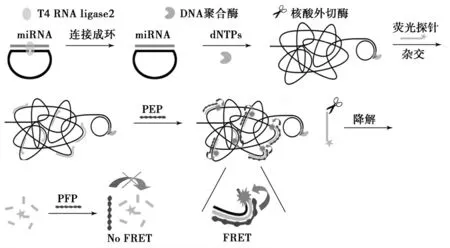
图1 RCA反应阳离子共轭聚合物均相检测miRNA原理Fig.1 Principle of homogeneous detection of miRNA by RCA and CCP
图2为miRNA(miR221)样品与空白溶液经RCA 反应后应用PFP检测的荧光光谱图.从图2曲线a可见,目标miR221分子的反应产物的荧光光谱在PFP的荧光峰(λem=420nm)处降低.同时,荧光素分子的荧光发射峰(λem=525nm)显著增强,表明发生了PFP到荧光素分子的能量转移.目标miR221可使PLP成环并引发RCA 反应,产生的DNA 长链上杂交了多个荧光素标记的DNA 探针.在加入PFP 后,其能与DNA分子通过静电力作用相互吸引,PFP作为能量供体把能量转移到DNA 上标记的荧光素分子上,产生高效的FRET.而在空白溶液中(曲线b),在525nm 荧光素的荧光强度很低,同时420nm 处PFP的荧光值高于样品的荧光值,其FRET 效率(I525nm/I420nm)显著比miR221产生的低.这是由于在空白溶液中,不能发生连接成环反应,亦不能引发RCA 反应.单链荧光素标记探针被ExoΙ消化降解为单核苷酸小分子,其电荷小,与PFP的结合能力弱,不能产生有效的FRET.据此,笔者优化了反应实验条件,建立了RCA 扩增均相检测miRNA 的新方法.

图2 miRNA的RCA反应产物应用PFP检测的荧光光谱Fig.2 Fluorescence spectra from solution containing PFP and RCA products from miRNA
2.2 荧光标记探针浓度对实验结果的影响
实验过程中,锁式探针浓度和PFP的用量等反应条件对结果影响较小.而荧光标记探针的浓度对实验结果的影响较大,需进行优化.
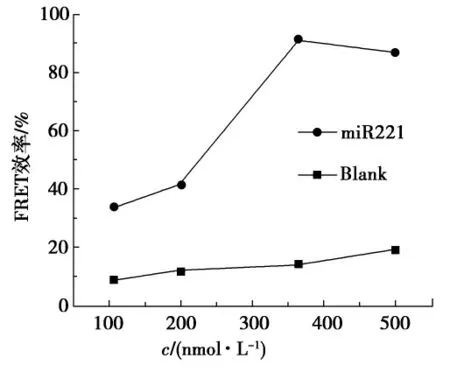
图3 荧光标记探针的浓度对实验结果的影响Fig.3 Effect of concentration of fluorescein-labeled probe on the experimental results
荧光标记探针的用量对PFP引起的FRET 效率(I525nm/I420nm)有着较大影响,实验优化了不同用量荧光标记探针对FRET 效率的影响.图3为荧光标记探针的浓度分别为105,200,364,500nmol/L 时,空白和样品的FRET 效率情况.如图3所示,miRNA 的反应产物的FRET 效率随荧光标记探针浓度升高而显著提高.当超过364nmol/L时,FRET 效率提高并不明显,表明荧光标记探针浓度为364nmol/L 时,其与RCA产物进行充分杂交,FRET 效率最大;而加入浓度再增加时,过量的标记探针会被ExoΙ降解消化掉,FRET效率几乎保持不变.因此,实验选择364nmol/L为最佳荧光标记探针用量.
2.3 方法的校准曲线和灵敏度
在最佳荧光标记探针用量,RCA 反应4h的实验条件下,测量了不同浓度miR221的荧光共振能量转移效率.如图4所示,miR221的浓度在0.5~100pmol/L 内,反应产物的相对FRET 效率随其浓度的增加而增强.并且,相对FRET 效率与miR221浓度在0.5~20pmol/L内呈良好的线性关系(图4插图).线性方程为Y=1.928+2.513cmiR221(pmol/L),Y 为相对FRET 效率.相关系数R=0.997 8,检出限(3σ,n=11)为0.2pmol/L.对10pmol/L的miR221重复测定5次,其相对标准偏差为5.4%.
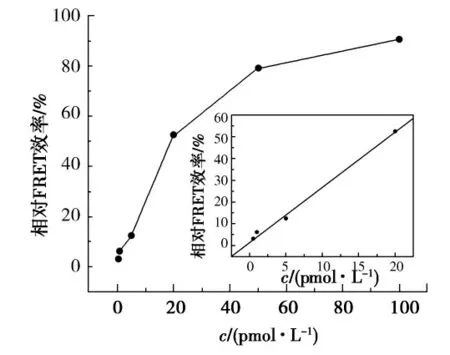
图4 相对FRET效率与目标miR221不同浓度的关系Fig.4 Relationship between the relative FRET efficiency and the concentration of target miR221
3 结论
提出了一种利用滚环扩增结合阳离子共轭聚合物的荧光共振能量转移技术均相检测miRNA 的新方法.方法针对通常标记探针必须用固相检测方式的不足,在荧光标记探针与RCA 产物杂交后,使用单链特异核酸外切酶I降解过量的荧光标记探针.然后,利用阳离子共轭聚合物PFP与荧光标记探针产生荧光共振能量转移,实现了RCA 反应标记探针的均相检测.同时,基于PFP 独特的光学特性,可进一步提高目标miRNA 检测的灵敏度.方法简便,背景低,灵敏度高,不需要繁琐的分离和精确的控温步骤.方法可为miRNA 及DNA 等的均相RCA 检测和原位成像分析以及临床诊断提供一种新策略.
[1] HE Lin,HANNON G J.MicroRNAs:small RNAs with a big role in gene regulation[J].Nat Rev Genet,2004,5:522-531.
[2] HAMMOND S M.MicroRNA detection comes of age[J].Nat Methods,2006,3:12-13.
[3] MITCHELL P S,PARKIN R K,KROH E M,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci,2008,105:10513-10518.
[4] SAGE C I,NAGEL R,EGAN D A,et al.Regulation of the p27Kip1tumor suppressor by miR-221and miR-222promotes cancer cell proliferation[J].EMBO J,2007,26:3699-3708.
[5] CHEN C,RIDZON D A,BROOMER A J,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33:e179.
[6] LIZARDI P M,HUANG Xiaohua,ZHU Zhengrong,et al.Mutation detection and single-molecule counting using isothermal rolling-circle amplification[J].Nat Genetics,1998,19:225-232.
[7] CHENG Yongqiang,ZHANG Xian,LI Zhengping,et al.Highly sensitive determination of microRNA using targetprimed and branched rolling-circle amplification[J].Angew Chem Int Ed,2009,48:3268-3272.
[8] YAO Bo,LI Juan,HUANG Huang,et al.Quantitative analysis of zeptomole microRNAs based on isothermal ramification amplification[J].RNA,2009,15:1787-1794.
[9] DUAN Xinrui,LIU Libing,FENG Fude,et al.Cationic conjugated polymers for optical detection of DNA methylation,lesions,and single nucleotide polymorphisms[J].Acc Chem Res,2010,43:260-270.
[10] ZHANG Jiangyan,LI Zhengping,WANG Hui,et al.Ultrasensitive quantification of mature microRNAs by real-time PCR based on ligation of a ribonucleotide-modified DNA probe[J].Chem Commun,2011,47:9465-9467.
[11] FENG Fude,HE Fang,AN Lingling,et al.Fluorescent conjugated polyelectrolytes for biomacromolecule detections[J].Adv Mater,2008,20:2959-2964.

