三烷基钇配合物合成及在催化Tishchenko 反应中的应用
徐 宾
(1.拉萨师范高等专科学校,西藏 拉萨850003;2.苏州大学 材料与化学化工学院,江苏省重点有机实验室,江苏 苏州215123)
0 引 言
近年来,烷基稀土金属配合物由于其较高的催化活性逐渐成为人们研究的热点[1-7]。但是,烷基稀土配合物通常不稳定,容易发生配体再分配或β—H 消除等反应,要稳定所生成的烷基稀土配合物,往往需要空间位阻较大的烷基化试剂(R = (Me3Si)2CH-,Me3SiCH2-,t-BuCH2-,(Ph2P)2CH-)[8]来稳定它。
均配型三烷基稀土配合物是合成许多复杂烷基稀土催化剂的前体,到目前为止人们对于烷基稀土配合物催化性质的研究往往注重于单烷基稀土配合物和二烷基稀土配合物[9-14],对于均配型三烷基稀土配合物的催化性质研究较少。因此,我们参照文献合成了三烷基钇稀土配合物,以此为催化剂,考察了其在催化Tishchenko 反应中的行为。
1 实验部分
1.1 主要试剂与仪器
所有操作均需采用Schlenk 技术,在严格的无水无氧及氩气保护条件下进行。四氢呋喃,甲苯,正己烷用无水氯化钙干燥数天后,加金属钠回流至加入二苯甲酮后呈蓝紫色,蒸出备用;将醛类用氢化钙干燥数日后减压蒸出,封管备用。
Carlo Erba 1110 型元素分析仪;Electrothermal Engineering Limited 8100 系列数字熔点仪;Unity Inova-400 型NMR 仪。
1.2 三烷基钇YR3 稀土配合物的合成
均配型三烷基稀土配合物YR3(R = CH2C6H4-NMe2-o)按文献方法[8]由2-(二甲胺基)苄基的锂盐与相应的无水三氯化钇反应制得,如图1 所示。
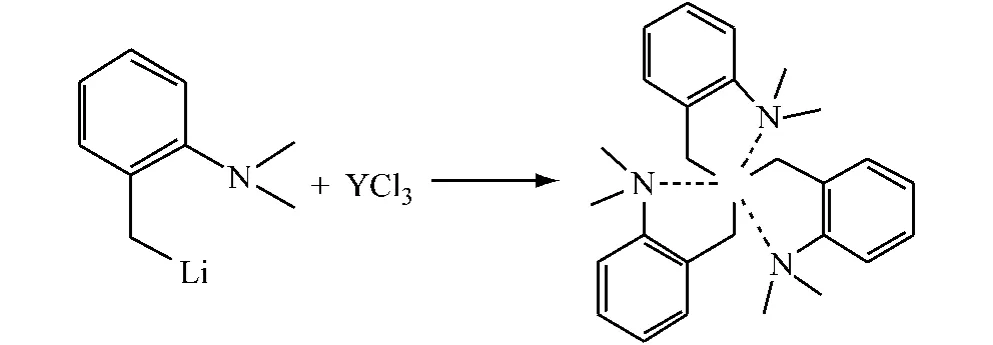
图1 三烷基钇稀土配合物的合成
1.3 Tishchenko 反应步骤
YR3催化Tishchenko 反应的步骤相似,以苯甲醛为例:将一定量的催化剂溶于0.5 mL 甲苯中,加入1 mmol 苯甲醛,在一定温度下搅拌一定时间后,用蒸馏水破坏催化剂以终止反应。水相用乙醚萃取(10 mL×3)。合并有机相,加入无水硫酸钠干燥。洗脱液为乙酸乙酯∶石油醚 = 1 ∶40,过硅胶柱得纯产品。
2 结果与讨论
2.1 三烷基钇稀土配合物的表征
配合物YR3的1H NMR (400 MHz,C6D6,25 °C,δ ):1.61 (s,2H,CH2C6H4N(CH3)2-o),2.06 (s,6H,N(CH3)2),6.61-6.67 (m,1H,aromatic),6.78~6. 81 (m,1H,aromatic),6. 93 ~6. 98 (m,1H,aromatic),7.03 ~7.06 (m,1H,aromatic)。
2.2 配合物YR3 催化Tishchenko 反应
Tishchenko 反应是指2 分子的醛自身发生缩合成羧酸酯的反应,见图2,是1 种原子经济型反应。此反应有很重要的工业价值,也有很多的专利。
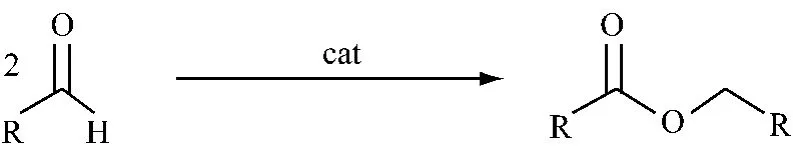
图2 Tishchenko 反应方程式
但是以稀土配合物催化该反应的报道却不多。Onozawat 等[15]首次采用茂基为辅助配体的硅甲基稀土金属配合物(C5Me5)2LnCH(SiMe3)2(Ln =La,Nd)催化Tishchenko 反应,但反应时间较长,需要3 d,并且催化剂价格较高且难以制备。Roesky 等[16-17]发现三甲基硅胺稀土金属配合物Ln[N(SiMe3)2]3在催化Tishchenko 反应时,室温,1 天就可完成反应,活性在以苯甲醛作为底物时要好于硅甲基稀土金属化合物,且催化剂较易制备。后来,Roesky 等[18]又报道了以三脒基稀土金属配合物作为催化剂催化Tishchenko 反应,结果发现,脒基配体的体积越小,反应活性越高。但是催化剂合成上要用到烷基汞,生成物有金属汞,较为复杂。庞明伦等[5]发现胺基桥联双芳氧基钇2-(二甲胺基)苄基配合物LYR(L = Me2NCH2CH2N{CH2-(2-O-C6H2-But2-3,5)}2,R = CH2C6H4-NMe2-o)可以高活性的催化Tishchenko 反应,反应时间短,适应底物较广。但对于均配型三烷基钇稀土配合物YR3的催化效果没有讨论,因此,我们初步研究了YR3催化Tishchenko 反应的性能,发现YR3催化Tishchenko 反应具有一定的活性,产率中等。结果列于表1 中。
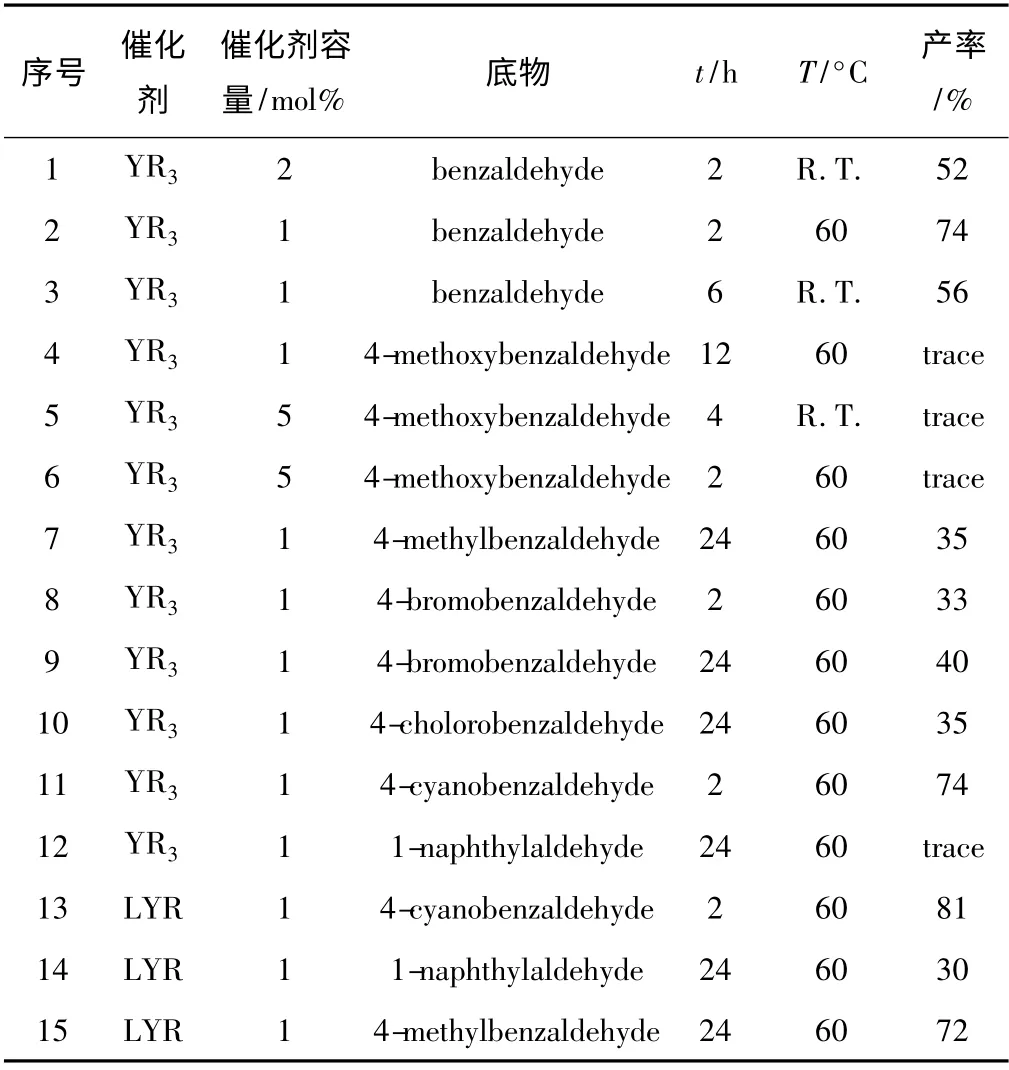
表1 YR3、LYR 催化Tishchenko 反应的结果a
从表中可以看出,以苯甲醛为底物,当催化剂用量为1 mol%时,在60 °C条件下反应2 h,产率为74%,与相同条件下以LYR 为催化剂时产率接近[5]。升高温度有助于加快反应速率(序号1 ~3)。适当延长反应时间,对产率影响不大(序号8 ~9)。YR3对底物的适应性不太好,以对氰基苯甲醛为底物时,产率较高,为74%(序号11),与相同条件下以LYR 为催化剂时产率接近[5]。而以对溴、对氯、对甲基苯甲醛为底物时,产率较低(序号7 ~10,15),仅为LYR 催化产率的一半[5]。当以1-萘醛、对甲氧基苯甲醛为底物时,反应不发生,而 LYR 催化对甲氧基苯甲醛进行Tishchenko 反应时产率高达86%[5]。由此可见,辅助配体的加入可以明显改变配合物的催化活性。
根据Roesky 小组[17]提出的机理:醛类先与稀土金属配位生成烷氧配合物,继而发生氢转移反应而完成催化循环,氢转移反应过程为决速步骤。所以猜测LYR 中的辅助配体L 在催化过程中没有解离下来,较大的空间效应使发生氢转移的两个分子非常接近,见图3,而使反应速度加快,所以LYR 催化活性相对于前体YR3的活性高。
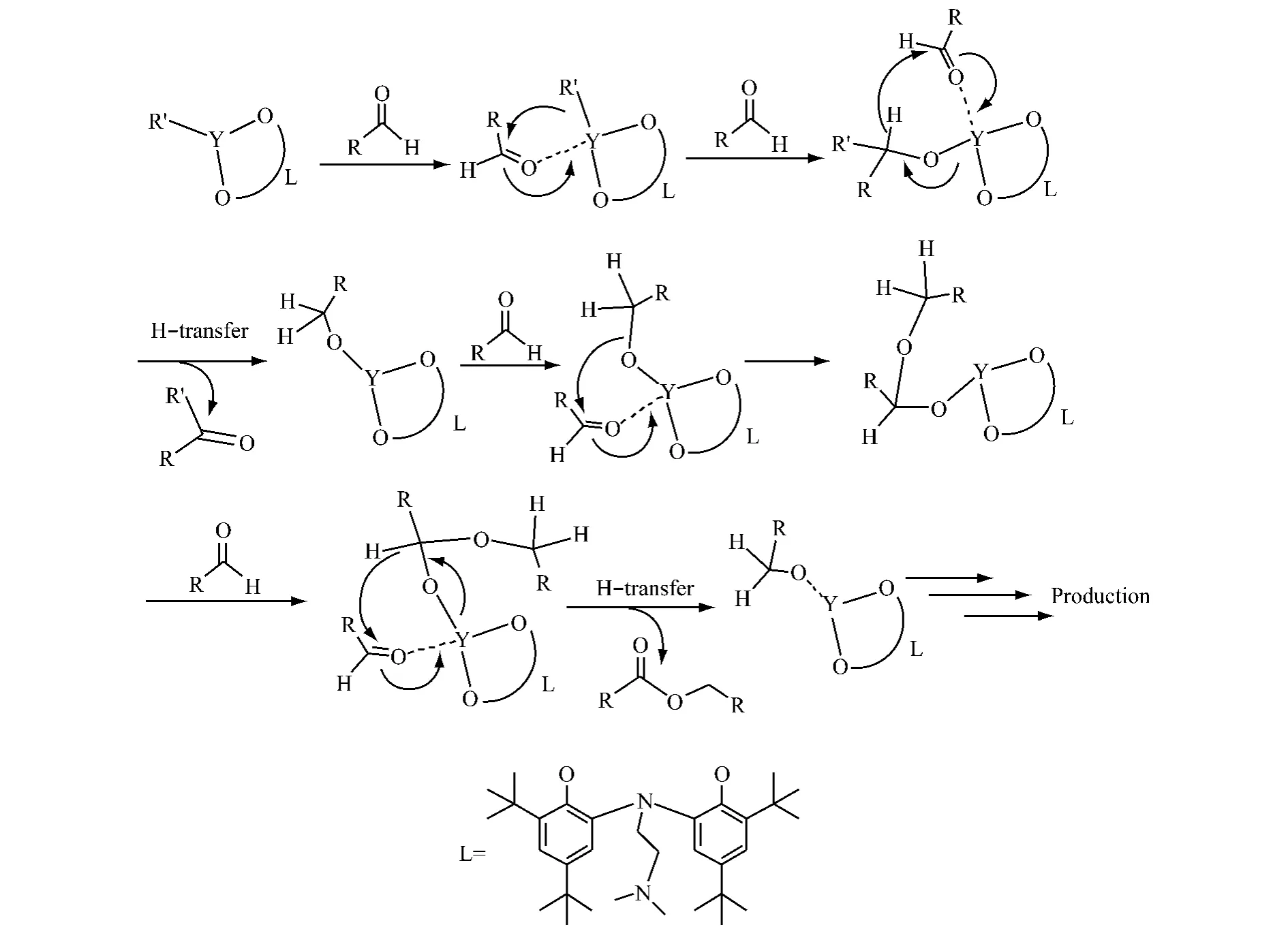
图3 LYR 催化Tishchenko 反应可能的机理
2.3 Tishchenko 反应各产物的核磁数据
各产物的核磁数据见表2。
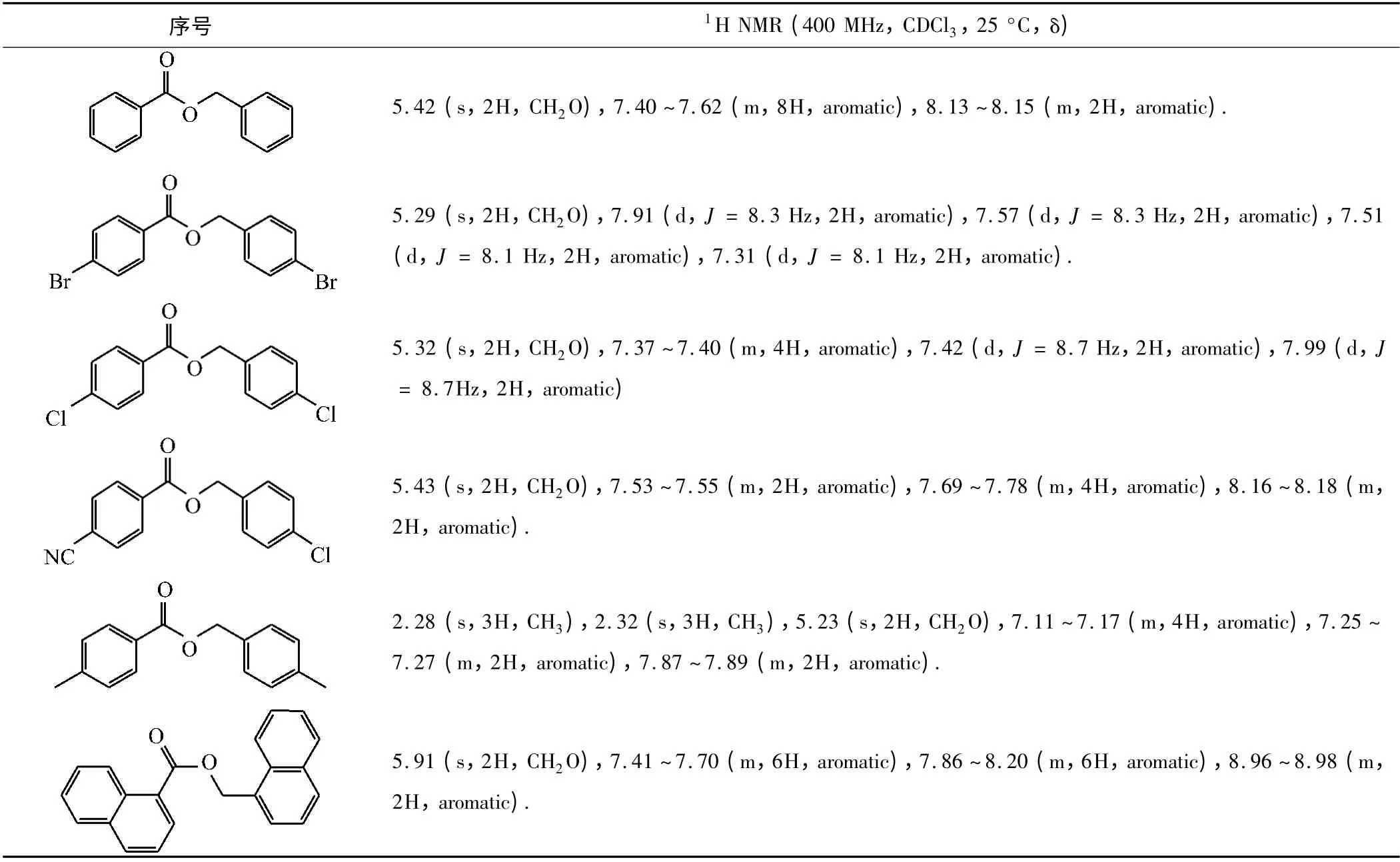
表2 Tishchenko 反应产物的表征
3 结 语
我们发现三烷基钇稀土配合物催化Tishchenko 反应有一定的活性,对某些底物效果较好,与以茂基为辅助配体的硅甲基稀土配合物相比[15],具有价格便宜而且制备简单等优点。三烷基钇配合物的催化活性比以胺基桥联双芳氧基为辅助配体的苄基稀土配合物LYR 的活性低,可能原因是由于辅助配体L 的加入,在决速步骤氢转移过程中,配体L 没有解离,使得发生氢转移的2 分子非常接近,有利于反应的进行。
[1] Zeimentz P M,Elvidge B R,Okuda J,et al. Cationic Organometallic Complexes of Scandium,Yttrium,and the Lanthanoids[J]. Chem Rev,2006,106(6):2404-2433.
[2] Crimmin M R,Barrett A G M,Hill M S,et al. Heavier Alkaline Earth Amides as Catalysts for the Tischenko Reaction[J]. Org Lett,2007,9(2):331-333.
[3] Meyer N,Roesky P W,Hessen B,et al. Synthesis and Structures of Scandium and Lutetium Benzyl Complexes[J]. Organometallics,2008,27(7):1501-1505.
[4] Bambirra S,Perazzolo F,Hessen B,et al. Strategies for the Synthesis of Lanthanum Dialkyl Complexes with Monoanionic Ancillary Ligands[J]. Organometallics,2008,27(4):704-712.
[5] Pang M L,Yao Y M,Zhang Y,et al. Synthesis,characterization of amine-bridged bis(phenolate)yttrium alkyl complex and its catalytic behavior for the Tishchenko reaction[J]. Chinese Science Bulletin,2008,53(13):1978-1982.
[6] Zimmermann M,Anwander R. Homoleptic Rare-Earth Metal Complexes Containing Ln-C σ-Bonds[J]. Chem Rev,2010,110(10):6194-6259.
[7] Ichibakase T ,Nakajima M. Direct Enantioselective Aldol-TishchenkoReactionCatalyzedbyChiralLithium Diphenylbinaphtholate[J]. Org Lett,2011,13(7):1579-1581.
[8] Harder S. Syntheses and Structures of Homoleptic Lanthanide Complexes with Chelating o-Dimethylaminobenzyl Ligands:Key Precursors in Lanthanide Chemistry[J]. Organometallics,2005,24(3):373-379.
[9] Yao Y M,Ma M T,Xu X P,et al. Synthesis,Reactivity,and Characterization of Amine Bis(phenolate)Lanthanide Complexes and Their Application in the Polymerization of ε-Caprolactone[J].Organometallics,2005,24(16):4014-4020.
[10] Gao W,Cui D M,Liu X M,et al. Rare-Earth Metal Bis(alkyl)s Supported by a Quinolinyl Anilido-Imine Ligand:Synthesis and Catalysis on Living Polymerization of ε-Caprolactone [J].Organometallics,2008,27(22):5889-5893.
[11] Xu X,Xu X Y,Chen Y F,et al. Dialkyllanthanide Complexes Containing New Tridentate Monoanionic Ligands with Nitrogen Donors[J]. Organometallics,2008,27(4):758-763.
[12] Liu B,Cui D M,Ma J,et al. Synthesis and Reactivity of Rare Earth Metal Alkyl Complexes Stabilized by Anilido Phosphinimine and Amino Phosphine Ligands[J]. Chem Eur J,2007,13:834-845.
[13] Liu X L,Shang X M,Cui D M,et al. Achiral Lanthanide Alkyl Complexes Bearing N,O Multidentate Ligands. Synthesis and Catalysis of Highly Heteroselective Ring-Opening Polymerization of rac-Lactide[J]. Organometallics,2007,26(10):2747-2757.
[14] Yang Y,Li S H,Cui D M,et al. Pyrrolide-Ligated Organoyttrium Complexes. Synthesis,Characterization,and Lactide Polymerization Behavior[J]. Organometallics,2007,26(3):671-678.
[15] Onozawat S Y,Sakakurat T,Tanaka M,et al. Lanthanoid-catalysed Tishchenko reaction of mono- or di-aldehydes[J]. Tetrahedron,1996,52(12):4291-4302.
[16] Berberich H,Roesky P W. Homoleptic lanthanide amides as homogeneous catalysts for the Tishchenko reaction[J]. Angew Chem Int Ed,1998,37(11):1569-1571.
[17] Bürgstein M R,Berberich H,Roesky P W. Homoleptic lanthanide amides as homogeneous catalysts for alkyne hydroamination and the Tishchenko reaction[J]. Chem Eur J,2001,7(14):3078-3085.
[18] Zuyls A,Roesky P W,Deacon G B,et al. Lanthanide Formamidinates as Improved Catalysts for the Tishchenko Reaction[J]. Eur J Org Chem,2008(4):693-679.

