雌激素对人皮肤成纤维细胞骨形态发生蛋白-2 mRNA表达的影响
谭 拯,李 勤,程 飚,余文林,熊 杰
皮肤是雌激素敏感器官[1],雌激素参与了皮肤的许多生理及病理过程。人类皮肤衰老与体内性激素水平降低有关[2]。成纤维细胞是皮肤皱纹形成的主要效应细胞,它的生物学特性改变决定了皮肤老化[3]。骨形态发生蛋白( bone morphogenetic proteins, BMPs)是一种酸性多肽物质,对细胞的增生和分化具有重要调节作用[4]。目前,雌激素与BMP-2 相互作用的研究主要集中在骨组织,对二者在皮肤老化方面的研究尚未见报道。本研究通过体外培养人正常皮肤成纤维细胞,观察雌激素对细胞中BMP-2 mRNA 表达的影响,探讨BMP-2 在雌激素参与的皮肤衰老过程中可能起到的作用。
1 材料与方法
1.1 材料
1.1.1 标本来源 本院整形外科门诊常规手术切除的2 例健康成年男性眼部非皱纹皮肤。
1.1.2 试剂和设备 亚甲基双丙烯酰胺(DMEM)、胎牛血清(Gibco), Dispase Ⅱ、胰蛋白酶、Triton X100(Sigma);Trizol 试剂及反转录酶试剂盒(Takala)、TaqDNA 聚合酶(Promega)、PCR 扩增仪(Biometra)。
1.2 方法
1.2.1 人皮肤成纤维细胞分离 根据文献[5,6]的方法分离人皮肤成纤维细胞(HSFB),具体操作步骤如下:①原代培养:用含青霉素和链霉素的PBS 将手术切除的正常皮肤冲洗3 次,每次约10 s,用血管钳尽量去除皮下结缔组织;其后用眼科剪将皮肤剪成小块状,真皮面朝下平铺于平皿中,加入4 %蛋白酶Ⅱ 4 ℃条件下过夜;次日分离表皮、真皮,将真皮剪切成小块,接种于培养皿中,置于37 ℃、5 %CO2恒温培养箱中培养1 h,另加入少量含20%优等胎牛血清的DMEM 培养液,次日加入足量培养基继续培养,以后每3 d 换液1 次。②传代:用0.25%胰酶、0.02%乙二胺四乙酸(EDTA)消化约1 min,在显微镜下观察细胞回缩变圆、细胞间隙增大后,加入含10%优等胎牛血清的DMEM 终止消化,用吸管吹打细胞,以1∶3 比例传代培养。③形态学观察:利用倒置相差显微镜观察细胞生长情况及形态变化。第3 ~6 代细胞用于正式实验。实验共分两组,对照组(加入PBS)和雌激素处理组。分别取不同代数的HSFB 做实验,每代取3 皿细胞作为重复实验。雌激素处理组在培养基中加入1×10-6mol/L 17-β-雌二醇刺激24 h后与对照组培养基同时提取RNA。
1.2.2 引物设计与合成 引物设计与合成参考文献[7],BMP-2 基因引物序列由上海英骏生物技术有限公司合成,其上游序列为5’-CACCGACCCGTCAGCT-3’,下游序列为5’-ATGAATTCGGTTGACCAAT-3’。扩增目的基因片段长度532 bp;GAPDH 上游序列为5’-ATGGCGGGCCAATAAATT-3’,下游序列为5’-CCATAAGGGAACGGACGT-3’。扩增目的基因片段长度为178 bp。
1.2.3 细胞总RNA 提取 灭酶EP 管收集细胞上清保存备用,用冷PBS 冲洗细胞2 次;加入 1 ml Trizol,吹打细胞至液体澄清(生化:摇动混匀后室温孵育10 min);将裂解液转移至1.5 ml 灭酶EP 管中,加入氯仿0.2 ml(1/5 Trizol 体积),剧烈震摇15 s,置室温5 min;4 ℃、12 000×g(相对离心力12 300)离心15 min;小心收集上层水相约0.5 ml 置于另一1.5 ml 灭酶EP 管中;加入0.5 ml 异丙醇,用力摇匀,置室温10 min;4 ℃、12 000×g 离心10 min,可见RNA 沉淀。倒弃上清,用滤纸吸干管口余液,加入预冷的75%灭酶异醇1 ml,用指轻弹管壁使 RNA 沉淀飘起。4 ℃、7 500×g(相对离心力7 700)离心5 min,沉淀即为总RNA;弃上清,真空干燥约4 min 或空气中干燥5 ~10 min,加入20 µl(30 µl)DEPC 水。56 ℃水浴<10 min 助溶,取少量测A 值,其余-70℃保存备用。
1.2.4 反转录cDNA ①在0.5 ml 微量离心管中,加入总RNA 1 ~5 μg,补充适量的去离子水使总体积达11 μl。在管中加10 μmol/L T 重复寡核苷酸[Oligo(dT)]12 ~18 μl,轻轻混匀,离心。②70 ℃加热10 min,立即将微量离心管插入冰浴中至少1 min。再加入下列试剂的混合物:10×PCR buffer 2 μl、25 mmol/L MgCl22 μl、10 mmol/L dNTP mix 1 μl、0.1 mol/L DTT 2 μl,轻轻混匀,离心。42 ℃孵育2 ~5 min。③加入Superscript Ⅱ1 μl ,在42 ℃水浴中孵育50 min。④于70 ℃加热15 min 终止反应。⑤加入RNase H 1 μl,37 ℃孵育20 min,降解残留的RNA。-20 ℃保存备用。
1.2.5 RT-PCR PCR 总反应体系为25 μl,其中模板量为2 μl,引物浓度为0.5 μmol/L、0.1 mmol/L dNTP、1.25 U Taq 聚合酶和1×PCR 缓冲液。共循环数40次,其中BMP-2 每一循环包括:94 ℃ 1 min,58 ℃ 1 min 和68 ℃ 1 min; 3-磷酸甘油醛脱氢酶(GAPDH)反应条件同BMP-2。
1.2.6 凝胶电泳 PCR 产物在2%琼脂糖凝胶中电泳分析结果。凝胶成像分析系统(GSD-7500,美国)对PCR 扩增条带进行图像扫描,测吸光度值,用BMP-2与GAPDH 的比值表示BMP-2 mRNA 的相对含量。
1.2.7 流式细胞仪检测雌激素、BMP-2 对成纤维细胞周期的影响 将第3 代培养细胞常规消化,用培养液调整细胞密度为1×108/L,接种于6 孔培养板, 每孔2 ml 培养24 h。该实验总共分3 组,对照组、雌激素组和BMP-2 组,分别取第3 代后不同代数的培养细胞共3 代,每代细胞取3 皿细胞作重复实验。用70%乙醇将17-β-雌二醇稀释成1×10-6mol/L,分别取2 μl 加入含2 ml 培养基的培养板内。对照组采用PBS 替代,而BMP-2 组BMP-2 浓度根据文献研究采取0.4 μg/ml。继续培养至倒置显微镜下观察细胞生长接近80% 后终止培养,常规胰酶消化、PBS 洗涤、75%冷乙醇固定后,在流式细胞仪(Elite,贝克曼库尔特公司,美国)上检测各雌激素浓度组的细胞周期时相细胞比。
1.3 统计学方法
利用SPSS13.0 统计软件对数据进行分析,数据以均数±标准差表示,两组间比较采用配对t 检验,多组间比较采用Oneway ANOVA 方法进行,P <0.05表示差异具有统计学意义。
2 结果
2.1 HSFB原代培养
显微镜下观察成纤维细胞生长良好,为长梭形。
2.2 不同刺激组HSFB的周期分布
成纤维细胞在浓度为1×10-6mol/L 的17-β-雌二醇和0.4 μg/ml 的BMP-2 作用下,处于S 期的细胞百分数明显上升,增生指数与对照组相比差异均有统计学意义(P <0.01);雌激素处理组处于S 期的细胞百分数也较BMP-2 组增加(P <0.05)(表1)。
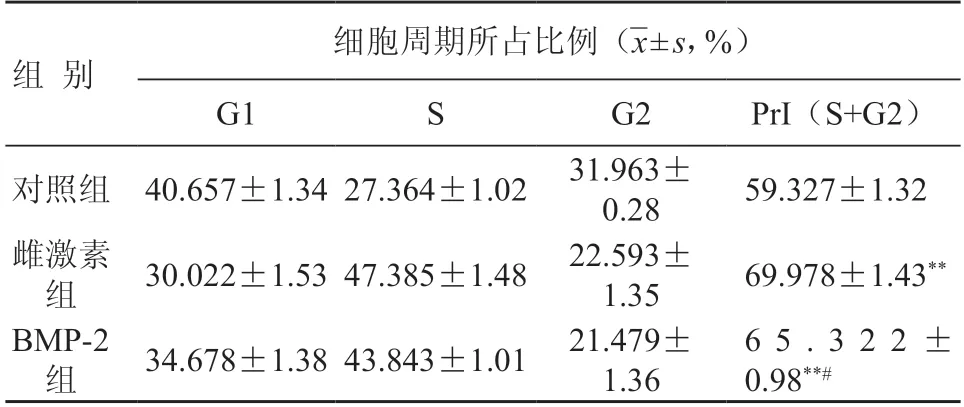
表1 不同刺激组HSFB的周期分布
2.3 PCR产物和琼脂糖凝胶电泳结果
PCR 产物和琼脂糖凝胶电泳结果见图1,产物片段大小与待扩增的基因片段长度相一致。雌激素组BMP-2 mRNA 相对值为8.43±0.43,而对照组BMP-2 mRNA 相对值为4.65±0.32,两组相比差异有统计学意义(P <0.01)。

图1 BMP-2和GAPDH基因产物PCR扩增图
3 讨论
皮肤衰老主要表现为皮肤的胶原纤维和基质结构以及代谢发生改变,出现胶原交联、溶解性下降、脂褐素堆积、血管弹性下降,从而发生皮肤松弛变薄、色斑产生等一系列变化。皮肤衰老受年龄、外部环境及体内激素水平的影响[8]。皮肤是一个雌激素敏感器官[1],雌激素参与了皮肤的许多生理及病理过程,人类皮肤衰老与体内性激素水平降低有关,但二者间的内在联系和机制目前尚不十分清楚。有研究表明,雌激素可通过成纤维细胞上的受体直接调控该细胞的增生,提高其活性,增加胶原含量[7,9,10]。另外,通过皮肤上的雌激素受体,雌激素也可以刺激角质形成细胞增生,增加和保持真皮中的胶原蛋白,减少基质金属蛋白酶(MMP)的表达,增加真皮中黏多糖和透明质酸的含量[11],从而保持皮肤厚度、弹性及水分,并保证角质层的屏障功能。
BMPs 属于TGF -β 超家族,在胚胎发生和发育、组织与细胞的分化和增生等方面起重要作用[4]。研究表明,雌激素可以上调成骨细胞系MN7 细胞BMP-2 mRNA 的表达[12,13]。
雌激素对HSFB 增生的影响与其浓度有关。周武等[14]发现,雌激素的浓度为1×10-6~1×10-10mol/L时,可明显促进HSFB 的增生;但雌激素浓度>10-6mol/ L 时,其对细胞增生有抑制作用,浓度< 1×10-12mol/ L 时,对细胞增生无影响。与雌激素相同,BMP-2 对HSFB 增生的影响也与浓度有关。邓廉夫等[15]发现,BMP-2 浓度在0.4 μg/ml 时成纤维细胞增生迅速,因此本实验选取该浓度进行实验。我们发现,用雌二醇和BMP-2 刺激培养细胞后,处于S 期的细胞百分数明显上升,其中雌激素组高于BMP-2组。该结果表明,雌激素与BMP-2 均可促进HSFB增生。另雌激素刺激后,培养细胞BMP-2 mRNA 表达增加,表明雌激素刺激可有效增加细胞BMP-2 表达,而BMP-2 表达增加可促进HSFB 增生。因此,本研究推测,BMP-2 有可能是雌激素刺激后的一个下游分子,雌激素有可能通过BMP-2 上调成纤维细胞活性,促进成纤维细胞增生及增加胶原含量,从而成为延缓由于激素缺乏引起的皮肤衰老的重要机制之一。但因目前尚未见对于雌激素、BMP-2 及皮肤相关性研究,未来实验研究应集中在雌激素刺激成纤维细胞后BMP-2 表达、BMP-2 下游通路及BMP-2 下游通路激活后成纤维细胞生物学效应的改变等方面。
[1] Emmerson E, Hardman MJ. The role of estrogen deficiency in skin ageing and wound healing [J]. Biogerontology, 2012, 13(1): 3-20.
[2] Sumino H, Ichikawa S, Abe M, et al. Effects of aging and postmenopausal hypoestrogenism on skin elasticity and bone mineral density in Japanese women [J]. Endocr J, 2004, 51(2): 159-164.
[3] 王曦. 成纤维细胞与皮肤老化 [J]. 中国美容医学, 2005, 14(2) : 243-245.
[4] Conway SJ, Doetschman T, Azhar M. The inter-relationship of periostin, TGF beta, and BMP in heart valve development and valvular heart diseases [J]. Scientific World Journal, 2011, 11:1509-1524.
[5] 马英智, 张丽红, 孙梅, 等. 人真皮成纤维细胞的分离培养及鉴定 [J]. 中国老年学杂志, 2009, 29(16):2005-2007.
[6] 赵利媛. 几种药物对体外培养人成纤维细胞MMP-1、MMP-12及LOX基因表达的影响 [D]. 天津: 天津医科大学, 2010:18-20.
[7] Shu YY, Maibach HI. Estrogen and skin: therapeutic options [J]. Am J Clin Dermatol, 2011, 12(5):297-311.
[8] Venable ME, Obeid LM. Phospholipase D in cellular senescence [J]. Biochim Biophys Acta, 1999, 1439(2):291-298.
[9] Shah MG, Maibach HI. Estrogen and skin. An overview [J]. Am J Clin Dermatol, 2001, 2(3):143-150.
[10] Stevenson S, Thornton J. Effect of estrogens on skin aging and the potential role of SERMs [J]. Clin Interv Aging, 2007, 2(3):283-297.
[11] Son ED, Lee JY, Lee S, et al. Topical application of 17betaestradiol increases extracellular matrix protein synthesis by stimulating tgf-Beta signaling in aged human skin in vivo [J]. J Invest Dermatol, 2005, 124(6):1149-1161.
[12] Peres JA, Lamano T. Strategies for stimulation of new bone formation: a critical review [J]. Braz Dent J, 2011, 22(6):443-448.
[13] Lissenberg-Thunnissen SN, de Gorter DJ, Sier CF, et al. Use and efficacy of bone morphogenetic proteins in fracture healing [J]. Int Orthop, 2011, 35(9):1271-1280.
[14] 周武, 盛晚香, 吴剑波, 等. 雌激素对人正常皮肤成纤维细胞的影响 [J]. 武汉大学学报(医学版), 2008, 29(2):202-205.
[15] 邓廉夫, 汤雪明, 柴本甫, 等. 肿瘤坏死因子-α和骨形成发生蛋白2诱导成纤维细胞成骨表型表达的体外研究 [J]. 中国修复重建外科杂志, 1998, 12(4):236-240.

