高效液相色谱-荧光检测法同时测定体外循环下狗血浆中的阿曲库铵和劳丹碱
杨莹莹,陈媚,邝毓姗,叶利明,张文胜
(1.山西省医药与生命科学研究院,山西太原 030006;2.石家庄制药集团欧意药业有限公司,河北石家庄 050051;3.四川大学华西药学院,四川成都 610041;4.四川大学华西医院转化神经科学中心麻醉与危重急救研究室,四川成都 610041)
苯磺酸阿曲库铵(atracurium besilate)是一种新型中等时效的非去极化肌松药,为苯肼异喹啉类化合物,主要用于各种手术麻醉时维持骨骼肌的松弛或控制呼吸,尤其适用于插管时或剖宫产术时肌肉松弛的维持[1];由于阿曲库铵起效快,作用时间短,不因病人肝肾功能的损害而改变药物的作用时间,因而得到国内各大医院的广泛使用。苯磺酸阿曲库铵有顺-顺、顺-反、反-反3种立体异构体,3种异构体均有很强的肌肉神经阻断作用,但作用程度有所差别。临床上常用的有注射用苯磺酸阿曲库铵、注射用顺苯磺酸阿曲库铵,其中注射用苯磺酸阿曲库铵为3种异构体的混合物,三者的相对含量分别为55.0%~60.0%、34.5%~38.5%及5.0%~6.5%[2];注射用顺苯磺酸阿曲库铵,为顺式旋光异构体,肌松强度为阿曲库铵的3倍左右,近几年得到了较广泛的应用。在阿曲库铵药代动力学研究中,常需测定阿曲库铵的血药浓度,以指导临床用药。因此建立灵敏、快速地测定阿曲库铵血药浓度的方法有重要的意义。另外,阿曲库铵在生理pH 值及碱性条件下易发生霍夫曼清除,其主要降解产物为劳丹碱。劳丹碱呈脂溶性,比阿曲库铵更容易穿越血脑屏障,具有诱发惊厥的作用。惊厥可导致呼吸、心搏骤停及不同程度的中枢神经系统并发症,如果处理不当,可导致昏迷甚至死亡。因此在麻醉手术中对劳丹碱进行药物浓度的监测对阿曲库铵的合理用药具有一定的指导意义。
目前国外有采用液相色谱-荧光检测法[3-5]或质谱法[6-8]测定血浆中阿曲库铵及其代谢产物劳丹碱的报道;国内关于血浆中阿曲库铵的测定多为液相色谱-紫外法[9]或荧光法[10-12],而关于劳丹碱的检测未见报道。本研究以注射用苯磺酸阿曲库铵为研究对象,建立了高效液相色谱-荧光检测(HPLCFLD)测定狗血浆中阿曲库铵和劳丹碱浓度的方法。该方法可将3种异构体良好分离,方法的选择性好、灵敏度高、重复性好,已应用于体外循环下狗体内阿曲库铵的药代动力学研究及劳丹碱的血药浓度监测,能较好地满足要求。此外,本研究还利用该方法对注射用顺苯磺酸阿曲库铵进行了考察,该方法亦可用于注射用顺苯磺酸阿曲库铵的体内分析。
1 实验部分
1.1 仪器
Waters 2695型高效液相色谱仪,配Waters 2475型荧光检测器(美国Waters 公司);Biofuge Primo 高速离心机(德国Kendro 公司);MSI Minishake 旋涡混合器(德国IKA 公司);ME215S 电子天平(德国Sartorius 公司);Milli-Q 纯水机(美国Millipore 公司)。
1.2 药品与试剂
阿曲库铵苯磺酸盐对照品(纯度98.2%,江苏恒瑞医药股份有限公司);劳丹碱对照品(纯度99%,美国Sigma 公司);注射用苯磺酸阿曲库铵、注射用顺苯磺酸阿曲库铵(江苏恒瑞医药股份有限公司);盐酸维拉帕米注射剂(内标,上海禾丰制药有限公司);二氯甲烷、甲醇、乙腈(色谱纯,美国Tedia 公司);K2HPO4、NaOH、NaH2PO4、H3PO4均为国产分析纯;实验用水为去离子纯化水。
1.3 溶液的配制
阿曲库铵标准储备液:精密称取阿曲库铵苯磺酸盐对照品10 mg,置于10 mL 容量瓶中,以0.1 mmol/L 盐酸溶液溶解并稀释至刻度,得1.0 g/L的标准储备液,于4℃下保存备用。
劳丹碱标准储备液:精密称取劳丹碱对照品10 mg,置于10 mL 容量瓶中,以0.1 mmol/L 盐酸溶液溶解并稀释至刻度,得1.0 g/L的标准储备液,于4℃下保存备用。
内标溶液:精密量取维拉帕米注射剂适量,用水稀释至10 mg/L 作内标溶液,于4℃下保存备用。
1.4 色谱条件
色谱柱:Agilent Eclipse Plus C18柱(150 mm ×4.6 mm,5μm);柱温:25℃;流动相:0.03 mol/L 磷酸氢二钾(用磷酸调pH 值至5.0)-乙腈(72∶28,v/v),以0.45μm 微孔滤膜过滤;流速:1.0 mL/min;荧光检测波长:激发波长(λEx)为240 nm,发射波长(λEm)为320 nm;进样量:20μL。
1.5 样品预处理
取肝素抗凝的狗全血2 mL,采血管中提前加入2 mol/L 硫酸40μL(使血浆的pH 值约为4.0),防止药物降解,于3500 r/min 下离心10 min 后,取血浆约1 mL,于-20℃下保存备用。
取上述血浆样品0.2 mL 于离心管中,加入内标溶液50μL,混匀,然后加1 mol/L NaH2PO4(pH 5.5)0.5 mL,混匀后加1 mL 二氯甲烷,混旋萃取5 min,于3500 r/min 下离心5 min,取下层有机相于另一离心管中,室温下用氮气流吹干;残渣用200μL 流动相溶解,取20μL 进样测定。
1.6 定性与定量
在相同的条件下,将样品色谱图与阿曲库铵和劳丹碱标准溶液的色谱图对照,根据保留时间确定样品中各组分的色谱峰;由于注射用阿曲库铵中反-反异构体和顺-反异构体含量较低,且3种异构体的含量比例一定,故测定时以顺-顺阿曲库铵的峰面积计算。在标准溶液与样品进样量相同的情况下,应用内标法定量,计算样品中各物质的含量。比例及缓冲盐的pH 值进行优化,最终选用1.4节中的色谱条件,各峰峰形和分离情况均较好,且不受内源性杂质的干扰。图1为空白血浆、空白血浆中添加对照品以及含药血浆样品的HPLC-FLD 谱图,由此可见,血浆中内源性物质不干扰阿曲库铵及劳丹碱的测定。劳丹碱、顺-顺阿曲库铵和维拉帕米的保留时间分别为2.8、12.7和21.2 min。

图1 (a)空白血浆、(b)空白血浆添加对照品和(c)含药血浆样品的HPLC-FLD 谱图Fig.1 Chromatograms of(a)a blank plasma sample,(b)a blank plasma sample spiked with standards and(c)a plasma sample with the drugs
2 结果与讨论
2.1 样品制备方法的选择
由于阿曲库铵在生理温度及pH 值条件下稳定性较差,进入生物体后很快会发生霍夫曼消除,降解为劳丹碱,故采血管内必须提前加入硫酸,使血样呈酸性,防止采血后阿曲库铵继续降解。文献报道的样品制备方法有固相萃取[3,7]、蛋白质沉淀[4,10]、液-液萃取[6,9]等方法,但固相萃取法操作复杂而且成本较高,故本研究考察了蛋白质沉淀、液-液萃取两种提取方法。研究发现蛋白质沉淀方法虽操作简单,但该方法需将样品稀释,阿曲库铵的检出限勉强可以满足实验要求,但劳丹碱的检出限却无法满足需要。本文采用液-液萃取法,考察了不同有机溶剂、溶剂体积以及提取时间对待测物提取效率的影响,最后选用提取效率高的二氯甲烷为提取溶剂,并浓缩提取液。该提取方法成本低、操作简便且灵敏度高,可以满足样品测定需求。
2.2 pH 值对样品提取回收率的影响
肌肉松弛药属弱碱性胺类,通常以盐形式存在,在萃取过程中缓冲液的pH 值对药物的提取回收率有较大的影响。文献[5-7]采用pH 为5.0、5.4、6.0的缓冲试剂。本文考察比较了pH 值为4.5、5.0、5.5、6.0的缓冲液对待测物回收率的影响,结果显示pH 为5.5时阿曲库铵的提取效率最高,故选用pH 5.5的NaH2PO4溶液(1 mol/L)为提取缓冲液。
2.3 荧光激发波长和发射波长的选择
以流动相为空白调零,取1.0 g/L 阿曲库铵标准溶液进样,采用手动停流技术,在荧光检测器上通过对阿曲库铵的激发光谱(200~450 nm)和发射光谱(250~650 nm)扫描,分别得到最大激发波长240 nm和最大发射波长320 nm。
2.4 色谱条件的选择
文献[11]报道测定顺阿曲库铵时流动相采用0.05 mol/L 磷酸二氢钾(pH 3.0)-乙腈(50∶50,v/v),由于顺阿曲库铵中不含其他异构体,色谱峰较易分离,故分析时间较短。但是在上述条件下无法达到阿曲库铵中3种异构体的分离,故对流动相的
2.5 线性范围和检出限
取空白狗血浆0.2 mL,分别加内标液50μL,加1 mol/L NaH2PO4(pH 5.5)0.5 mL,加入阿曲库铵和劳丹碱的标准储备液配制成含阿曲库铵25、50、100、250、1000、2500、5000μg/L 以及含劳丹碱25、50、100、500、1500、3000、6000μg/L的含药血浆,按1.5节中血浆样品处理方法处理后进样,分别测得阿曲库铵、劳丹碱和内标的峰面积。以待测物的质量浓度(x,μg/L)为横坐标,分别以顺-顺阿曲库铵对内标的峰面积比(y)、劳丹碱对内标的峰面积比(y)为纵坐标进行线性回归,得到阿曲库铵血药浓度的回归方程为y=0.0023x -0.0768,线性范围为25~5000μg/L,r=0.9990;劳丹碱的回归方程为y=0.0023x +0.0022,线性范围为25~6000μg/L,r=0.9984。以信噪比为3计阿曲库铵和劳丹碱的检出限分别为3μg/L和1μg/L。
2.6 精密度和回收率
取空白狗血浆0.2 mL,分别配制低、中、高3个质量浓度的质控(QC)样品,使阿曲库铵含量分别为50、250、2500μg/L 以及劳丹碱含量分别为50、500、3000μg/L;QC 样品每一浓度水平配制6份,按1.5节样品处理方法操作,以当日的标准曲线计算样品的浓度得日内精密度;连续测定5 d,每日测定1次,得到日间精密度。对QC 样品进行测定后,各组样品峰面积与内标峰面积之比代入当日标准曲线回归方程计算质量浓度,与加入浓度比较得方法的回收率,用以表示分析的准确度,结果见表1。由表1可见,日内、日间精密度良好,方法的回收率在92.1%~109.5%之间。

表1 空白狗血浆中阿曲库铵和劳丹碱的加标回收率和精密度Table 1 Recoveries and precisions(RSD)of atracurium and laudanosine spiked in a blank dog plasma sample
2.7 稳定性
配制含阿曲库铵低、中、高3个浓度的QC 样品,每个浓度水平平行配制3份样品,分别考察各浓度样品在-20℃冰箱中保存14 d、室温下放置7 h、反复冻融3次及按1.5节处理后室温下放置12 h后阿曲库铵的稳定性。结果表明,样品中阿曲库铵在上述条件下稳定性良好,各组的RSD均小于10%,方法的回收率在87.8%~111.5%之间(见表2)。
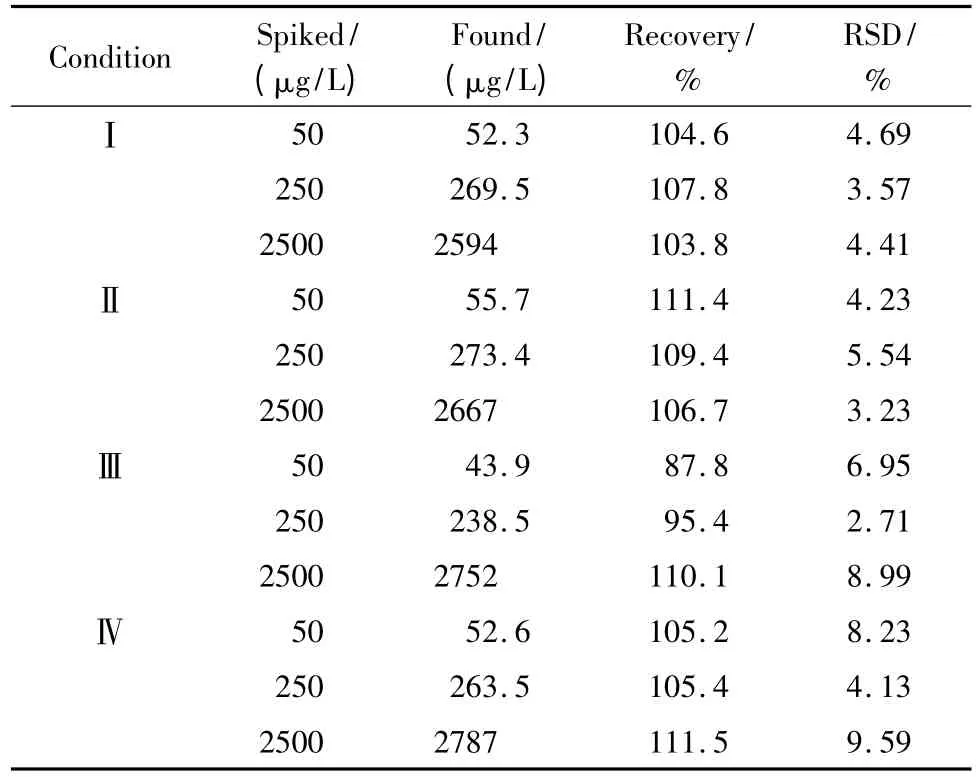
表2 不同条件下狗血浆中阿曲库铵的稳定性(n=3)Table 2 Stability of atracurium spiked in dog plasma stored under various conditions(n=3)
2.8 在体外循环实验中的应用
健康狼狗5只,雌雄不分,体重17~23 kg,以2.5%戊巴比妥钠基础麻醉,气管插管后进行体外循环,注射用苯磺酸阿曲库铵以0.8 mg/kg 剂量股静脉注射。分别在给药前和给药后1、3、5、7、10、15、30、45、60、90、120和150 min 时股动脉取血约2 mL(采血管中提前加入2 mol/L 硫酸40μL,防止药物降解),于3500 r/min 下离心5 min 后取血浆约1 mL,按照1.5节操作测定血药浓度,测得阿曲库铵和劳丹碱的平均血药浓度-时间曲线(见图2)。通过血药浓度-时间曲线的数学模型分析,可以得到阿曲库铵和劳丹碱的药动学参数,通过与非体外循环条件下药动学参数的比较,可以制定出适合体外循环下麻醉手术的个体化给药方案,以指导临床合理用药;通过劳丹碱的血药浓度监测可以降低手术中患者突发惊厥的可能性,为临床安全用药提供参考。

图2 体外循环下狗血浆中阿曲库铵和劳丹碱的平均血药浓度-时间曲线Fig.2 Mean concentration-time curves of atracurium and laudanosine in dog plasma during cardiopulmonary bypass
2.9 顺苯磺酸阿曲库铵的初步考察
由于缺乏顺苯磺酸阿曲库铵对照品,故采用注射用顺苯磺酸阿曲库铵进行初步考察。取空白狗血浆0.2 mL,加入内标液50μL、1 mol/L NaH2PO4(pH 5.5)0.5 mL、顺苯磺酸阿曲库铵溶液和劳丹碱标准液适量,配制成顺阿曲库铵约250μg/L 及劳丹碱约100μg/L的含药血浆,按1.5节中血浆样品处理方法处理后进样分析。在优化的色谱条件下,顺苯磺酸阿曲库铵与内标均可得到良好的分离,内源性物质对其测定没有干扰(见图3)。由此可见本方法也可用于顺苯磺酸阿曲库铵的血浆样品分析。由于样品成分减少,分析顺苯磺酸阿曲库铵时可适当调整流动相比例,使出峰时间提前,以节省分析时间,提高工作效率。

图3 添加顺阿曲库铵及劳丹碱的空白血浆的色谱图Fig.3 Chromatogram of a blank plasma sample spiked with cis-atracurium and laudanosine
3 结论
本研究建立了同时测定体外循环狗血浆中阿曲库铵和劳丹碱的高效液相色谱-荧光检测分析方法,通过方法学验证和实际应用,证明该方法具有灵敏度高、重复性好、操作简便、快速、准确等优点,适用于临床前阿曲库铵和劳丹碱的血药浓度测定及其药代动力学研究,同时为其临床药代动力学、药效学研究提供了参考。
[1]Zhao J.New Anesthesiology.Beijing:People’s Military Medical Press(赵俊.新编麻醉学.北京:人民军医出版社),2000:363
[2]British Pharmacopoeia Commission.British Pharmacopoeia 2009(Volume I & II).London:The Stationery Office,2008:5
[3]Schopfer C,Benakis A.J Chromatogr B,1990,526:223
[4]Christine F,Michel A,Jean Y L,et al.J Chromatogr B,1999,724:117
[5]Tassonyi E,Fathi M,Hughes G J,et al.Acta Anaesthesiol Scand,2002,46:1236
[6]Cirimelea V,Villaina M,Pepinb G,et al.J Chromatogr B,2003,789:107
[7]Marinah M A,Robert A A.J Chromatogr B,2006,842:91
[8]Agata B,Zbigniew F,Malgorzata W G,et al.J Chromatogr A,2010,1217:1266
[9]Yan K L,Zhao L,Zhu X Q,et al.Chinese Journal of Pharmaceutical Analysis(阎克里,赵丽,朱秀卿,等.药物分析杂志),2009,29(8):1348
[10]Zhou D L,Zhong L,Qiu Y C,et al.Journal of Chongqing Medical University(周定利,钟玲,邱妍川,等.重庆医科大学学报),2008,33(6):724
[11]Li J,Chen B,Yang W H,et al.Chinese Journal of Pharmaceutical Analysis(李娟,陈冰,杨婉花,等.药物分析杂志),2011,31(4):713
[12]Sun W Q,Mo L Q,Qin Y,et al.Chinese Pharmacological Bulletin(孙文琴,莫利求,秦莹,等.中国药理学通报),2011,27(5):712

