辽东栎SSR 反应程序和反应体系的优化
康峰峰,秦英英,韩海荣
(北京林业大学省部共建森林培育与保护重点实验室,北京 100083)
辽东栎是一种具有重要的生态价值和经济价值的树种[1,2]。它主要分布在黑龙江、吉林、辽宁、内蒙古、河北、山西、陕西、宁夏、甘肃、青海、山东、河南等省区。辽东栎在辽宁半岛常常生长于低山丘陵区,在华北地区则常生于海拔600 m~1 900 m的山地,而在陕西省和四川北部可达海拔2 200 m~2 500 m,常生于阳坡和半阳坡,成小片纯林或混交林。另外,辽东栎在朝鲜北部也有分布[2]。为了更好地进行辽东栎的保护和利用,近年来针对辽东栎抗性、空间格局和生理生态等方面的研究很多[3~11],但对其进行的遗传多样性方面的分析则较少[12,13],SSR 分子标记则是进行遗传多样性分析的一个非常好的方法之一。SSR是一种由2 到5个核苷酸位单位多次串联重复的核苷酸序列,长达几十或者几百个核苷酸[14]。SSR 广泛分布于真核生物基因组,在每个座位的重复数量可能并不完全相同,从而产生多态性[15]。SSR 分子标记在植物中的应用非常的广泛,,如在水稻[16]、玉米[17]、大豆[18]、小麦[19]、桑树[20]等植物中都有很多的应用,不过在辽东栎方面,尚未有人用SSR 做过相关的研究。而SSR 标记的反应体系在应用于不同的物种时会有一定的差异,因此,在对辽东栎群体进行SSR 分析之前,建立一个适合于辽东栎的SSR 反应体系是非常必要的。
1 材料和方法
1.1 材料
进行辽东栎SSR 反应体系优化的辽东栎叶片来自于山西省灵空山的辽东栎群体,随机选取3个健康的辽东栎个体作为优化的材料,用变色硅胶迅速干燥。采样时间为2010年5月。用于优化的SSR 引物序列为GCTCCCTGGTAGTCGGCTAAAGA、CAATTGGGACAACATGGAAGCAT。
1.2 DNA 提取
虽然SSR 反应对DNA 质量的要求不高,但是DNA 的质量还是会影响反应的结果。为了保证提取的DNA 的质量,使用DNA 提取试剂盒从干燥的辽东栎叶片中提取总DNA,提取好的DNA 用1%的琼脂糖凝胶电泳检测其质量,用紫外分光核酸测定仪检测其浓度,然后定量。
1.3 PCR 反应程序和反应体系的优化
PCR 反应在美国ABI Veriti 96 孔快速梯度PCR仪上完成,所用试剂全部来自TaKaRa(大连)有限公司,引物合成公司为英潍捷基(上海)贸易有限公司合成。聚丙烯酰胺凝胶电泳所使用的电泳仪为Biorad 高压电泳仪HV-5056,电泳槽为Bio-Rad Sequi-Gen GT System,规格为38 cm×50 cm。
在Ueno 等人所提供的反应体系[21]的基础上进行优化,使用的反应程序为Ueno 等人所提供的反应程序[21]。由于Ueno 等人所用的反应总体积为8 μL,而反应体积过小容易造成实验误差,故而实验采用的反应体积为SSR-PCR 常用的20 μL。实验采用单因素法对DNA 浓度、dNTP 浓度、引物浓度、Taq酶用量等因素进行了优化,所使用的10×Buffer(Mg2 +Plus)均为2 μL(体系优化时所使用引物为PL109-110),实验结果用1.5%的琼脂糖凝胶电泳进行检测,每个反应重复两遍。所设置的反应体系优化梯度如表1、2、3、4 所示。

表1 DNA 单因素优化Table 1 The single factor optimization of the DNA's concentration

表2 dNTP Mixture 单因素优化Table 2 The single factor optimization of the dNTP's concentration
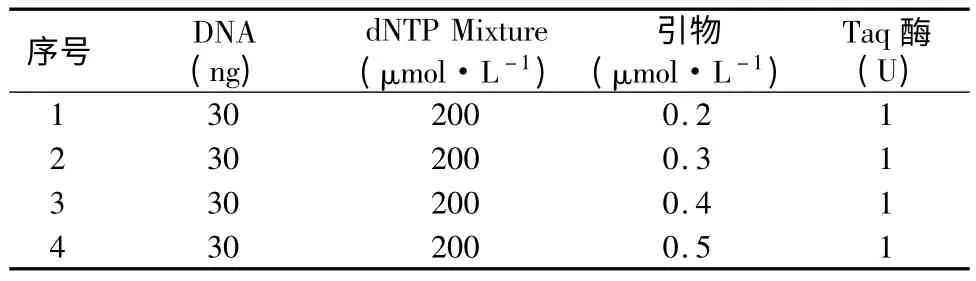
表3 引物单因素优化Table 3 The single factor optimization of the Prime's concentration

表4 Taq 酶单因素优化Table 4 The single factor optimization of the Taq polymerase's concentration
1.4 反应程序的优化
使用优化后的反应体系来进行反应程序的优化,主要针对反映的循环程序进行初步的优化,分别使用30、33、35、37、40个循环作为反映的循环次数。
1.5 结果检测
使用1.5%的琼脂糖凝胶电泳进行检测,每个反应重复两遍。
2 结果与分析
由图1(从左到右DNA 浓度分别为10 ng、20 ng、30 ng、40 ng)可以看出,当DNA 浓度为10 ng 的时候,看不到明显的扩增产物,仅有引物二聚体的产生,浓度为20 ng、30 ng 和40 ng 时,均可以看到明显的扩增条带,但是相比之下,DNA 浓度为30 ng 时得到的产物条带更细更亮,浓度为40 ng 的条带后则有模糊的引物二聚体条带,故而选择的DNA 最优浓度为30 ng。
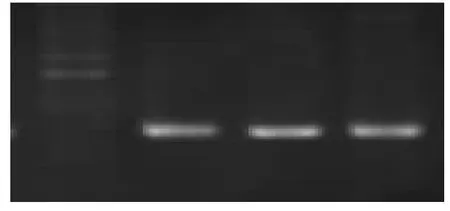
图1 DNA 优化结果图Fig.1 The result of the DNA optimization
从图2(从左到右dNTP 浓度分别为100 μmol·L-1、150 μmol·L-1、200 μmol·L-1、250 μmol·L-1)得知,dNTP 浓度的变化对SSR-PCR 扩增反应的影响并不是很大,但是当其浓度过大或者过小时都会造成SSR-PCR 的产物量的减少。从图2 中可以看出,dNTP 浓度为100 μmol·L-1和浓度为250 μmol·L-1时,产物的量要更少,浓度为150 μmol·L-1和200 μmol·L-1时得到的条带比较清晰,且清晰度相似。为了节约试剂,故而选取dNTP 的浓度为150 μmol·L-1为最佳浓度。
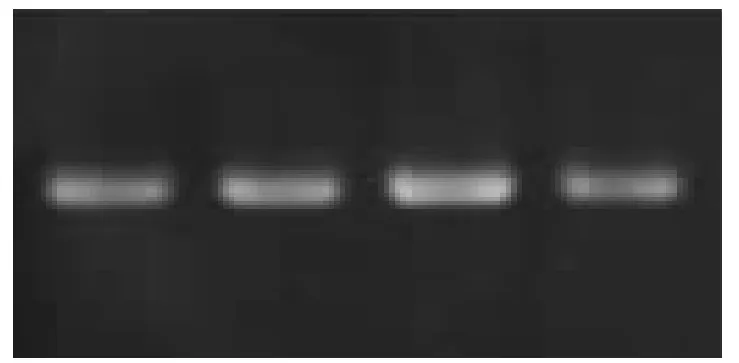
图2 dNTP 浓度优化结果图Fig.2 The result of the dNTP concentration optimization
从图3(从左到右引物浓度为0.2 μmol·L-1、0.3 μmol·L-1、0.4 μmol·L-1、0.5 μmol·L-1)中可以看出,引物浓度过低时得到的产物条带非常的不明显,但对于辽东栎来讲,引物PL109-110 的浓度在0.3 μmol·L-1、0.4 μmol·L-1和0.5 μmol·L-1时得到的条带的量和清晰度都相似,均没有引物二聚体的产生,故而选择引物浓度为0.3 μmol·L-1为最佳反应浓度。
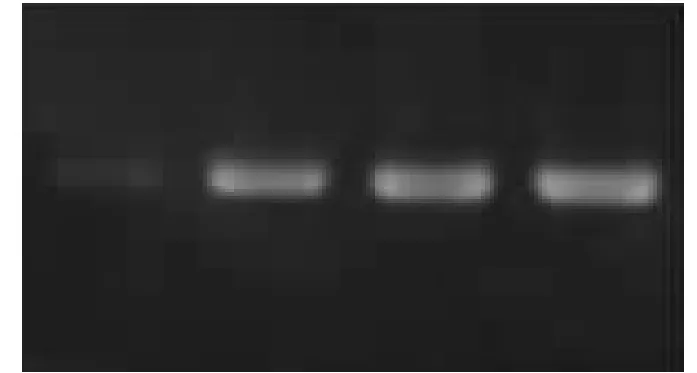
图3 引物浓度优化结果图Fig.3 The result of the Primer concentration optimization
图4 中Taq 酶的浓度从左至右为0.5 U、1 U、1.5 U、2 U,当Taq 酶浓度为0.5 U 时,无扩增产物的产生,说明这个浓度过小,而Taq 酶浓度为1U、1.5U、2U 时可以得到清晰、细亮的条带,但随着Taq酶浓度的升高,拖尾现象有越来越严重的趋势。这也说明辽东栎的SSR-PCR 反应体系所需的酶浓度较低,当酶浓度为1U 时足以满足反应的需求。
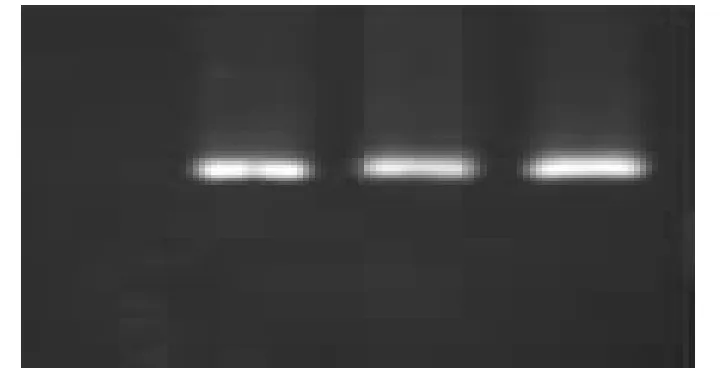
图4 Taq 酶浓度优化结果图Fig.4 The result of the Taq polymerase concentration optimization
另外,实验结果表明,33个循环所得到的条带数更为清晰,更容易识别。最终确定的反应程序如下:

3 讨论
优化后得到的最终辽东栎SSR 反应体系为30 ngDNA 模板,2 μL10×Buffer(Mg2 +Plus),150 μmol·L-1dNTP Mixture,0.3 μmol·L-1上下游引物,1 U(5 u·μL-1)Taq 酶,反应总体积为20 μL。最终确定的反应程序的循环数为33个循环。
SSR-PCR 的影响因素有很多,DNA 纯度、反应程序、循环数、DNA 浓度、dNTP 浓度、引物浓度、Taq酶浓度、退火温度等均可以对其结果产生较大的影响。在进行大批量的SSR 扩增反应之前需要对其进行反应程序和反应体系的优化,特别是对于之前没有先例的,更需要针对其作出优化,得到一个适合该物种使用的SSR-PCR 反应程序。
由实验可知,辽东栎的SSR-PCR 反应体系中,各个反应条件对反应结果均有影响,其中DNA 浓度和退火温度对反应结果的影响较大,dNTP 浓度、引物浓度和Taq 酶浓度虽然对其反应结果也有较大的影响,但相对不那么敏感,在一定的浓度范围内均能得到相似的理想结果。这说明辽东栎的SSR-PCR反应条件相对不是特别敏感,但是在进行大批量的反应之前对其反应体系进行优化是非常有必要的,一方面可以使得反应条带更为清晰,结果更为准确,另一方面,可以对不同的反应因子选取一个合理的反应浓度,减少不必要的浪费。
在SSR-PCR 反应中,各种因素的含量会对反应结果造成不同的影响,DNA 的浓度对SSR 反应的影响是比较大,在浓度较小的时候,会造成反应得到的产物量过少而无清晰条带的产生,而在浓度过大的时候,则容易造成非特异性扩增,出现引物二聚体,影响条带的正确判读,有的时候还会造成无反应产物出现。而dNTP 浓度的过大或者过小都会造成产物量的减少,dNTP是反应的底物,当其浓度过低时,产物量减少,过高时,它会与Taq 酶争夺Mg2 +的结合,导致酶活性的降低,同样会造成扩增产物的量的减少,并且还容易造成产物在凝胶上出现拖尾现象。Taq 酶浓度的过低会造成扩增产物的量的减少,而如果量过高则会导致非特异性扩增和拖尾现象的出现。本文优化后得到的辽东栎SSR-PCR 反应体系具有酶用量较低、dNTP 浓度较低等特点,如仁用杏的SSR 反应体系为200 μmol·L-1的dNTP,1.5 U的Taq 酶[22],油葵的SSR 反应体系为200 μmol·L-1的dNTP,2 U 的Taq 酶[23]。
另外,循环数的增加容易使得PCR 产物过多容易产生涂抹带或者片状带,甚至导致非特异性产物的产生和增多,而循环数过低则会使得PCR 产物量过少,从而导致条带不清晰甚至看不到。文章对循环数进行重复对照试验最终确定的循环数为33个循环,这也是适合于辽东栎SSR 反应的循环数。实际上,SSR 反应对于反应程序的要求并不像AFLP分子标记试验那么严格,延伸时间的长短也可以根据具体的反应来进行调整,在一定范围内的反应程序的变化并不会造成非常大的影响,在实际的操作中,每个实验室都会有其根据经验所总结得出的最适的SSR 反应程序。
[1]周浙昆.中国栎属的起源演化及其扩散[J].云南植物研究,1992,14(3):227~236.
[2]钱崇澍,陈焕镛.中国植物志:第二十二卷[Z].北京:科学出版社,1998.
[3]李宗峰,李旭光,王永健,等.不同恢复群落中辽东栎种群空间格局分析[J].广西植物,2007,27(4):576~580.
[4]路纪琪,张知彬.鼠类对山杏和辽东栎种子的贮藏[J].兽类学报,2004,24(002):132~138.
[5]马杰,阎文杰,李庆芬,等.东灵山辽东栎虫损种子调查[J].生态学杂志,2008,27(2):282r~285r.
[6]田丽,王孝安,郭华,等.黄土高原马栏林区辽东栎更新特性研究[J].广西植物,2007,27(2):191~196.
[7]吴晓莆.东灵山地区辽东栎群落中植物种群的时空格局研究[D].北京:中国科学院植物研究所,2001.
[8]郭文霞,牛树奎,康东伟,等.北京地区主要乔木树种的抗火性分析[J].北京林业大学学报,2010(3):84~89.
[9]王海珍,韩蕊莲,冉隆贵,等.不同土壤水分条件对辽东栎,大叶细裂槭水分状况的影响[J].西北林学院学报,2003,18(3):1~5.
[10]王海珍,梁宗锁,韩蕊莲,等.辽东栎(Quercus liaotungensis)幼苗对土壤干旱的生理生态适应性研究[J].植物研究,2005,25(003):311~316.
[11]蔺琛,马钦彦,韩海荣,等.山西太岳山辽东栎的光合特性[J].生态学报,2002,22(9):1399~1406.
[12]恽锐,钟敏.北京东灵山辽东栎群落DNA 多样性的研究[J].植物学报:英文版,1998,40(002):169~175.
[13]钟敏,王洪新.干旱和湿润生境下辽东栎群体遗传结构及其适应意义的初步研究[J].植物学报:英文版,1995,37(009):661~668.
[14]Litt M,Luty J A.A hypervariable microsatellite revealed by in vitro amplification of a dinucleotide repeat within the cardiac muscle actin gene[J].American Journal of Human Genetics,1989,44(3):397.
[15]郭小平,刘毓侠.SSR 技术及其在植物遗传育种中的应用[J].华北农学报,1998,13(003):73~76.
[16]马琳,余显权,赵福胜.贵州地方水稻品种的SSR 遗传多样性分析[J].中国水稻科学,2010,24(3):237~243.
[17]闵丽,许崇香,安英辉,等.48 份玉米自交系的SSR 遗传多样性分析[J].黑龙江农业科学,2010(006):8~11.
[18]李小威,董志敏,赵洪锟,等.用SSR 标记进行野生大豆耐碱基因定位及QTL 分析[J].吉林农业科学,2010,35(003):15~17.
[19]朱占玲,田宾,刘宾,等.小麦整穗发芽的QTL 定位分析[J].山东农业科学,2010(006):19~23.
[20]彭波,胡兴明,邓文,等.桑树种质资源SSR 标记的遗传多样性分析[J].湖北农业科学,2010,49(004):779~784.
[21]Ueno S,Tsumura Y.Development of ten microsatellite markers for Quercus mongolica var.crispula by database mining[J].Conservation Genetics,2008,9(4):1083~1085.
[22]艾鹏飞,方闪闪,甄志军,等.仁用杏SSR 反应体系的建立与优化[J].北方园艺,2009(008):68~70.
[23]艾鹏飞,赵治国,方闪闪.油葵SSR 反应体系的优化[J].河北工业科技,2010(001):4~7.
