缺氧后适应与心肌营养素-1对心肌细胞缺氧复氧的保护作用及机制探讨
周贻军,赵亚男,赵 鑫,缪 绯,王先宝,颜 竞,张秀丽,刘映峰,杨平珍
(南方医科大学珠江医院,广州510280)
心肌营养素-1(CT-1)最初由Pennica等[1]在小鼠心脏胚胎干细胞中提取,因在体外具有促进心肌细胞生长的作用而命名为CT-1,其化学结构与IL-6相似,并且能与gpl30受体结合,归类为IL-6家族。在以往的研究中,CT-1只作为心肌疾病诊断和预后判断的标志物;最近的研究发现,其在心肌损伤中是一种重要的神经激素[2]。已有研究发现,缺血后适应可在缺血再灌注时保护心肌细胞[3],即缺氧后适应在缺氧复氧时可保护心肌细胞,其机制可能与激活细胞外信号调节激酶(ERK1/2)通路有关[4]。2012年9月~2013年3月,本研究就CT-1与缺氧后适应对心肌细胞缺氧复氧损伤的作用及与ERK1/2通路的关系进行探讨。
1 材料与方法
1.1 材料 H9C2细胞株,由南方医科大学珠江医院实验室提供。新生牛血清、胎牛血清、DMEM-高糖培养基、青链霉素、PBS缓冲液。Annexin V-FITC细胞凋亡检测试剂盒(Keygen,货号 KGA106)。phospho-p44/42 MAPK(Erk1/2)购自 Cell Signal Technology。Goat Anti-Rabbit IgG(H+L Chain Specific)购自Southern Biotech。定量PCR用酶SYBR Green PCR Master Mix购自TOYOBO公司。CT-1购于Peperotech公司。二甲基亚砜购于Sigma公司。内参抗体:HRP标记的优质内参,购于上海康成公司。
1.2 方法
1.2.1 细胞培养 H9C2心肌细胞株在含10%胎牛血清的DMEM-高糖培养基,37℃、5%CO2培养箱中培养,复苏细胞正常传2、3代后,取指数生长期的细胞进行实验。
1.2.2 实验分组及处理 正常对照组(a组):细胞用含10%新生牛血清的DMEM液正常培养,不经任何处理。缺氧复氧组(b组):采用pH 6.8 D-Hanks液在缺氧培养箱(95%N2、5%CO2、37℃)培养3 h;将pH 6.8的D-Hanks换成含10%新生牛血清的DMEM 液,在 MCO-17AICO2培养箱(95%O2、5%CO2、37℃)复氧3 h。缺氧复氧+缺氧后适应组(c组):在复氧前施加5 min复氧/5 min缺氧3个循环,其他同b组。缺氧复氧+缺氧后适应+CT-1组(d组):在缺氧3 h后加入10μg/L CT-1,5 min复氧/5 min缺氧3个循环,复氧3 h,其他同b组。缺氧复氧+缺氧后适应+CT-1+ERK抑制剂组(e组):在缺氧完成前30 min加入20μmol/L ERK抑制剂A6355,缺氧完成后加入10μg/L CT-1,5 min复氧/5 min缺氧3个循环,复氧3 h,其他同b组。缺氧复氧+缺氧后适应+CT-1+二甲基亚砜组(f组):ERK抑制剂换为二甲基亚砜,其他同e组。
1.2.3 细胞存活率检测 采用MTS法。取指数生长期细胞,调整细胞浓度为1×105/mL,每孔100μL加到96孔板中。收集各处理组细胞,按10∶1加入Cell Titer96AQ单溶液细胞增殖检测试剂,即100μL培养液加入10 μL检测液。95%N2、5%CO2、37 ℃孵育4 h后,酶标仪读板,酶联免疫检测仪读取OD490的数据记为A值,重复3次。细胞存活率=处理组A值/对照组A值×100%。
1.2.4 细胞凋亡率检测 采用流式细胞仪。心肌细胞以1×106/孔接种于培养板,2 mL PBS液轻润洗,以0.25%不含EDTA胰酶孵育使细胞从培养板壁上完全脱落,将细胞重悬,加入Annexin V-FITC,室温避光反应15 min,离心,去除上清。重悬细胞,加入Propidium Iodide,放置在冰上避光保存,用流式细胞仪检测细胞凋亡率。
1.2.5 ERK1/2和p-ERK1/2蛋白表达检测 采用Western blot法。采用 Biorad法提取总蛋白20μg进行电泳分离。蛋白转印到PVDF膜,5%脱脂奶粉溶液室温封闭1 h。分别加入ERK1/2和p-ERK1/2单克隆抗体(1∶1 000稀释)。4℃孵育过夜,辣根过氧化物酶标记山羊抗兔IgG二抗37℃孵育1 h,加入化学荧光发光底物反应5 min。X线片曝光,凝胶成像系统分析结果,重复3次。
1.2.6 Bad mRNA检测 采用Q-PCR法。收集各组细胞,加入Trizol溶液裂解细胞提取总RNA,检测样本纯度和完整性,逆转录后PCR扩增、电泳。设计Bad mRNA上游引物:5'-TATGTTCCCTCTCCGTTACT-3',下游引物:5'-CTCCAGCTAGGATGATAGGA-3'。
1.2.7 统计学方法 采用SPSS13.0软件进行统计分析。计量资料以¯x±s表示,组间比较采用t检验;计数资料采用单因素方差分析,样本率的比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组细胞存活率和凋亡率比较 见表1。

表1 各组细胞存活率和凋亡率比较(%,¯x±s)
2.2 各组细胞p-ERK1/2蛋白、Bad mRNA水平比较 见表2、图1。

表2 各组细胞p-ERK1/2和Bad mRNA水平比较(¯x±s)
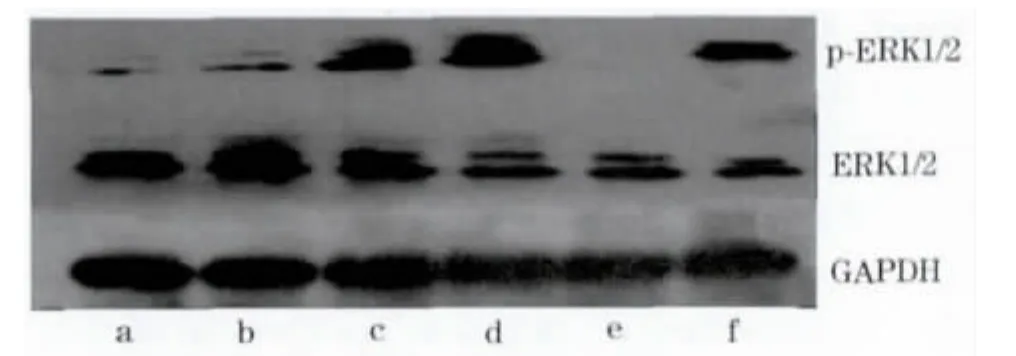
图1 Western blot法检测各组细胞ERK1/2和p-ERK1/2水平
3 讨论
缺血后适应是指心肌持续缺血后,在长时间再灌注之前给予1次或数次短时间的缺血/再灌注。薛枫等[5]在临床工作中证实,急诊经皮冠状动脉介入治疗缺血后适应处理,能改善心肌灌注,减少心肌坏死;于宗良等[6]对家兔进行研究,得出相似结论。缺血后适应应用临床多年,表现出一定的细胞保护作用,但仍无法达到满意的效果。
CT-1在体内分布广泛,在多种组织器官内具有保护细胞的作用。研究证实,CT-1可保护胰腺β细胞,减少β细胞凋亡[7];减少肝脏移植术后肝细胞的缺血/再灌注损伤[8]等。在心血管系统,CT-1被证实与心血管疾病的发生及发展密切相关,其在体外可激活CD+4T淋巴细胞,部分激活充血性心衰时的免疫应答[9]。高血压时CT-1表达上调,诱导血管平滑肌细胞增生、肥大,生产细胞外基质[10]。而且,CT-1可促进心肌细胞应对各种损伤,促进心肌细胞进行适应性改变,产生细胞保护作用。本研究发现,单独应用缺氧后适应虽可起到细胞保护作用,但效果有限,加入CT-1后心肌细胞存活率明显上升、凋亡率下降,提示缺氧后适应联合CT-1后细胞保护作用明显提高。
缺氧后适应及CT-1的心肌细胞保护作用机制尚未完全明确,而已有的研究表明,ERK1/2信号通路不仅与心肌细胞的分化[11]、肥大[12]、血管平滑肌细胞的增殖[13]有关,而且与各种心肌保护机制密切相关[14~16]。ERK1/2存在非磷酸化及磷酸化两种形式,p-ERK1/2具有生物学活性,可产生一系列生物学效应。本研究结果提示,缺氧后适应通过激活ERK1/2信号通路使ERK1/2磷酸化,进而下调Bad mRNA表达,减少心肌细胞凋亡,起到心肌保护作用。在缺氧后适应的基础上加入CT-1,p-ERK1/2蛋白表达量明显增加,提示缺氧后适应联合CT-1可进一步加强对ERK1/2信号通路的激活作用,从而增加ERK1/2磷酸化水平,产生更大的心肌细胞保护作用。
综上所述,缺氧复氧损伤对心肌细胞伤害较大,缺氧后适应处理可减少缺氧复氧对心肌细胞的损伤,与CT-1联合后可明显增强对缺氧复氧心肌细胞的保护作用,其可能的机制为通过激活ERK1/2信号通路,使ERK1/2蛋白磷酸化,下调Bad mRNA表达。
[1]Pennica D,King KL,Shaw KJ,et al.Expression cloning of cardiotrophin 1,a cytokine that induces cardiac myocyte hypertrophy[J].Proc Natl Acad Sci,1995,92(4):1142-1146.
[2]Richards AM.Cardiotrophin-1:a new cardiac marker[J].Clin Sci(Lond),2000,99(1):91-92.
[3]Penna C,Pasqua T,Perrelli MG,et al.Postconditioning with glucagon like peptide-2 reduces ischemia/reperfusion injury in isolated rat hearts:role of survival kinases and mitochondrial KATPchannels[J].Basic Res Cardiol,2012,107(4):272.
[4]van Vuuren D,Lochner A.Ischaemic postconditioning:from bench to bedside[J].Cardiovasc J Afr,2008,19(16):311-320.
[5]薛枫,杨向军,章斌,等.缺血后适应在急诊经皮冠状动脉介入治疗中的应用[J].临床心血管病杂志,2011,27(5):341-345.
[6]于宗良,陈乐,杨向军.粒细胞集落刺激因子联合缺血后适应治疗急性心肌梗死的实验研究[J].中国病理生理杂志,2012,28(11):1933-1937.
[7] Jiménez-González M,Jaques F,Rodríguez S,et al.Cardiotrophin 1 protects beta cells from apoptosis and prevents streptozotocin-induced diabetes in a mouse model[J].Diabetologia,2013,56(4):838-846.
[8]Aguilar-Melero P,Luque A,Machuca MM,et al.Cardiotrophin-1 reduces ischemia/reperfusion injury during liver transplant[J].J Surg Res,2012,181(2):83-91.
[9] Fritzenwanger M,Jung C,Franz M,et al.Immunomodulatory effects of cardiotrophin-1 on in vitro cytokine production of monocytes & CD+4T-lymphocytes[J].Indian J Med Res,2012,136(3):471-476.
[10]Lopez-Andres N,Fortuno MA,Diez J,et al.Vascular effects of cardiotrophin-1:a role in hypertension[J].JHypertens,2010,28(6):1261-1272.
[11]Gao M,Yang J,Wei R,et al.Ghrelin induces cardiac lineage differentiation of human embryonic stem cells through ERK1/2 pathway[J].Int J Cardiol,2012(16):106.
[12] Vidal M,Wieland T,Lohse MJ,et al.β-Adrenergic receptor stimulation causes cardiac hypertrophy via a Gβγ/Erk-dependent pathway[J].Cardiovasc Res,2012,96(2):255-264.
[13]Yao HL,Gao FH,Li ZZ,et al.Monocyte chemoattractant protein-1 mediates angiotensinⅡ-induced vascular smooth muscle cell proliferation via SAPK/JNK and ERK1/2[J].Mol Cell Biochem,2012,366(1-2):355-362.
[14]Dong XB,Yang CT,Zheng DD,et al.Inhibition of ROS-activated ERK1/2 pathway contributes to the protection of H2S against chemical hypoxia-induced injury in H9c2 cells[J].Mol Cell Biochem,2012,362(1-2):149-157.
[15]Zhang S,Li H,Yang SJ.Tribulosin suppresses apoptosis via PKC epsilon and ERK1/2 signaling pathway during hypoxia/reoxygenation in neonatal rat ventricular cardiac myocytes[J].J Asian Nat Prod Res,2011,13(12):1135-1145.
[16]Yuan H,Yan B,Wang HH,et al.Nitric oxide preserves XIAP and reduces hypoxia/reoxygenation-induced cardiomyocytes apoptosis via ERK1/2 activation[J].Biochem Biophys Res Commun,2012,27,421(1):134-139.

