胰岛素样生长因子-I及雌激素受体在绝经后子宫肌瘤中的表达
孙华萍*
(浙江省淳安县第二人民医院妇产科,浙江 淳安 311719)
胰岛素样生长因子-I及雌激素受体在绝经后子宫肌瘤中的表达
孙华萍*
(浙江省淳安县第二人民医院妇产科,浙江 淳安 311719)
目的研究胰岛素样生长因子-I及雌激素受体在女性绝经后子宫肌瘤组织中的表达及其相关性,为防治子宫肌瘤提供更充分的理论依据。方法将研究对象分为研究组20例,为绝经后女性行肌瘤切除者;对照组43例,则为孕龄女性行肌瘤切除者。采用免疫组织化学法,检测胰岛素样生长因子-I及雌激素受体在肌瘤组织中的表达。结果研究组中胰岛素样生长因子-I的阳性表达率低于对照组,差异有统计学意义(P<0.001);相反的,研究组中雌激素受体的阳性表达率则高于对照组,差异也有统计学意义(P<0.05)。结论胰岛素样生长因子-I在绝经后子宫肌瘤组织中的表达,可能促进了子宫肌瘤的发生、发展;而局部雌激素受体在绝经后子宫肌瘤组织的高表达,则可能对绝经后子宫肌瘤的继续生长起着非常重要的作用。
胰岛素样生长因子-I;雌激素受体;绝经后;子宫肌瘤
作为女性生殖器官中最多见的良性肿瘤,子宫平滑肌瘤可引起腹痛、压迫感、月经量增多及不孕症等一系列临床症状,同时有研究报道其还可表现为低度恶性,向肺部等其他器官转移[1]。目前有研究者认为,雌激素及其受体(ER)对子宫肌瘤的发生具有重要作用,但选择性雌激素受体调节剂如三苯氧胺并不能完全治愈子宫肌瘤,故提示还有其他因子参与子宫肌瘤发病机制[2]。近年来研究发现,在子宫肌瘤中存在胰岛素样生长因子(IGF)及其受体,介导雌激素促进肌瘤的生长。虽然子宫肌瘤多见于孕龄女性,但临床实践中也发现部分子宫肌瘤在绝经患者中仍呈逐渐增大现象。本研究通过免疫组化检测绝经后女性子宫肌瘤及孕龄女性子宫肌瘤组织中IGF-I及ER的表达,进一步探讨绝经后子宫肌瘤发病机制的相关因素,为积极防治子宫肌瘤提供新的理论依据。
1 资料与方法
1.1 临床资料
选取2000年1月至2012年12月在我院因子宫肌瘤行子宫切除术住院患者为研究对象。其中绝经后行子宫切除者20例作为研究组,年龄(53.47±4.18)岁。孕龄女性行子宫切除者43例作为对照组,年龄(39.13±4.17)岁。上述患者均已排除内分泌的干扰因素,术前未服用激素类药物,无甲状腺功能障碍、卵巢肿瘤及糖尿病等并发症。所有受试对象均自愿接受各种必要的检查,并签署相关的知情同意书。
1.2 试剂及仪器
IGF-I抗体(北京中杉金桥生物技术有限公司);ER抗体(福州迈新生物技术开发有限公司);MaxvisionTM检测试剂盒(福州迈新生物技术开发有限公司);电子显微镜(OLYMPUS,日本)等。
1.3 实验方法
子宫经手术离体后,呈纵行剖开,在瘤体中心部取约0.8cm×0.8cm ×0.2cm大小的组织块常规固定。严格按照试剂盒检测步骤进行操作。高倍镜下观察IGF-I在胞浆、胞膜的表达[3]及ER在胞核的表达[4]。按人工计数方法[5],并随机选择4个视野,计数平滑阳性细胞总数和肌细胞总数,计算阳性细胞表达率。
1.4 统计学分析
采用SPSS17.0统计软件,所有数据均以(χ—±s)表示,组间比较采用t检验,以P<0.05为有差异统计学意义。
2 结 果
2.1 IGF-I在绝经后及孕龄女性子宫肌瘤组织中的表达
IGF-I在免疫组化中阳性表现为棕色细小颗粒状,主要分布在肌瘤细胞胞浆及包膜。其中,在绝经后女性子宫肌瘤组织中的表达阳性率为(75.34±1.25)%,见图A;而在孕龄女性子宫肌瘤组织中的表达阳性率为(94.17±1.49)%,见图B;二者比较差异有统计学意义(P<0.001)。见表1。
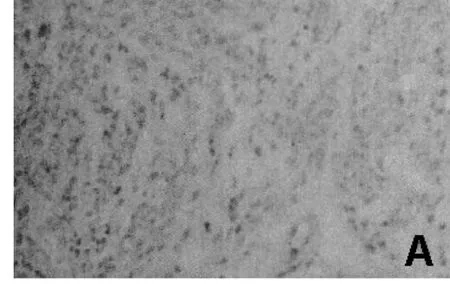
图A 代表IGF-I在绝经后女性子宫肌瘤组织中的表达(×200)

图B 代表IGF-I在孕龄女性子宫肌瘤组织中的表达(×200)
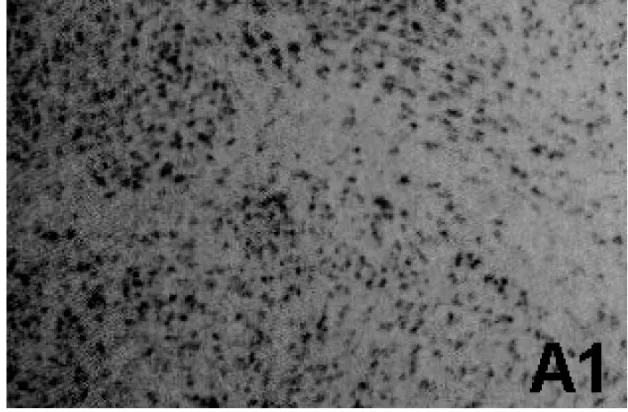
图A1 代表ER在孕龄女性子宫肌瘤组织中的表达(×200)
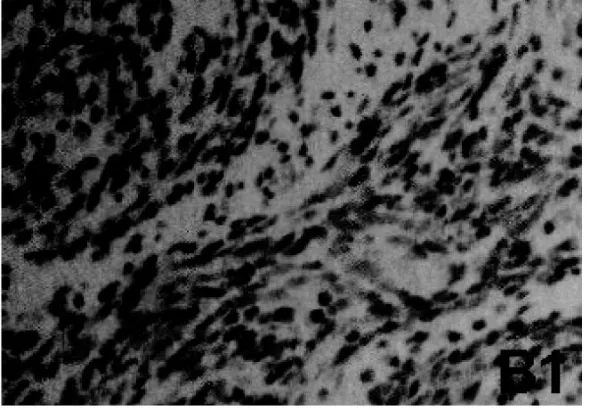
图B1 代表ER在绝经后女性子宫肌瘤组织中的表达(×200)
2.2 ER在绝经后及孕龄女性子宫肌瘤组织中的表达
ER在免疫组化阳性也表现为棕色细小颗粒状,但其主要分布在胞核中。其中,在孕龄女性子宫肌瘤组织中的表达阳性率为(51.36±2.07)%,见图A1;而在绝经后女性子宫肌瘤组织中的表达阳性率为(83.15± 2.13)%,见图B1;二者比较差异也有统计学意义(P<0.05)。见表1。

表1 IGF-I及ER在绝经后及孕龄女性子宫肌瘤组织中表达阳性率的比较(χ—±s)
3 讨 论
子宫平滑肌瘤是女性生殖器官中最多见的良胜肿瘤之一,也是妇女绝经前子宫切除的主要原因,对广大妇女的身心健康造成严重的影响。随着绝经后机体内孕激素水平的降低,大多数子宫肌瘤逐渐萎缩,但临床实践中也发现在绝经后部分肌瘤体积反而逐渐增大,甚至恶变,而最终采取手术治疗。因此,对于绝经后非萎缩性子宫肌瘤的诊治已引起相当重视,但缺乏满意的非手术治疗方法,其中部分学者主张放宽手术指征以尽早进行手术治疗。本研究通过比较绝经后女性子宫肌瘤及孕龄女性子宫肌瘤组织中IGF-I及ER含量的表达,进一步探讨绝经后子宫肌瘤的发病机制,为积极防治子宫肌瘤有极其重要的意义。
目前对其子宫肌瘤的发病机制尚不十分明确,与生育情况、种族、年龄及肥胖等有关,也可能与生长因子、性激素水平及基因突变有一定的相关性。70年代初,Townsend等[6]采用G-6-PD(Glucose-6-phosphate Dehydrogenase)的异构酶证实了同一机体的不同部位肌瘤来源于不同细胞的克隆增殖。有研究证实[7],局部肌瘤组织细胞对雌激素的高敏感性在肌瘤发生过程中发挥重要的作用。也有文献报道,局部的胰岛素样生长因子通过自分泌/旁分泌途径介导雌激素对细胞的有丝分裂作用[8]。胰岛素样生长因子系统(IGFS)是一类小分子单链多肽(分子量约7500kD),由IGF-I和IGF-II两个单链多肽类生长因子组成。作为一种多功能细胞增殖调控因子,其分布广泛,与个体发育及胚胎分化紧密相关,参与蛋白质、脂肪和糖代谢。在细胞的生长代谢、分化和增殖中发挥重要作用。本研究结果发现IGF-I在绝经后非萎缩性子宫肌瘤组织中有一定的表达,但含量明显低于孕龄女性子宫肌瘤组织的表达。与carter等[9]研究结果基本一致。IGF-I表达受雌、孕激素水平的调控,绝经后非萎缩性子宫肌瘤组织中IGF-I表达下降,可能与子宫肌瘤局部雌激素含量下降有关。非萎缩性子宫肌瘤组织IGF-I含量明显高于绝经后萎缩性肌瘤组织,说明IGF-I的表达受雌激素的影响。绝经后雌激素水平降低,但肌瘤局部分泌的IGF-I促进肌瘤的继续生长。由此,我们认为IGF-I表达水平的相对增高对绝经后部分肌瘤体积的增大具有重要的作用。
根据实验结果及临床观察证实子宫肌瘤是一种性激素依赖性肿瘤,与雌激素及其受体相关。雌激素可能通过激活局部调控因子,活化细胞分裂素活化蛋白激酶及快速酪氨酸磷酸化早期下游信号转导通路来参与子宫平滑肌细胞的有丝分裂。
有研究表明[10],绝经后非萎缩性组肌瘤中激素合成酶的表达含量与绝经前分泌期及增生期相当,且显著高于绝经后萎缩性组(P<0.05),而绝经后萎缩性组肌瘤与相应肌层之间差异无统计学意义(P>0.05),说明绝经后患者雌激素水平的下降,肌瘤可继续生长,可能与激素合成酶持续高表达、雌激素原位合成增加密切相关。本研究结果表明,绝经后非萎缩性子宫肌瘤组织仍有ER的高表达,并明显高于孕龄女性子宫肌瘤组织中的含量,从而可说明绝经后子宫瘤继续生长可能与局部组织处于相对高雌激素水平有关,从而促进肌瘤继续生长。
综上所述,IGF-I在绝经后子宫肌瘤组织的表达,对促进子宫肌瘤的生长具有重要意义。而局部ER在绝经后子宫肌瘤组织的高表达则提高局部组织的对雌激素的敏感性,提示其在绝经后子宫肌瘤的继续生长起重要作用。由此可见,若能找到有效控制局部雌激素合成或改变受体活性的药物,对于绝经后子宫肌瘤的保守性或辅佐治疗具有十分重要的作用。
[1] Rakhshani N.Benign Metastasizing Leiomyoma of the Uterus[J]. Arch Iranian Med,2007,10(1):97-99.
[2] Richards RG,Augustine RP.Estradiol stimulates tyrosine phosphorylation of the insulin-like growth factor-I receptor and insulin receptor substrate-1 in the uterus[J].Proc Natl A cad Sei USA, 1996,93(21):12002-12007.
[3] Linda YU,Katrin S.Differential Expression of Receptor Tyrosine Kinases(RTKs) and IGF-1 Pathway Activation in Human Uterine Leiomyomas[J].IGF-I Pathway Activation In Fibroids,2008,14 (5-6):264-275.
[4] Takashi Y,Satoshi N.Progesterone down-regulates insulin-like growth factor-I expression in cultured human uterine leiomyoma cells[J].Human Reproduction,2004,19(4):815-821.
[5] 邢传平.免疫组织化学结果的判定方法[J].中华病理学杂志,2001, 30(4):318.
[6] Stewart EA.Uterine fibroids[J].Lancet,2001,357(9252):293-298.
[7] 乐杰.妇产科学[M].北京:人民卫生出版社,2008:378-379.
[8] Maruol T,Ohara N,Wang J,et al.Sex steroidal regulation of uterine leiomyoma growth and Apoptosis[J].Human Reproduction Update, 2004,10(3):207-222.
[9] Hamelers IH,Van Schaik RF,Van Teeffelen HA.Synergistic proliferative action of insulin-like growth factor-I and 17 beta-estradiol in MCF-7S breast tumor cells[J].Exp Cell Res,2002,273(1):107-117.
[10] 夏晓梦,伍小敏,方小玲.绝经后子宫肌瘤中芳香化酶P450的表达及意义[J].实用妇产科杂志,2008,24(12):733-736.
R737.33
B
1671-8194(2013)12-0167-02
*通讯作者:E-mail:yuwen3431@163.com

