胃蛋白酶原光激化学发光免疫测定方法的建立
周 伟金 磊* 孟 伟高月求
(1 上海中医药大学附属曙光医院检验科,上海 200021;2 上海中医药大学附属曙光医院细胞免疫实验室,上海 200021)
胃蛋白酶原光激化学发光免疫测定方法的建立
周 伟1金 磊2* 孟 伟1高月求2
(1 上海中医药大学附属曙光医院检验科,上海 200021;2 上海中医药大学附属曙光医院细胞免疫实验室,上海 200021)
目的建立一种检测人血清胃蛋白酶原浓度的光激化学发光免疫测定方法。方法采用双抗体夹心法建立检测人血清中胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ浓度的方法,评估其分析灵敏度、回收率和批内精密度,并与雅培(化学发光法)进行比较。结果胃蛋白酶原Ⅰ/Ⅱ的分析灵敏度分别为0.8ng/mL和0.6ng/mL,回收率分别为100.3%、106.5%,批内变异系数(CV)为0.93%~4.1%、1.2%~4.3%,与化学发光法的相关性较好(r=0.99)。结论该方法测定胃蛋白酶原具有较高灵敏度、精密度和准确性,适用于临床。方法建立后可进一步进行长期稳定性试验。
胃蛋白酶原;光激化学发光免疫分析方法;微粒
胃蛋白酶原(pepsinogen,PG)是胃蛋白酶的无活性前体,分子量为42KDa左右,PG有7个同工酶,按其生化免疫特性可分为PGⅠ亚群和PGⅡ亚群。PGⅠ主要由胃底腺主细胞分泌,PGⅡ则由胃底腺、胃窦幽门腺、Brunner等腺分泌[1,2],它们可以反映胃黏膜状态和功能。PG大多释放入胃并活化为胃蛋白酶,仅有约1%通过黏膜毛细血管进入血循环,当胃部有病理变化时,如胃炎、胃溃疡等,血清PG的水平会发生相应的变化,PG作为胃病筛查的体外检测已越来越受到关注[3]。建立一种快速、灵敏的胃蛋白酶原测定方法是临床研究人员关注的焦点。我们尝试采用光激化学发光免疫分析方法[4](1ight initiated chemiluminescent assay,LICA)建立一种检测胃蛋白酶原的方法,并对检测性能进行初步评价。
1 材料与方法
1.1 试剂和仪器
抗PGⅠ单克隆抗体8003#和8009#,抗PGⅡ单克隆抗体8101#和8103#均购自Medix Biochemia公司。发光微粒由博阳生物科技(上海)有限公司提供。LICA通用液系LICA HT光激化学发光检测仪的配套试剂。二奎啉甲酸(BCATM)法蛋白质定量检测试剂盒购自Thermo Fisher Scientific公司。相关性分析样本,来自于上海中医药大学附属曙光医院住院及门诊病人新鲜血液,分离血清冷冻保存。LICA HT高通量均相发光免疫分析仪、LICA SP全自动移液器由上海博阳医疗仪器有限公司提供;粒径仪为NICOMP380激光衍射式粒度分布测量仪。96孔微孔板为LICA HT高通量均相发光免疫分析仪配套专用板。
1.2 实验方法
1.2.1 免疫发光微粒的制备
依照参考文献[5],取适量200nm左右表面为活性醛基的发光微粒2支,离心处理,超声分散至0.1mol/L磷酸缓冲液(pH值7.0)中,以10∶2(W/w)的比例分别加入单克隆抗体8003#和8101#,分别加入适量三氢硼氰化钠(NaCNBH3)催化,37℃旋转混合反应48h,进行离心,清洗未反应的单抗,之后将其分别定容至10mg/mL,4℃保存备用。
1.2.2 抗体的生物素标记
取适量单克隆抗体8009#和8103#,将其溶液的pH值调整为8.5,以1∶30(摩尔比)的比例加入生物素(Biotin),4℃混合反应过夜,之后将未反应的生物素进行透析处理,将其定容至1mg/mL,4℃保存备用。
1.2.3 标准品的制备
将两份经Abbott Architect系统定值的PGⅠ、PGⅡ混合样本用分别小牛血清系列稀释,配制成0、5、35、70、200、500ng/mL的PGI标准液和0、5、10、20、50、100ng/mL的 PGⅡ标准液。再使用Abbott Architect系统对每个稀释液进行标定,标定合格后,分装成每管1mL,保存在-20℃备用。
1.2.4 检测方法
在96孔微孔板中,每孔依次加入标准品或者待测样本25µL、免疫发光微粒试剂25µL、生物素标记试剂25µL,将微孔板置于LICA HT光激化学发光检测仪内,仪器程序设定为37℃温育1200s,然后仪器自动加入LICA通用液175µL,37℃温育900s后,读取光信号RLU值。
1.2.5 检测方法性能评价
1.2.5.1 分析灵敏度
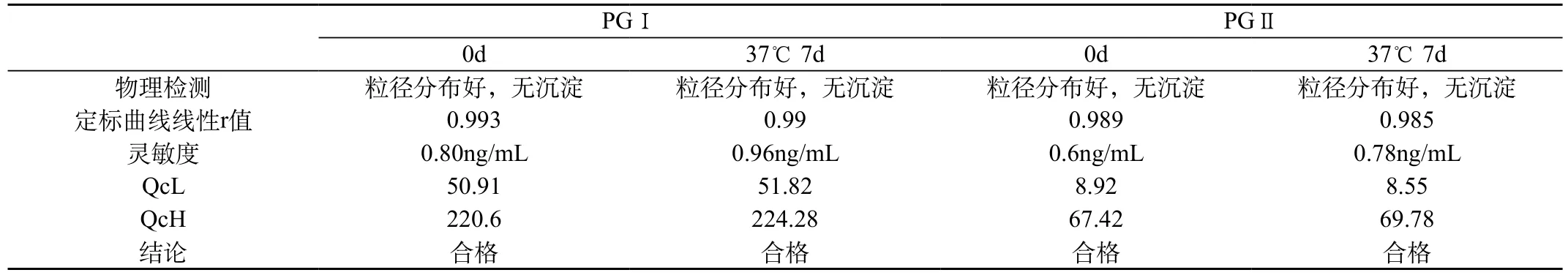
表2 LICA PGⅠ/PGⅡ的稳定性

图1 LICA同Abbott测定PGⅠ的相关图
方法参考EP17-A[6]程序:质控在控的情况下,同批试剂一次运行空白样本或零值校准品20次,计算均值及SD,以空白均值±2SD来计算方法的分析灵敏度。
1.2.5.2 回收率
待测样本等体积分为3份,取2份分别以等体积与高低质控品(QC H和QC L)等体积混合,分别测定待测样本、混合后样本、QC H和QC L各测3次,取均值,计算回收率。回收率=实际检测浓度/理论浓度×100%。
1.2.5.3 精密度
参考EP5-A2[7]程序:采用同一批试剂、校准品,以各自配套的质控血清作为测试标本,一次运行对标本重复测定至少20次。计算均值、SD及CV。
1.2.5.4 稳定性
37℃加速稳定性实验,将试剂在37℃存放7d,然后对其进行物理检查,并在线性、灵敏度、精密度方面考察其稳定性。
1.2.5.5 方法学相关性分析
取65份患者血清样本,分别用建立的LICA和Abbott Architect试剂(化学发光法)进行检测,并对2种方法的检测值进行比较,得到相关性曲线。
2 结 果
2.1 分析灵敏度
光激化学发光法PGⅠ、PGⅡ试剂盒的分析灵敏度分别为0.8ng/mL和0.6ng/mL。
2.2 批内精密度
光激化学发光法PGⅠ、PGⅡ试剂盒QC L的批内精密度分别为4.1%和4.3%,QC H的批内精密度分别为0.93%和1.2%。
2.3 回收率
样本与QC L等体积混合后的样本为样本1,与QC H等体积混合后的样本为样本2,回收率=实际检测浓度/理论浓度×100%。结果见表1。
2.4 稳定性
将37℃存放7d的试剂取出,对其进行物理检查,并考察试剂的线性、灵敏度、精密度,结果见表2。
2.5 与化学发光法检测结果的相关性
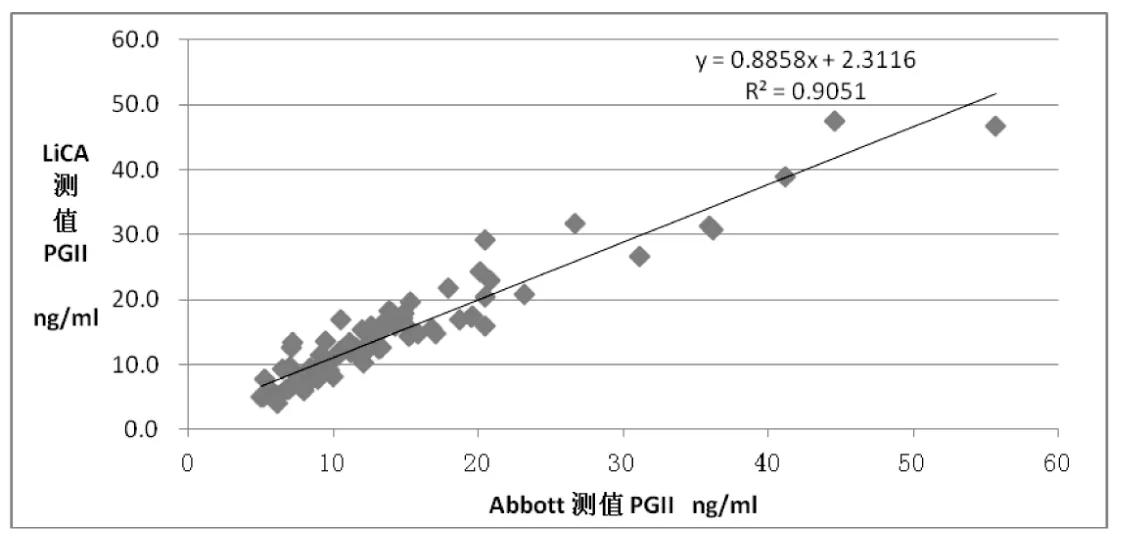
图2 LICA同Abbott测定PGⅡ的相关图

表1 LICA PGⅠ/PGⅡ的回收率
分别用LICA法和Abbott化学发光法检测65份患者血清样本的PGⅠ和 PGⅡ的浓度,相关结果见图1和图2,相关性方程分别为YPGI=1.004XPGI-0.147,r=0.977;YPGII=0.885XPGII+2.311,r=0.951;对二相关系数做统计分析,r>r0.05(63),P<0.05,说明相关系数有统计意义。
3 讨 论
已有报道证实[8,9],血清胃蛋白酶原的水平可动态地反映胃黏膜的状态和组织功能:在发生基底腺黏膜萎缩性胃炎时,会伴随着血清PGⅠ含量的显著下降,PGⅠ/PGⅡ的比值降低,这提示了胃癌的可能;在胃溃疡时,PGⅠ会异常增高;比较溃疡组、慢性萎缩性胃炎组、胃癌组和正常组的PGⅠ值和PGⅠ/PGⅡ值,其大小顺序如下:溃疡组>正常组>萎缩性胃炎组>胃癌组。由于PGⅠ、PGⅡ检测成本相对低廉且操作简便,适合大批量的标本检测,对胃黏膜疾病的大规模筛查具有实用价值,因此可作为慢性萎缩性胃炎的胃黏膜萎缩程度筛查指征。
对PG的检测目前已经报道的方法有免疫比浊分析、化学发光免疫分析、时间分辨荧光免疫分析等,但这些方法分别存在敏感性差、定量范围窄、需要反复清洗与分离、检测耗时长、自动化程度不高等缺点。光激化学发光是继LOCI[10](Luminescent oxygen channeling immunoassay)技术问世之后,在国内建立、发展并应用于临床检测的一种新型检测技术。在均相条件下将内部带有染料的LICA通用液微粒以及包被有活性分子并且内部带有发光化合物的发光微粒混合物和检测样本混合。此时LICA通用液微粒和包被有活性分子的发光微粒可迅速有效地捕捉靶分子并形成免疫夹心复合物。经680nm激发光照射后,LICA通用液微粒中的染料被诱导激活,并释放高能态的单线态活性氧。该高能态的活性氧被近距离的发光微粒俘获,传递能量以激活所述发光微粒中的发光化合物。数微秒后,发光微粒中的发光化合物将释放出高能级610nm红光,用光子计数器计数得到相对光量子单位(RLU)值。该法反应为均相反应,既可加快反应速度,又可避免反复分离与清洗,同时,由于微粒表面积的增加,也提高了检测的灵敏度。
本研究采用LICA的双抗体夹心法,建立了测定PGⅠ和PGⅡ的方法,并考察了分析性能。结果表明,LICA法测定PGI和PGII的本底低、灵敏度高、特异性强、准确性和重复性好、分析时间短(仅为25min)。在37℃ 7d的加速稳定性实验中,试剂的外观目测无沉淀,粒径分布均一,在线性、灵敏度、精密度方面也和4度试剂无明显差异,试剂的稳定性佳。
LICA测定PGⅠ和PGⅡ的分析灵敏度分别为0.8ng/mL和0.6ng/mL,同市场上同类产品雅培的灵敏度1ng/mL和0.5ng/mL近似;本法的回收率高,在90%~110%之间;质控血清的批内和批间CV均<5%,具有很好的准确性和重复性,与化学发光法的相关性好,可适用于临床。该方法的建立有助于进一步进行长期稳定性试验和相应的检测试剂盒的研制。
[1] Samloff IM.Cellular localization of group I pepsinogens in human gastric mucosa by immunofluorescence[J].Gastroenterology,1971, 61(2):185-188.
[2] Samloff IM,Liebman WM (1973).Cellular localization of the group II pepsinogens in human stomach and duodenum by immunofluorescence[J].Gastroenterology,1973,65(1):36-42.
[3] 孙丽萍,袁嫒.胃蛋白酶原含量检测及其在胃疾病诊治中的应用[J].世界华人消化杂志,2001,9(10):1174-1176.
[4] 高云朝.光激化学发光技术研究进展及应用[J].中华检验医学杂志,2009,32(4):474-476.
[5] Hermanson GT.Bioconjugate Techniques[M].2nd ed.Anaheim: Academic Press,2008:890-892.
[6] Clinical and Laboratory Standards Institute (Formerly NCCLS). Protocols for Determination of Limits of Detection and Limits of Quantitation; Approved Guideline-Second Edition [S].EP17-A, NCCLS,2004.
[7] Clinical and Laboratory Standards Institute (Formerly NCCLS). Evaluation of Precision Performance of Quantitative Measurement Methods[S].EP5-A2,NCCLS,2004.
[8] 吴志成,何敏,夏勇.血清胃蛋白酶原检测与慢性萎缩性胃炎相关研究[J].齐齐哈尔医学院学报,2010,31(13):2027-2028.
[9] 姜智敏,戈之铮.胃蛋白酶原在慢性萎缩性胃炎和胃癌筛查中的价值[J].胃肠病学,2009,14(12):754-756.
[10] Ullman EF,Singh S,Wu ZP,et al.Luminescent oxygen channeling immunoassay: Measurement of particle binding kinetics by chemiluminescence[J].Proc Natl Acad Sci USA,1994,91(6): 5426-5430.
Quantitative Determination of Pepsinogen Using the Light Initiated Chemiluminescent Immunoassay
ZHOU Wei1, JIN Lei2, MENG Wei1, GAO Yue-qiu2
(1 Department of Laboratory, the Affiliated Shuguang Hospital of Shanghai TCM University, Shanghai 200021, China; 2 Cellular Immune Laboratory, the Affiliated Shuguang Hospital of Shanghai TCM University, Shanghai 200021, China)
ObjectiveTo develop a light initiated chemiluminescent immunoassay for human pepsinogen.MethodsDouble antibody sandwich immunoassay was used to develop to detect the concentrations of pepsinogen Ⅰ and pepsinogen Ⅱ in human sera respectively. Analytical sensitivity, recovery and within-run precision were evaluated and the results were compared with Abbott reagent(chemiluminescent immunoassay).ResultsThe analytical sensitivity of pepsinogen Ⅰ and pepsinogen Ⅱ were 0.8ng/mL and 0.6ng/mL, recovery of PGⅠ and PGⅡ were 100.3%, 106.5%, within-run precision were 0.93%-4.1%、1.2%-4.3%. The coincidence rate with the chemiluminescent immunoassay was highly significant (r=0.99).ConclusionsThe light initiated chemiluminescent immunoassay for pepsinogen have good sensitivity, precision, accuracy, and can be applied for clinical determination. It will be helpful to carry on the long-term stability test.
Pepsinogen; Light initiated chemilumineseent immunoassay; Microsphere
R446.6
B
1671-8194(2013)12-0064-03
*通讯作者

