苯酚羟基化工艺条件的研究
冯世强,许 宁,庄 岩,马建学,褚小东
(上海华谊丙烯酸有限公司,上海 200137)
邻苯二酚和对苯二酚是两种重要的有机化工中间体,广泛应用于香料、染料、医药、农药、橡胶、涂料、照相等行业。传统的对苯二酚生产方法有苯胺氧化法、对二异丙苯氧化法等,邻苯二酚则主要通过邻氯苯酚或邻甲氧基苯酚等水解获得。这些传统的生产方法由于反应步骤多、工艺流程复杂、副产物多等原因已被淘汰。二十世纪70年代以来,以H2O2为氧化剂的苯酚羟基化合成苯二酚的方法,由于工艺条件简单、反应条件温和H2O2价廉、氧化副产物是水而无污染,被认为是二十一世纪最有前途的“清洁”工艺路线,是国内外研究机构竞相研究的热点之一[1,2],也是制备邻、对苯二酚产品的重要方法。该反应遵循自由基机理,反应过程较为复杂。本文以负载型铁系氧化物为催化剂、以30%H2O2为氧化剂,研究了自由基机理反应条件下,苯酚羟基化的工艺条件。
1 实验部分
1.1 主要原料及试剂
苯酚(江苏永华精细化学品有限公司);30%过氧化氢(上海远大过氧化物有限公司);邻苯二酚(江苏永华精细化学品有限公司);对苯二酚(江苏永华精细化学品有限公司),以上试剂均为分析纯。
1.2 催化剂的制备
负载型铁系氧化物催化剂的制备见专利[3]。制备过程中,将微孔树脂浸渍于含有铁离子的盐溶液中,经浓碱处理后,再经回流即可制得。
1.3 苯酚羟基化反应
采用50mL玻璃反应釜,间歇式操作。操作方式:首先称取一定量的苯酚、水和催化剂置于反应釜中,待体系温度稳定到反应温度时,用微量泵将双氧水连续加入。待H2O2全部加入后,继续反应15min。反应液经过滤后取样分析。
2 结果与讨论
2.1 反应温度的影响
在第二溶剂∶水∶苯酚质量比=2∶3∶1、苯酚与H2O2摩尔比=3∶1、催化剂用量为苯酚质量的2.5%、反应时间120min的工艺条件下,实验考察了反应温度对催化剂性能的影响,结果见图1、2。

图1 反应温度对苯酚转化率的影响Fig.1 Effectof reaction temperation on phenol conversion
从图1可以看出,苯酚的转化率随反应温度的升高先降低后升高。
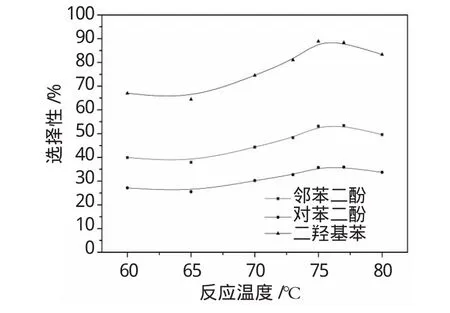
图2 反应温度对苯二酚选择性的影响Fig.2 Effectof reaction temperation on dihydroxybenzene selectivity
从图2可以看出,苯二酚的选择性随反应温度的升高先升高后降低,在75℃时达到最高。在本文考察范围内,当温度过低或过高时,都会出现苯酚转化率升高和苯二酚选择性降低的现象。从Fenton机理看,苯酚羟基化过程包括多种平行或竞争反应,因此,这种奇怪的性能曲线应该是多个过程的综合反映,在没有对羟基化各个过程完全了解并量化之前,本文尚且无法进行准确的现象分析和讨论。
由于75℃时的苯二酚选择性最高,因此选取该温度为最佳反应温度,此时苯酚转化率为18.3%,苯二酚选择性为88.9%。
2.2 催化剂用量的影响
在第二溶剂∶水∶苯酚质量比=2∶3∶1、苯酚与H2O2摩尔比=3∶1、反应温度75℃;反应时间120min的工艺条件下,实验考察了催化剂用量对催化剂性能的影响,结果见图3、4。
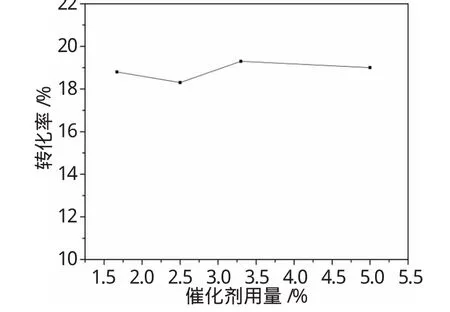
图3 催化剂用量对苯酚转化率的影响Fig.3 Effectof catalyst dosage on phenol conversion
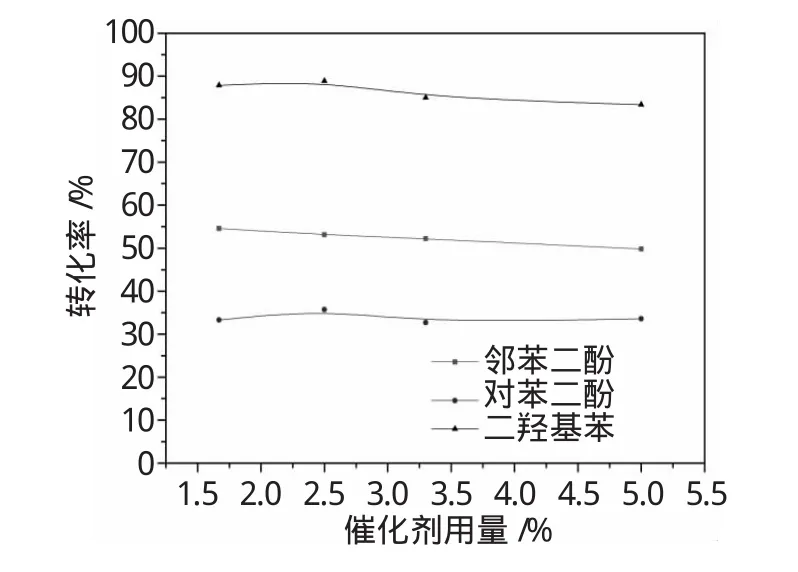
图4 催化剂用量对苯二酚选择性的影响Fig.4 Effectof catalyst dosage on dihydroxybenzene selectivity
从图4可以看出,催化剂用量在苯酚质量的2.5%时,苯二酚选择性最高。此时苯酚转化率为18.3%,苯二酚选择性为88.9%。
按多相催化反应的规律看,催化剂用量的增加会导致反应转化率的提高和产品选择性的下降。但苯酚羟基化反应比较特殊,本文先后进行了多次重复性试验,发现当催化剂用量降低到最佳值以下时,苯酚的转化率和苯二酚选择性却有较大幅度的下降。这点需要从H2O2数个平行的竞争性反应来解释。
2.3 H2O2用量的影响
在第二溶剂∶水∶苯酚质量比=2∶3∶1、催化剂用量为苯酚质量的2.5%、反应温度75℃、反应时间120min的工艺条件下,实验考察了H2O2用量对催化剂性能的影响,结果如图5、6。

图5 苯酚与过氧化氢摩尔比对苯酚转化率的影响Fi g.5 E f f e c t o f mo l a r r a t i o o f p h e n o l t o H 2O2 o n p h e n o l c o n v e r s i o n
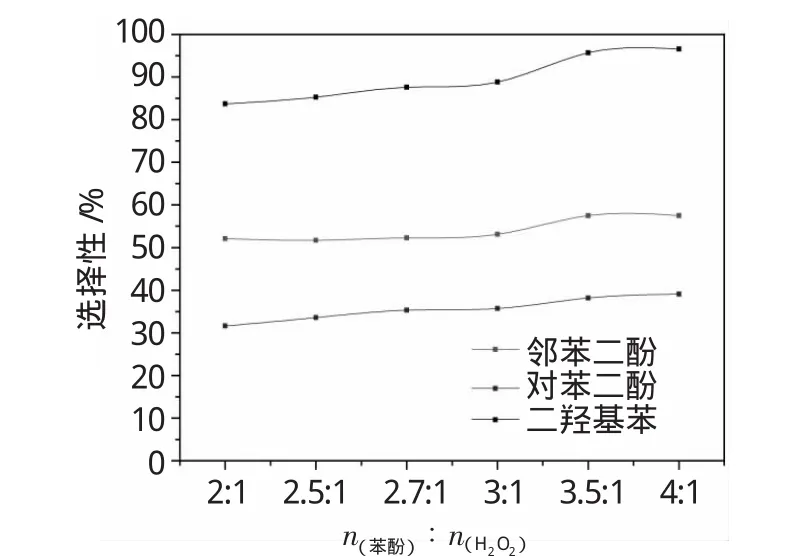
图6 苯酚与过氧化氢摩尔比对苯二酚选择性的影响Fig.6 Effect ofmolar ratio of phenol to H2O2 on dihydroxybenzene selectivity
由图5、6可以看出,该反应与一般多相催化反应规律相同,随着H2O2用量的减少,苯酚转化率降低,而苯二酚选择性逐渐增加。相对来说,H2O2用量在苯酚羟基化反应中的规律性比较明显,随着H2O2用量的降低,苯酚转化率明显降低,苯二酚选择性明显升高。当苯酚与H2O2的摩尔比为4∶1时苯二酚选择性可以达到96.6%,但此时的苯酚转化率降低比较明显,仅为12.3%。为了保证苯酚的转化率在18%以上,故选取苯酚与H2O2的摩尔比为3∶1,此时苯酚的转化率为18.3%,苯二酚的选择性为88.8%。
2.4 第二溶剂用量的影响
苯酚羟基化反应是较强的放热反应,理论反应热约为260kJ·mol-1,计算表明可以造成反应体系60℃的绝热温升。试验过程发现,现工艺条件下,反应有45min的诱导期。诱导期过后,反应会突然加速。如果不能对反应过程进行有效撤热,体系会在数分钟内达到沸腾,温度为苯酚和水的共沸温度99.5℃左右。此时苯二酚的选择性大幅度降低,生成大量焦油。反应过程中,保持平稳的系统温度是得到高苯二酚选择性的关键。
该苯酚羟基化技术中,采用与水共沸温度为70℃的第二溶剂进行撤热。其优点是惰性,并且可以通过共沸过程将体系的反应热迅速移走,并使反应控制在71~75℃。
为了研究第二溶剂在体系中的确切作用,在水:苯酚质量比=3∶1、苯酚∶H2O2=3∶1、催化剂用量为苯酚质量的2.5%、反应温度75℃、反应时间120min的工艺条件下,实验考察了第二溶剂用量对催化剂性能的影响,结果见表1。

表1 第二溶剂用量的影响Tab.1 Effectof the second solvent dosage
从表1可以看出,第二溶剂用量的多少对苯酚的转化率和苯二酚的选择性影响不大。当完全不使用第二溶剂时,通过控制H2O2进料速度来控制反应速率,并利用夹套循环水进行反应撤热,得到了比使用第二溶剂时苯二酚选择性稍高的反应结果。以上实验事实说明,反应过程加入第二溶剂主要作用是使反应温度容易控制。如果有其它有效撤热手段,则完全可以不采用第二溶剂撤热。
3 撤热方式的研究
采用第二溶剂撤热的优点在于反应可以在常压下平稳进行,但主要缺点为:(1)第二溶剂汽化潜热较小,蒸发量大,对冷凝器性能要求高;(2)反应温度受到限制,不能在超过共沸点的温度下反应。(3)反应之后,需要对第二溶剂进行分离回收,既增加了分离能耗,同时不可避免会有少量损失,增加了生产成本。
鉴于第二溶剂撤热存在上述不利因素,且反应体系本身需要水作为溶剂,因此,采用水汽化方式移除反应热,不再添加第二溶剂。由于反应温度(70~75℃)低于水在常压下的沸点,因此需要在减压下进行反应。通过调节真空度,使水的沸点与反应温度一致。
同第二溶剂撤热相比,采用减压水汽撤热具有明显优势,主要表现在:(1)水的汽化潜热大,蒸发量小,对冷凝器性能要求低,并有利于反应温度控制和安全操作;(2)不存在溶剂的分离回收,降低了生产成本;(3)通过改变真空度,反应温度可调。通过改变真空度可以在不同温度下进行反应,便于优化反应温度。真空度与水的沸点(反应温度)之间的关系见表2。

表2 真空度与水和苯酚共沸点之间的关系(实测)Tab.2 Connection of vacuum and azeotropic pointofwater and phenol(actualmeasurement)
由于减压下水与苯酚存在共沸,因此,测定的沸点实际上是对应真空度下水与苯酚的共沸点,在表中真空度对应的共沸组成在6%~9%之间(以苯酚质量百分数计)。
采用真空撤热,在水∶苯酚质量比=3∶1、苯酚∶H2O2摩尔比=3∶1、催化剂用量为苯酚质量的2.5%、真空度0.069MPa、反应温度75℃、反应时间120min的工艺条件下,苯酚转化率为18.5%,苯二酚选择性89.0%。经过多次小试及3L小试放大实验证实,采用减压水汽蒸发的方法,撤热效果好,能够有效控制反应温度,操作简单方便,具有良好的工业应用价值。
4 结论
通过小试研究,以负载型铁系氧化物为催化剂,采用真空撤热,比较适宜的反应工艺条件为:反应温度75℃,反应时间120min,水∶苯酚质量比=3∶1;苯酚∶H2O2摩尔比=3∶1;催化剂用量为苯酚质量的2.5%;真空度为0.069MPa。在此条件下苯酚转化率为18.5%,苯二酚选择性为89.0%。
[1] 刘红,卢冠忠,胡宏玖.苯酚羟基化反应催化剂研究进展[J].应用化学,2003,32(2):4-8.
[2] 张淳,隆仲华,熊春荣,等.含铁复合金属氧化物对苯酚羟基化反应工艺的研究[J].化学世界,2000,(11):590-609.
[3] 吴通好,于剑锋,王国甲,等.苯酚过氧化氢羟化合成对苯二酚的Da-wson结构杂多化合物催化剂及其制备[P].CN:1048654C,2000-01-26.

