短小乳杆菌重组S-层蛋白质的纯化及其体外黏附性的初步鉴定
王彩凤,敖敦格日勒,小 琴,特尼格尔,赵 慧,格日勒图
(内蒙古农业大学兽医学院,内蒙古呼和浩特010018)
S-层蛋白质(S-layer protein,SLP)是指由一层晶格状排列的单分子蛋白或糖蛋白亚单位组成的胞浆外层结构[1]。它是位于某些革兰阳性细菌和革兰阴性细菌以及古细菌的细胞表面独特结构,其厚度通常约为5nm~15nm,分子质量约为40ku~200ku,而乳酸杆菌的S-层蛋白质分子质量相对较小,约为25ku~71ku[2]。与其他细菌的SLP 相比,乳酸菌SLP的显著特点是分子量小、等电点高。几乎所有SLP均可自组装成二维的倾斜的、正方形的、六边形的对称晶格结构,覆盖在整个菌体表面,以非共价键相互作用。
研究表明,无论是在溶液中还是多种固相载体上,SLP 可以在熵的驱动下自组装成晶格结构[3]。这一特点使其在纳米技术、纳米生物技术领域备受研究者青睐。如借助基因工程技术,将SLP 的基因克隆至合适的表达载体中,获得的重组SLP 的结构和性质并未发生变化[4]。甚至经过遗传改造,原本不具有黏附能力的乳酸菌,通过表达了SLP 以后可获得黏附能力[5]。在医学领域,乳酸杆菌SLP因其高度规则的结构,显著的黏附能力和自组装能力,可望发展为潜在的免疫治疗和预防的候选材料,如药物靶标、疫苗和活性抗原递呈载体[6]。此外,SLP可作为毒力因子在确定和维持细胞的形状上起作用[7],也可作为细胞黏附的介质物,也可作为未成熟树突状细胞和T 细胞的调节器[8],还可作为保护层,分子筛,胞壁质水解酶等发挥作用[9]。而乳酸菌的SLP在异源蛋白质的分泌性表达甚至表面展示等方面有着更广阔的应用前景。
本研究应用基因工程技术克隆短小乳杆菌(Lactobacillus brevis)内蒙古分离株的slp基因,获得其大肠埃希菌表达产物并进行鉴定,最后对纯化的重组SLP的黏附特性进行初步鉴定和分析。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒E.coliDH5α、E.coliBL21(内蒙古农业大学动物科学与医学学院实验研究中心分离并保存);乳酸乳球菌NZ9000(购自荷兰);载体pGEX-4T-3(Invitrgen);重组质粒pMD19T-slp(内蒙古农业大学动物科学与医学学院实验研究中心构建)。
1.1.2 主要试剂 普通质粒小提取试剂盒(TIANGEN),BCA 蛋白定量试剂盒(康为世纪公司),XhoⅠ、BamHⅠ、TaqDNA 聚合酶、T4DNA 连接酶、胶回收试剂盒(TaKaRa),鼠抗GST 血清(日本带广畜产大学原虫病研究中心制备),山羊抗鼠IgGHRP(Invitrogen),透析袋(上海西诺公司),96孔酶标板(康公司宁);其他化学试剂均为国产分析纯。
1.1.3 引物设计 应用Primer Premier v5.0生物软件设计以下一对引物:
P1:5′-GACGGATCCATCGTGAGCGCTGCTG-3′(划线部分为BamHⅠ酶切位点)
P2:5′-GCTCTCGAGCTAGAGATTGTAAACG-3′(划线部分为XhoⅠ酶切位点)。引物由上海桑尼生物科技公司合成。
1.2 方法
1.2.1 原核表达载体pGEX-slp 的构建及鉴定以重组质粒pMD19T-slp为模板,应用PCR 方法扩增出的片段,经BamHⅠ和XhoⅠ双酶切得到slp目的片段,插入到相同酶处理的原核表达载体pGEX-4T-3中,成功构建原核表达载体pGEX-slp并进行鉴定。
1.2.2 slp基因IPTG 诱导表达条件的优化 首先将重组质粒pGEX-slp和质粒pGEX-4T-3(空载体)转化至E.coliBL21感受态细胞中,在Amp抗性的LB平板上挑取阳性菌落,转接到3 mL LB 培养基中于37 ℃过夜培养,次日将此培养物按1∶100比例转接于20mL LB中,于37 ℃、200r/min摇菌培养至OD600nm 值为0.5~0.7 时,加入适量的IPTG(终浓度为1mmol/L)进行诱导表达5h。并按0h(加入IPTG 之前)、0.5、1、2、3、4、5h 各取1mL菌液留样,离心收集菌体,加入1×SDS-PAGE上样缓冲液制备样品,进行SDS-PAGE 分析。以同样的方法,将过夜培养物按1∶100 比例转接于5mL LB中,于37 ℃培养至OD600nm 值为0.5~0.7 时,加入不同终浓度的IPTG(0.5、1.0、1.5、2.0、3.0mmol/L)进行诱导表达5h。以同样的方法制备样品,进行SDS-PAGE分析。
1.2.3 Western blot鉴定重组融合蛋白GST-SLP根据1.2.2试验确定的最佳IPTG 诱导表达条件进行诱导,制备样品,首先进行SDS-PAGE 分析,然后按常规方法将凝胶转移到硝酸纤维素膜上。其中第一抗体为鼠抗GST 血清,第二抗体为山羊抗鼠IgG-HRP,底物为DAB。常规方法进行显色观察结果并记录。
1.2.4 纯化和鉴定重组融合蛋白GST-SLP 根据1.2.2试验确定的最佳诱导表达条件,将重组菌种转接于1 000mL LB中,于37 ℃200r/min培养至OD600nm 值 为0.5~0.7 时,加入终浓度为3.0mmol/L IPTG 诱导5h。离心收集菌体沉淀,用PBS(50mmol/L,pH 7.0)重新悬浮沉淀,超声裂解菌体,离心弃上清,沉淀悬浮于5 mol/L LiCl溶液,于4℃静置18h。离心取上清,于4℃将上清液在PBS 中透析18h,将透析液用蛋白质浓缩仪浓缩,用SDS-PAGE 检测纯化情况。并用BCA 试剂盒检测重组融合蛋白GST-SLP的浓度。
1.2.5 体外鉴定重组融合蛋白GST-SLP的黏附特性 30 ℃静置培养乳酸乳球菌NZ9000至第3代,将培养物离心弃上清,沉淀用PBS 洗2 遍,浊度调至OD600nm=1.0。每个样品3个重复,将该菌液加入96孔酶标板中4 ℃过夜包被,次日用30g/L脱脂乳封闭1.5h。加入纯化的重组融合蛋白GSTSLP,取4个浓度梯度(110.0、55.0、36.7、27.5μg/mL),常温结合1.5h。加入一抗溶液(鼠抗GST 血清,用30g/L脱脂乳按1∶1 000稀释),常温结合1.5h。加入二抗溶液(山羊抗鼠IgGHRP,用30g/L脱脂乳按1∶4 000稀释),常温结合1.5h。加入底物TMB 显色,振荡15s,室温静置15min,测OD652mm 值,再加终止液,测OD450mm值。本试验共设计3个对照组,分别去除了重组融合蛋白GST-SLP 与脱脂乳以及抗体与NZ9000表面、脱脂乳的非特异性结合的影响,最后算出4个浓度梯度下重组融合蛋白GST-SLP 与NZ9000表面特异性结合的净值,即4 个浓度梯度的样品组在450nm 处的净吸光值,以此作一柱图,并进行误差分析。
2 结果
2.1 重组表达质粒pGEX-slp的酶切鉴定
重组表达质粒pGEX-slp经BamHⅠ和XhoⅠ双酶切后,得到约1 200bp的目的基因片段和约5 500bp的载体片段(图1),与PCR 方法扩增出的1 200bp特异性条带大小相符(图2)。
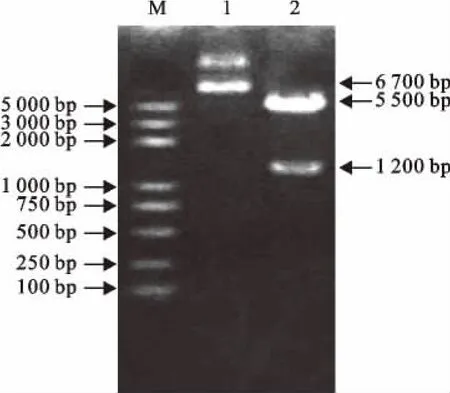
图1 重组质粒pGEX-slp的酶切鉴定Fig.1 Identification of the plasmid pGEX-slp by enzyme digestion
2.2 重组表达载体pGEX-slp最佳IPTG诱导表达条件的确定
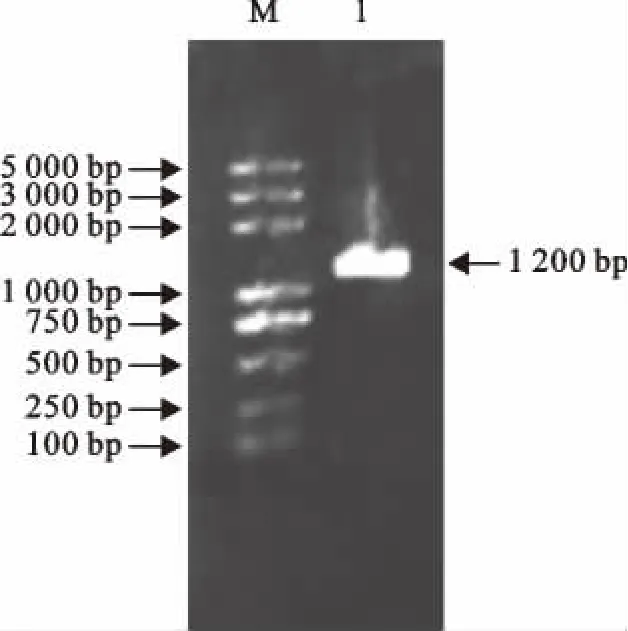
图2 slp基因PCR 产物Fig.2 PCR products of slp gene
经SDS-PAGE 方法检测,结果表明,成功表达了重组GST 蛋白和重组融合蛋白GST-SLP,其大小分别约为27ku 和71ku,与预计理论值大小相符。IPTG 诱导表达的最佳时间条件和最佳浓度条件分别为5h(图3)和3.0mmol/L(图4)。
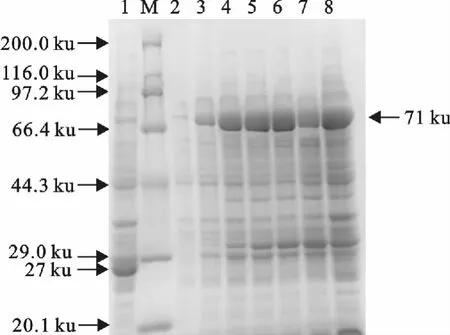
图3 不同时间IPTG 诱导表达的结果Fig.3 Expression results of different time induced by IPTG
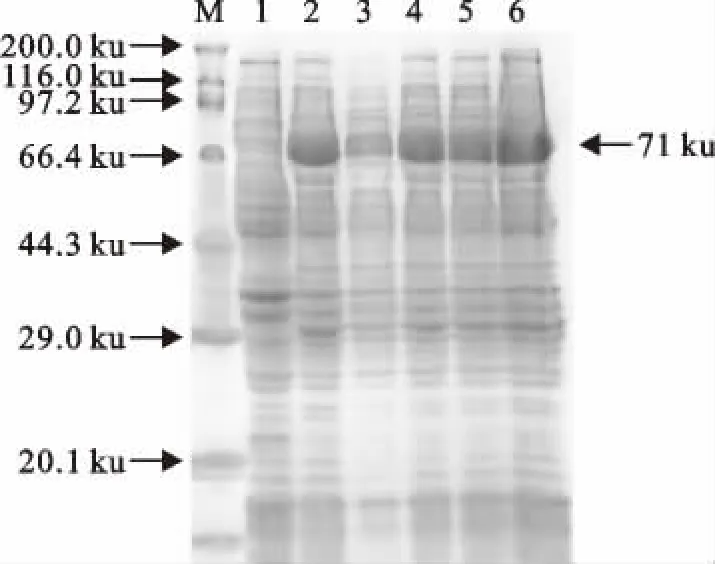
图4 不同浓度IPTG 诱导表达的结果Fig.4 Expression results of different IPTG concentrations
2.3 重组融合蛋白GST-SLP的Western blot检测结果
经Western blot检测,重组融合蛋白GST-SLP能被鼠抗GST 血清所识别,分别约在约71ku 和27ku处有特异性反应条带;而对照组重组GST 蛋白则在约27ku处同样出现了特异性的条带,该结果与实际情况相符合(图5)
2.4 重组融合蛋白GST-SLP的纯化结果
采用最佳的浓度和时间诱导条件进行大量诱导后,收集菌体沉淀,经超声波破碎、5mol/L LiCl溶液处理、透析、浓缩,得到纯化的蛋白样品,结果如图6所示,SDS-PAGE显示71ku处有一条优势条带,其浓度约为1.1mg/mL。
2.5 重组融合蛋白GST-SLP的ELISA 鉴定结果
根据4个浓度梯度的样品组在450nm 处的净吸光值作一柱图,分析重组融合蛋白GST-SLP 与NZ9000表面的黏附特性强弱,试验结果如图7 所示,显示呈阳性,可初步证明当重组融合蛋白GSTSLP浓度为110.0μg/mL 时,与NZ9000表面有较强的黏附特性;但是当浓度低时,它与NZ9000表面的黏附特性则较弱。
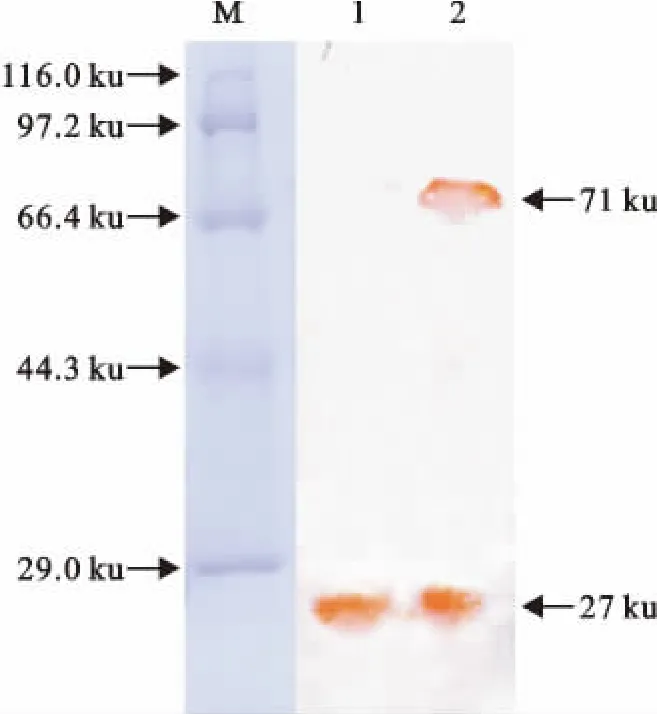
图5 表达产物的Western blot鉴定Fig.5 Analysis of the expressed products by Western blot
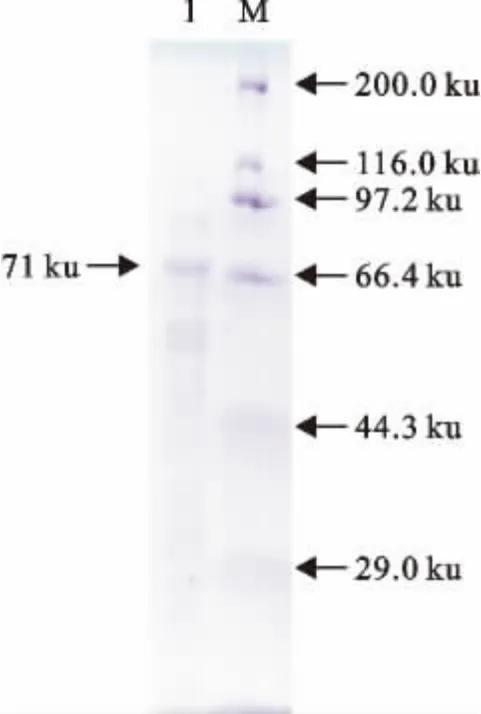
图6 纯化的重组融合蛋白GST-SLP的电泳分析Fig.6 SDS-PAGE analysis of purified recombinant fusion protein GST-SLP
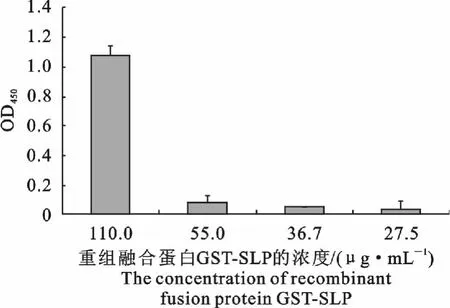
图7 重组融合蛋白GST-SLP的ELISA 分析Fig.7 ELISA analysis of recombinant fusion protein GST-SLP
3 讨论
细菌表面SLP 是体内和体外纳米生物技术应用方面的最优秀的候选蛋白,因为它具有自组装成二维晶格的能力,这种晶格形成了某些细菌表面的最外层结构[2,6,10]。乳酸杆菌作为人和动物消化道中重要的正常微生物,国外学者利用SLP的特性已在乳酸杆菌细胞表面成功展示了一些生物活性蛋白质或多肽,即通过基因工程方法使外源蛋白表达并展示到细菌的细胞外膜上[2]。据报道,乳酸杆菌对小肠的黏附作用与SLP 有 关[2,11-12]。Khang Y H等[6]利用短小乳杆菌SLP 黏附于肠上皮细胞的特性,成功利用短小乳杆菌重组SLP来介导抗体黏附于小牛肠细胞从而有效地预防了新生牛腹泻综合症。
本试验成功克隆了短小乳杆菌SLP 基因slp,原核表达并鉴定表达产物,最后对纯化的重组SLP的黏附特性进行了初步鉴定。应用PCR 方法正确扩增slp基因获得约1 200bp的片段,这与相关报道[13]的结果一致。用IPTG 诱导表达重组表达载体pGEX-slp,发现影响表达的主要因素包括:细菌生长期、细胞生长速率和IPTG 诱导浓度。因为细胞生长速率对外源蛋白的表达也有影响,所以诱导时机和诱导物的用量必须严格控制。而在生长不足或过度都会使外源蛋白降低表达量,甚至不表达。IPTG 的浓度适宜对表达外源基因十分重要,本试验已确定的IPTG 诱导表达的最佳温度为37 ℃,最佳IPTG 浓度为3.0mmol/L,最佳诱导时间为5h。
S-层蛋白以非共价键与宿主表面结合。为了研究乳酸菌S-层蛋白的一些性质,有时需要将其从细胞表面提取出来。常用的提取方法是高浓度变性剂处理的方法,如尿素、盐酸胍、氯化锂、金属螯合剂及阳离子置换剂等[14]。本试验采用的高浓度变性剂是氯化锂。由于S-层蛋白具有自我组装特性,因此提取的S-层蛋白液体透析去除变性剂后,又可以自动聚集为有活性的S-层蛋白。提取的S-层蛋白应用SDS-PAGE 方法进行了检测,结果显示在71ku处有一优势条带,证明本试验已获得了较高纯度的重组融合蛋白GST-SLP,这是进行其体外黏附特性的鉴定试验的前提条件。
重组SLP的体外黏附特性鉴定试验结果显示该蛋白质在高浓度时与NZ9000 表面黏附效果较强,而低浓度时黏附效果则较弱,这种浓度依赖性是与重组蛋白质纯化方法有关或是S-层蛋白其本身活性的改变导致或是融合外源性蛋白质的原因,尚需要进一步试验研究来证实。
[1]双 杰,包秋华,永 胜,等.几种乳酸菌S-层蛋白的普查以及slp基因的克隆与序列分析[J].中国乳品工业,2010,38(8):8-10.
[2]Hu Shumin,Kong Jian,Sun Zhilan,et al.Heterologous protein display on the cell surface of lactic acid bacteria mediated by the s-layer protein[J].Microbial Cell Factories,2011,10:1-13.
[3]Toca-Herrera J L,Krastev R,Bosio V,et al.Recrystallization of bacterial S-layers on flat polyelectrolyte surfaces and hollow polyelectrolyte capsules[J].Formation of Biomimetic Surfaces,2005,1(3):339-348.
[4]Sleytr U B,Egelseer E M,Ilk N,et al.S-layers as a basic building block in a molecular construction kit[J].FEBS,2007,274(2):323-334.
[5]Avall-Jaaskelainen S,Palva A.Surface display of the receptorbinding region of theLactobacillus brevisS-layer protein inLactococcus lactisprovides nonadhesive lactococci with the a-bility to adhere to intestinal epithelial ceUs[J].AEM,2003,69:2230-2236.
[6]Khang Y H,Park H Y,JeongY S,et al.Recombinant S-layer proteins ofLactobacillus brevismediating antibody adhesion to calf intestine alleviated neonatal diarrhea syndrome[J].J Microbiol Biotechnol,2009,19(5):511-519.
[7]王 凡,李晓清,刘 婷,等.乳酸杆菌S-层蛋白研究进展[J].中国饲料,2012,19(1):34-36.
[8]Konstantinov S R,Smidta H,de Vos W M,et al.S layer protein A ofLactobacillus acidophilusNCFM regulates immature dendritic cell and T cell flinctions[J].Mcrobiology,2008,105(49):19474-19479.
[9]Acosta M P,Palomino M M,Allievi M C,et al.Murein hydrolase activity in the surface layer ofLactobacillus acidophilusATCC 4356[J].Appl Environ Microbiol,2008,74(24):7824-7827.
[10]Heikki V,Ulla H,Helga B L,et al.Surface location of individual residues of SlpA provides insight into theLactobacillus brevisS-layer[J].J Bacteriol,2009,191(10):3339-3349.
[11]朱珊珊,崔 雯,任晓明,等.乳酸杆菌黏附作用的研究进展[J].中国畜牧兽医,2009,36(7):219-220.
[12]Silja A,Airi P.Lactobacillussurface layers and their applications[J].FEMS Microbiol,2005,29:511-529.
[13]Miia J V,Airi P.Isolation of surface(S)layer protein carryingLactobacillusspecies from porcine intestine and faeces and characterization of their adhesion properties to different host tissues[J].Vet Microbiol,2007,124:264-273.
[14]范郁冰.L.brevisM8S-层蛋白的黏附性及其引起Caco-2细胞蛋白质差异表达研究[D].湖南长沙:湖南农业大学,2012.

