三种生殖激素对滩羊卵母细胞体外成熟的影响
王 娟,孙 毅,程 龙,杨佳丽,石 娟,刘晓明,李 勇*
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
滩羊是我国独特的裘皮用绵羊品种,是国家二级动物保护品种,2001年被农业部列入第一批畜禽品种保护名录。其所产二毛皮毛色洁白,光泽悦目,花穗美观。滩羊羔羊肉脂肪分布均匀,肉质细嫩,腥味小,是“宁夏羊肉”的代表,已享誉全国。宁夏是滩羊的主产区,在保护滩羊种质资源特色的同时,对滩羊繁育性能的改良是宁夏滩羊产业发展的共性需求[1]。动物体细胞克隆技术为动物育种技术开辟了更广泛的途径,必将极大地提高动物育种的效率。也为我区动物育种产业的发展提供了技术支撑。
在体细胞核移植中体细胞必须在卵母细胞内进行重编程以恢复其全能性,而卵母细胞的成熟度则会直接影响体细胞的重编程。所以,卵母细胞的体外成熟,作为体细胞核移植过程中的一个重要环节被人们关注。自Edwards R G通过体外培养使小鼠、绵羊、猴、猪、牛、人[2]等哺乳动物的卵母细胞在体外获得成熟后,许多科研工作者在卵母细胞的体外成熟上做了大量的工作,通过在卵母细胞体外培养液中添加血清[3]、雌激素[4]、促卵泡素(folliclestimulating hormone,FSH)、促黄体素(luteinizing hormone,LH)[5]等物质,使哺乳动物卵母细胞体外成熟率得到不断提高。随着卵母细胞体外培养技术日益成熟,体外成熟的卵母细胞正在广泛应用于体外受精,用于扩繁优良母畜。在体细胞核移植等胚胎工程的各个领域,卵母细胞的成熟的效果,成为用于动物模型及生物反应器的生产的基础条件。但是,不同的物种在卵母细胞体外成熟中还存在一定的差异,而有关滩羊的卵母细胞成熟的研究尚未见到系统的报道,因此,本研究拟通过探讨不同浓度的FSH和LH及人绝经期促性腺激素(human menopausal gonaclotxopin,HMG)对滩羊卵母细胞体外成熟的影响,旨在建立滩羊卵母细胞体外成熟体系,为滩羊体细胞核移和滩羊分子育种和优良种畜扩繁奠定基础。
1 材料与方法
1.1 材料
1.1.1 滩羊卵巢 从屠宰场采集刚屠宰的母羊卵巢,放于加有青链霉素生理盐水的保温瓶中,30℃,4h内运回实验室。
1.1.2 试剂 FSH、LH 和17β-E2购自宁波第二激素厂,HMG购自丽珠制药公司;TCM199购自Gibco公司;青霉素、链霉素购自华北制药股份有限公司;胎牛血清购自HyClone公司;牛血清白蛋白(Bovine Serum Album,BSA),丙酮酸钠,谷氨酰胺,表皮生长因子,胰岛素-转铁蛋白-亚硒酸钠复合物Insulin-transferrin-sodium selenite media supplement,ITS),尿嘧啶,透明质酸酶均购自Sigma公司。
1.2 方法
1.2.1 卵丘-卵母细胞复合体(cumulus oocyte complexes,COCs)的采集 收集到的卵巢用37℃的灭菌生理盐水清洗1次,先剪去多余的脂肪和结缔组织,再用生理盐水冲洗3次~4次后,置于盛有采卵液培养皿中。切割法收集COCs细胞,将检出的COCs分为分为 A,B,C 3级:A级,卵丘细胞完整,卵母细胞胞质均匀;B级,卵丘细胞不完整,卵母细胞胞质均匀;C级,卵母细胞裸露,或胞质略有退化。选择A级和B级进行培养。
1.2.2 卵母细胞的体外成熟培养 将收集到的A级、B级COCs用洗卵液清洗3次~4次,然后置于预平衡2h~3h含1mL成熟液的U型皿中,进行体外成熟培养。培养条件为38.5℃,体积分数为5%CO2,饱和湿度,培养22h~24h。
采卵液:TCM199+2.5mg/mlL 肝素钠+50mL/L FBS;洗卵液:TCM199+20mL/L FBS;基础成熟液(maturation medium,MM):TCM199+10mg/mL BSA +100×ITS+50ng/mL EGF +1.5μg/mL 17β-E2+ 50 μg/mL尿嘧啶+2.5mmol/mL谷氨酰胺+1mmol/L丙酮酸钠;卵母细胞成熟液(oocyte maturation medium,OM )Ⅰ:MM+100μg/mL FSH+20μg/mL LH;OMⅡ:基础成熟液+200μg/mL FSH+40μg/mL LH;OM Ⅲ:基础成熟液 +300μg/mL FSH+60μg/mL LH;OM Ⅳ:基础成熟液+0.05IU/mL HMG;OMⅤ:基础成熟液+0.1IU/mL HMG;OMⅥ:基础成熟液+0.15IU/mL HMG;OM Ⅶ:基础成熟液+0.2IU/mL HMG;基础成熟液组即为对照组。收集到的卵母细胞分6组使用不同的培养液进行体外成熟培养,同一试验组重复3次~5次。
1.2.3 卵母细胞的成熟判定 将成熟培养后的COCs置于含3g/L透明质酸酶的D-PBS液内,用移液器轻轻吹打以除去成熟卵母细胞表面的卵丘细胞。在体视显微镜下,以异物针拨动卵母细胞进行观察,观察第一极体是否排出,来判定卵母细胞成熟。
1.2.4 试验设计 以成熟培养液不加激素为对照组,在成熟培养液中分别添加100μg/mL FSH+20μg/mL LH、200μg/mL FSH+40μg/mL LH、300μg/mL FSH+60μg/mL LH、0.05IU/mL HMG、0.1IU/mL HMG、0.15IU/mL HMG、0.2IU/mL HMG等,不同激素浓度为试验组,将卵母细胞成熟培养研究不同激素浓度对卵母细胞体外成熟的影响。每组试验进行5次避免人为因素造成的差异。
1.2.5 数据处理 结果用卡方检验进行差异显著性分析。
2 结果
2.1 添加不同浓度FSH和LH时滩羊卵母细胞体外成熟结果
在成熟液中添加不同浓度的FSH和LH对滩羊卵母细胞体外成熟有不同程度的影响,COCs在体外培养22h时,都可以观察到卵丘细胞不同程度的扩散(图1)。随着添加激素浓度的升高,卵丘细胞扩散度增加,其中扩散直径,空白对照(图1A)<OMⅠ(图1B)<OMⅠ(图1C)<OMⅢ(图1D)。但试验中发现,当激素FSH>300μg/mL,LH>60μg/mL时,卵丘细胞的扩散直径不再增加,这表明,添加激素对滩羊卵母细胞的卵丘细胞细胞扩散有着一定的影响作用。同时运用imageJ2x软件测定不同激素浓度下卵母细胞在卵丘细胞包裹中的投影计算激素对卵母细胞的影响。测定结果运用SPSS软件分析,结果表明不添加激素的对照组的扩散距离与OMⅠ、OMⅡ和OMⅢ的扩散距离差异性显著。OMⅠ、OMⅡ和OMⅢ的扩散距离差异性不显著。但OMⅡ中的卵母细胞扩增距离优于OMⅠ和OMⅢ中的卵母细胞扩增距离,如图2显示(扩散直径对应图1次序)。
另外,在滩羊卵母细胞成熟培养液中添加不相同浓度的FSH和LH对卵母细胞成熟率不同,成熟培养液中加入100μg/mL FSH和20μg/mL LH成熟率为57.9%,与对照组差异显著(P<0.05)。添加200μg/mL FSH和40μg/mL LH的OM Ⅱ成熟率为68.8%,与对照组差异显著(P<0.05)。添加300μg/mL FSH和60μg/mL LH的OMⅢ成熟率54.6%,与对照组差异显著(P<0.05)(表1)。OMⅡ的成熟率与OMⅠ和OMⅢ的成熟率差异显著(P<0.05)。该结果说明,成熟液中适度FSH和LH的浓度变化对滩羊卵母细胞体外成熟有着非常重要的影响,过高的激素浓度对卵母细胞的成熟有抑制作用。
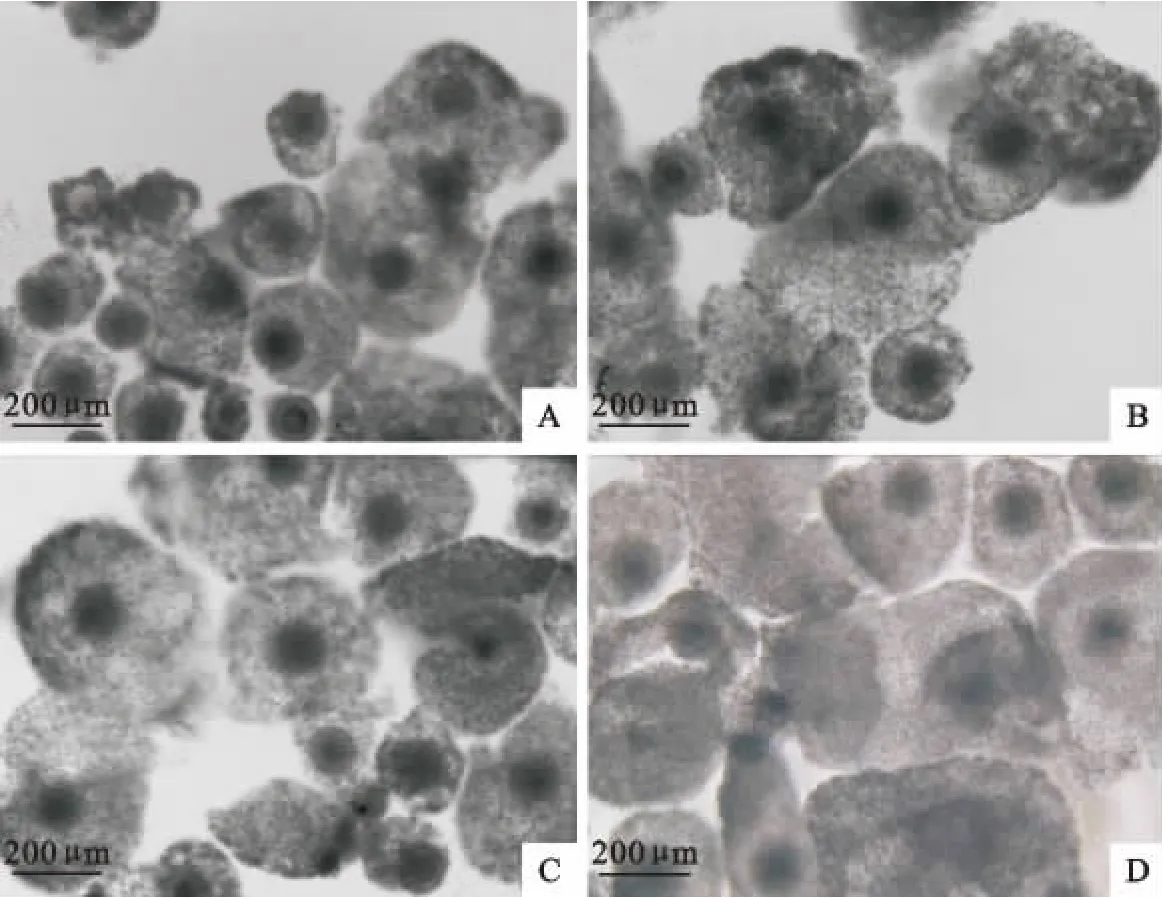
图1 FSH与LH对滩羊卵丘-卵母细胞复合体扩散度的影响(40×)Fig.1 The effects of FSH and LH on Tan sheep cumulus-oocyte complexes in vitro(40×)
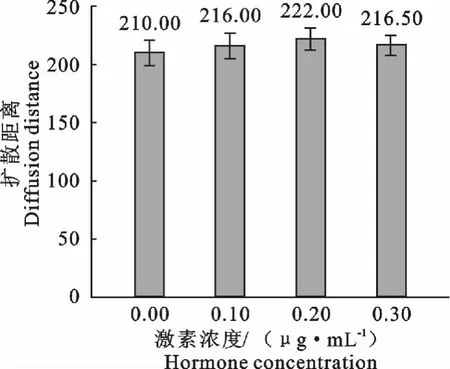
图2 不同FSH和LH激素浓度卵母细胞的扩散距离(扩散直径对应图1次序)Fig.2 The oocyte diffusion distance(Diffusion diameter corresponding figure 1order)in different FSH and LH concentrations
2.2 添加HMG时卵母细胞体外成熟结果
在卵母细胞体外成熟培养液中添加HMG(FSH∶LH≈1∶1)可替代FSH和LH激素的添加,不同HMG浓度也可促进COCs的扩散(图3),在培养22h后卵丘细胞扩散直径表现为对照组(图3A)<OM Ⅳ(图3B)<OM Ⅴ(图3C)<OM Ⅵ(图3D)<OMⅦ(图3E)。随着激素浓度增加扩散直径也在增加,但当浓度大于0.2IU/mL浓度时扩散度不再增加。同样运用ImageJ2x软件测定各组成熟液中的卵母细胞扩增距离显示,不加激素的对照组与添加激素的OM Ⅳ、OM Ⅴ、OM Ⅵ、OMⅦ各组中卵母细胞的扩增距离差异显著(P<0.05)。添加激素的各组之间差异不显著(P>0.05)。如图4显示(扩散直径对应图3次序)。
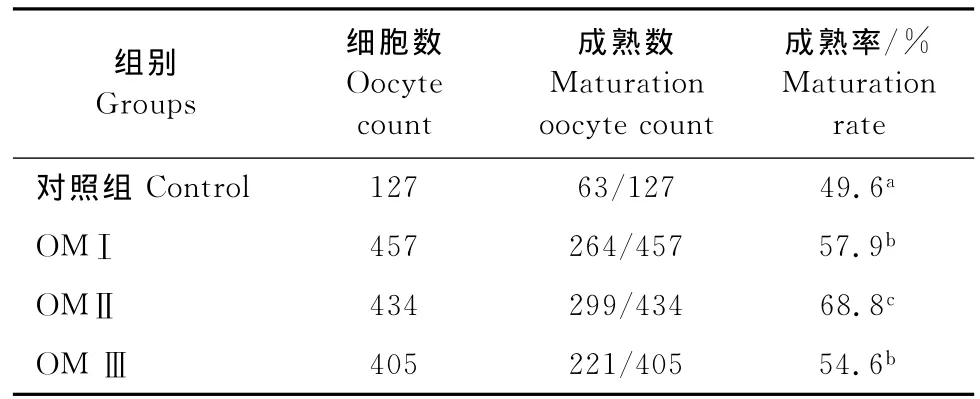
表1 不同FSH和LH浓度对滩羊卵母细胞体外成熟的影响Table1 The effects of FSH and LH concentration on in vitro maturation of tan sheep oocytes
在成熟培养液中添加不同浓度的HMG,卵母细胞的成熟率不同(表2)。其中添加0.1IU/mL HMG的成熟液的成熟率为69.6%,与对照组差异显著(P<0.05)。这表明0.1IU/mL HMG添加培养液中有利于卵母细胞的成熟。

图3 HMG对卵丘-卵母细胞复合体(COCs)扩散的影响(40×)Fig.3 The effects of HMG on Tan sheep oocyte maturation in vitro(40×)
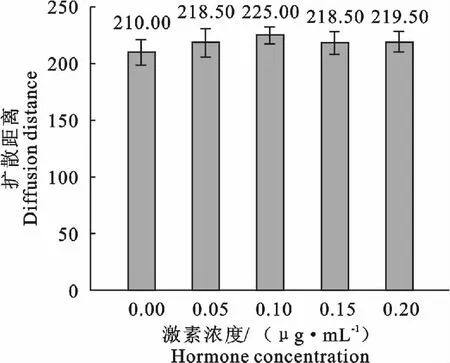
图4 不同HMG激素浓度卵母细胞的扩散距离(扩散直径对应图3次序)Fig.4 The oocyte diffusion distance in different HMG hormone concentrations(Diffusion diameter corresponding figure 3order)
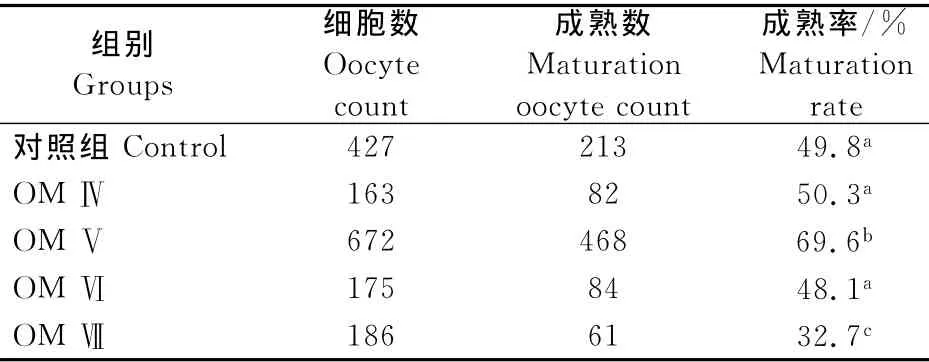
表2 HMG浓度对滩羊卵母细胞体外成熟的影响Table2 The effects of HMG concentration on in vitro maturation of Tan sheep oocytes
3 讨论
哺乳动物卵母细胞体外成熟培养技术是利用类固醇激素和促性腺激素在体外模拟卵泡的环境,进而诱发卵母细胞成熟的一项试验研究。在卵母细胞成熟过程中,促卵泡素FSH和出黄体素LH等促性腺激素素具有协同作用,共同调节卵母细胞成熟。研究表明,FSH能显著提高体外成熟卵母细胞的体外受精能力及早期胚胎的发育能力,其中FSH与诱导卵丘扩散、暂时抑制GVBD,改变了第一次减数分裂所需的时间,从而促进了卵母细胞的成熟。LH也有类似作用,另一方面通过除去成熟分裂抑制因子而对卵母细胞发挥作用[6]。
FSH在卵泡发育中起至关重要的作用,它通过cAMP途径促进卵丘细胞增生并产生相应的LH受体[7]促使卵丘细胞膨散,通过刺激颗粒细胞分泌成熟促进物,直接或间接地作用于卵母细胞,启动卵母细胞成熟分裂[8],将FSH加入培养基中促进人卵母细胞体外成熟,获81%的成熟率[9]。对于LH,一般认为通过两条途径发挥作用:一是引起卵丘发生变化,促进卵丘细胞扩散,可以促进颗粒细胞上孕酮受体的表达及孕酮的产生,孕酮通过Connexin 43导致GVBD便于精子通过卵丘细胞间隙到达透明带[10];二是显著增强了卵母细胞的存活力,降低异常卵母细胞的数量,从而提高卵母细胞的受精率[11]。
即使同一种动物,在卵母细胞体外成熟中,所添加FSH和LH剂量的报道也不尽相同。如在绵羊,Obrien J K 等[12]添加 FSH/LH 的量为10μg/mL,Andrew等的添加量为5μg/mL,Daniel等的添加量为LH 10μg/mL,FSH 1μg/mL。本试验结果表明在成熟液中添加激素FSH和LH可以获得不同的卵母细胞成熟率(68.8%~54.6%),在 FSH/LH 小于200μg/40μg/mL,随着激素浓度增加成熟率呈浓度正相关。但当激素浓度大于300μg/60μg/mL,表现出对卵母细胞成熟的抑制作用。同样,添加HMG单位浓度在小于0.1IU/mL时,卵母细胞的成熟率表现为正相关,但当其浓度大于0.1IU/mL下,卵母细胞的成熟表现为抑制作用,这与敖红等[13]在绵羊上的研究结果相似。HMG含有1∶1(U)的FSH和LH,可用来代替FSH和LH用于山羊和牛卵母细胞的成熟培养[14]。本研究比较了FSH和LH配合使用或HMG单独使用时对滩羊卵母细胞体外成熟的影响。结果表明,200μg/mL FSH和40μg/mL LH配合使用对卵母细胞的成熟的效果稍差于0.1IU/mL HMG添加效果,这与赛务家甫的研究结果略有不同[15],推断差异可能是由于激素的不同生产厂家造成的。
综上所述,在卵母细胞体外成熟中,添加200μg/mL FSH和40μg/mL LH与或添加0.1IU/mL HMG的成熟培养体系在滩羊卵母细胞体外成熟中效果良好,为进一步进行滩羊卵母细胞的应用试验奠定了基础。
[1]孙晓萍,郎 侠,杨博辉,等.提高滩羊繁殖性能的几种方法[J].畜牧与饲料科学,2010,31(3):91-92.
[2]Edwards R G.Maturation in vitro of mouse,sheep,cow,pig,rhesus,monkey and human ovarian oocytes[J].Nature,1965,208:349-351.
[3]武 浩.小鼠,山羊交互异种核移植研究[D].陕西杨凌:西北农林科技大学,2004.
[4]石德顺,卢克焕.牛卵泡液对牛卵母细胞体外成熟的影响[J].广西农业大学学报,1994(13):1-5.
[5]徐建祥,周木清,陈小武,等.不同条件对牛卵母细胞体外成熟的影响[J].黑龙江动物繁殖,1996,4(2):13-14.
[6]Iwata H,Akamatsu S,Minami N,et al.Allopueinol,an inhibitor of xanthine oxidase improves the development of IVM/IVF bovine embryos(>4cell)in vitro under certain culture econditions[J].Theirogenology,1999,51:613-622.
[7]侯文庆.卵泡发育的激素调节研究进展[J].上海兽医畜牧通讯,2001(2):67-69.
[8]Zhang L,Jing S W,Ozniak P J,et al.Cumulus cell function during bovine oocyte maturation,fertilization and embryo development in vitro[J].Mol Reprod Develop,1995,40:338-341.
[9]谢常青,林 戈,杨苏安,等.人类不成熟卵母细胞体外成熟影响的因素初探[J].生殖与避孕,2000,20(3):6-7.
[10]Masayuki S,Takat O T.FSH and LH induce progesterone production and progesterone recept or synthesis in cumulus cells:are quirement for meiotic resumption in porcine oocytes[J].Mol Human Reprod,2002,8(7):612-618.
[11]Roberts R,Iatropoulou A,Ciantar D,et al.Follicle-stimulat-ing hormone affects metaphase I chromosome alignment and increases aneuploidy in mouse oocytes matured in vitro[J].Biol Reprod,2005,72(9):107-118.
[12]O'Brien J K,Catt S L,Ireland K A,et al.In vitro and in vivo developmental capacity of oocytes from prepubertal and adult sheep[J].Theriogenology,1997,47:1433-1443.
[13]敖 红,孙桂金,尹逊河,等.绵羊卵母细胞体外成熟的研究[J].中国草食动物,2006,25(6):14-16.
[14]李雪峰.牛卵母细胞孤雌激活与体细胞核移植[D].陕西杨凌:西北农林科技大学,2001.
[15]赛务家甫.提高绵羊体细胞核移植效率的研究[D].陕西杨凌:西北农林科技大学,2007.

