兔骨髓来源的内皮祖细胞体外培养及鉴定
刘丹平,赵辉,齐鑫
(1.辽宁医学院附属第一医院;2.辽宁医学院,辽宁 锦州 121001)
内皮祖细胞 (Endothelial Progenitor Cells,EPCs)是一类来源于骨髓,存在于外周血中循环中,并且可以在生长因子的作用下可分化为内皮细胞(ECs)的前体细胞,也被称为血管母细胞。它和造血细胞来源于同一前体细胞,这一前体细胞被称为造血干/祖细胞[1]。EPCs 多持续存在于骨髓、外周血、脐带血和胎儿肝脏中,其中又以骨髓和脐带血中含量最高且增殖能力最强,因此常常作为获得EPCs 的重要来源[2]。本实验通过密度梯度离心联合差速贴壁法获取EPCs,并进行培养及鉴定。
1 材料与方法
1.1 主要材料 1 w 龄幼兔(辽宁医学院动物实验中心提供)、10%胎牛血清(Hyclone)、DMEM 培养液(Sigma)、M199 培养液(Hyclone)、EGF (英国PeproTech)、血管内皮生长因子VEGF (英国Pepro-Tech)、碱性成纤维细胞生长因子bFGF (英国Pepro-Tech)、淋巴细胞分离液(天津灏洋生物公司)、胰蛋白酶(Hyclone)、FITC 标记的荆豆凝集素(美国Sigma)、DiI 标记的乙酰低密度脂蛋白(美国Vector)、人纤维连接蛋白(美国Chemicon)、羊抗兔CD34 抗体、羊抗兔CD133 抗体、羊抗兔VEGFR-2/KDR 抗体、FITC 标记的羊抗IgG (美国SantaCruz)等。
1.2 方法
1.2.1 BMSCs 的分离 取1 w 的兔四肢长骨,直接用PBS 冲出骨髓,将冲出的骨髓液收集在带刻度的离心管中,800 rpm×5 min,可见分3 层,上层为脂肪等杂质,中层为PBS,下层沉淀为骨髓及血细胞。留取下层沉淀,加入4 mL 培养基,用吹打管混匀,在带刻度离心管中加入4 mL 淋巴细胞分离液,用滴管取混匀后的骨髓液,沿管壁缓慢叠加于分层液面上,注意保持清楚的界面。水平离心2000 rpm×20 min。离心后管内液体分为3 层,上层为血浆和PBS 液,下层主要为红细胞和粒细胞,中层为淋巴细胞分离液,在上、中层界面处有一以单个核细胞(MNCs)为主的白色絮状狭窄层。用枪头插到絮状层,吸取MNCs。用PBS 洗涤2 次(1000 rpm 离心5 min),弃上清,DMEM 完全培养液(含体积分数为10%的胎牛血清、青霉素100 U/mL、链霉素100 U/mL)重悬细胞,接种于培养瓶里,在37 ℃、5%的CO2饱和湿度培养箱中培养。
1.2.2 BMSC 向EPCs 的诱导培养 原代骨髓间充质干细胞培养48 h 后首次换液,获取未贴壁的细胞,1000 rpm 离心10 min,然后重悬在M199 培养基中(含有10%胎牛血清,10 μg/LVEGF、2 μg/LbFGF、10 μg/LEGF)。接种在预先包被有人纤维连接蛋白(HFN)的培养瓶中,37 ℃,5%CO2的湿度培养箱中培养。3 d 后首次换液,去除其中不贴壁细胞,以后每隔3~4 天换液1 次。当细胞融合达到80%~90%时可传第1 代,以后每8~10 天可传1 代。
1.2.3 骨髓来源的EPCs 鉴定 (1)细胞形态观察 倒置相差显微镜下,每日观察细胞生长情况和形态学变化;(2)流式细胞检测 取消化培养的P3 代细胞,离心后去上清液,PBS 稀释并计数;将细胞悬液以每管1 ×105个细胞,分装于各个流式管,预先设定空白对照管、单纯二抗管及CD133、CD34、VEGFR-2 各1 管;用PBS 洗涤后离心2 次,完全去血清后,加入300 μL 的PBS,加1 μL 的CD133、CD34、VEGFR-2 的一抗,避光保存30 min;加入1 mL 的PBS 离心去上清后,加入300 μL 的PBS,加入1 μL FITC 标记的二抗,避光存放30 min;加入1 mL 的PBS 离心去上清后,每管加入150 μL 的PBS 准备进行流式细胞仪检测;(3)DIL-ac-LDL 及FITC-UEA-1 双荧光标记 原代细胞传代后,培养至第10 d,取消化培养的细胞,离心后去上清,PBS 漂洗2 min,2次;加入5 mL DIL-ac-LDL (10 μg/mL),37 ℃孵育1 h;PBS 漂洗2 次;2%多聚甲醛固定细胞10 min;PBS 漂洗2 次;加入5 mL FITC- UEA-1(10 μg/mL),37 ℃孵育1 h。用激光共聚焦显微镜观察。DIL-ac-LDL 和FITC-UEA-1 双染色阳性细胞被认为是EPCs。
2 结 果
2.1 光镜下观察细胞的形态 培养48 h 后即出现梭形细胞。第4 d 换液后可见细胞集落形成,中央为圆形细胞,梭形贴壁细胞从集落中央以放射状向外周生长(见图1)。1 w 以后细胞生长旺盛,集落边缘细胞呈纺锤形近似单层生长。培养约7~10 d 成片生长的细胞集落相互连接,呈典型的“鹅卵石“样外观铺满培养瓶(见图2)。2 w 左右可见由多个细胞首尾相连呈鱼贯样排列或两排细胞平行排列呈条索状或管状结构(见图3)。
2.2 流式细胞检测 结果见图4。
2.3 DIL-ac-LDL 及FITC-UEA-1 双荧光标记细胞的免疫荧光鉴定:将细胞玻片置于激光共聚焦显微镜下观察,发现细胞既能与UEA-1 结合显示绿色荧光,又能吞噬ac-LDL 而使胞浆显示红色荧光。因而在镜下显示红绿双荧光的细胞即认定为EPCs (见图5)。
3 讨 论
研究表明,存在于哺乳动物外周血、骨髓中的内皮祖细胞(EPCs)是一类能定向增殖分化为成熟血管内皮细胞的前体细胞,是干细胞分化成熟过程的一个阶段,目前大多数学者将 CD34+/CD133+/VEGFR-2+的细胞普遍定义为EPCs[3]。EPCs 具有促进新生血管形成及提高微血管密度、促进内皮再生和提高血管通畅率等作用;不仅参与胚胎期的血管发育,也在成体血管新生及维持内皮细胞修复中起着重要的作用[4]。
EPCs 体外培养最初是用免疫磁珠分离出目标细胞群(CD34+、CD133+、VEGFR2+细胞或任意组合)然后采用贴壁培养法获得。这种方法虽然得到的细胞较纯,但数量少,满足不了实验研究的需要,且费用昂贵、操作复杂[5]。本实验利用密度梯度离心联合差速贴壁法获取EPCs,得到的细胞数量较多,操作较简单,经过鉴定后基本可以满足研究要求。首先通过密度梯度离心法从兔骨髓中分离出单个核细胞,在DMEM 培养基中,向间充质干细胞分化,利用MSCs 常在48 h 内贴壁而EPCs 贴壁时间较长的特点,在48 h 后获取未贴壁的细胞,离心后置于含有VEGF、EGF、bFGF 的M199 培养基中培养,3~4 d 换液,观察细胞形态。进过鉴定后,符合EPCs 的特点。
目前对于EPCs 的鉴定还没有统一标准,通常是根据内皮细胞的特性对其进行鉴定。包括细胞形态、表面标记及细胞功能三方面。典型的内皮细胞为长梭形,可成“铺路石样”形态密集排列。EPCs 的常用表面标志有:VEGFR- 2、CD34、CD133 等。功能鉴定包括分析结合UEA-1 及摄取ac-LDL 的能力[6-7]。因此本研究所培养的细胞进行了这三方面的检测。
通过一系列的细胞鉴定显示,本实验所采用的培养方法能够在体外成功培养 扩增具有典型特征的EPCs,且操作较简便具,能够满足研究需要。同时以骨髓作为细胞来源又可实现自体移植,为“细胞学治疗”及EPCs 的进一步研究打下了基础。
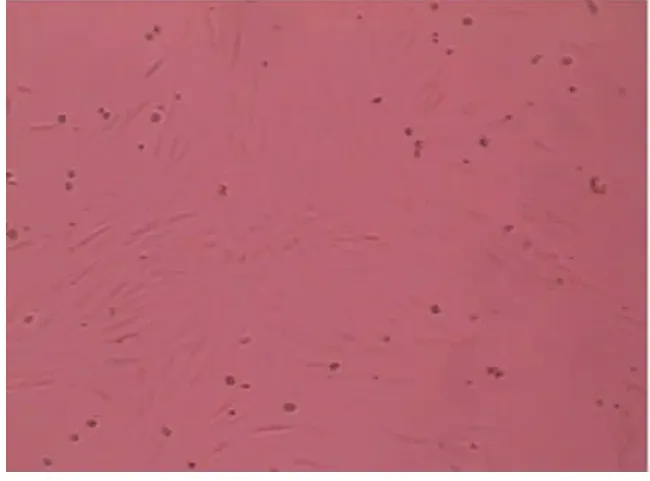
图1 4 d 后可见集落形成

图2 7~10 d 可见类似“铺路石”样形态
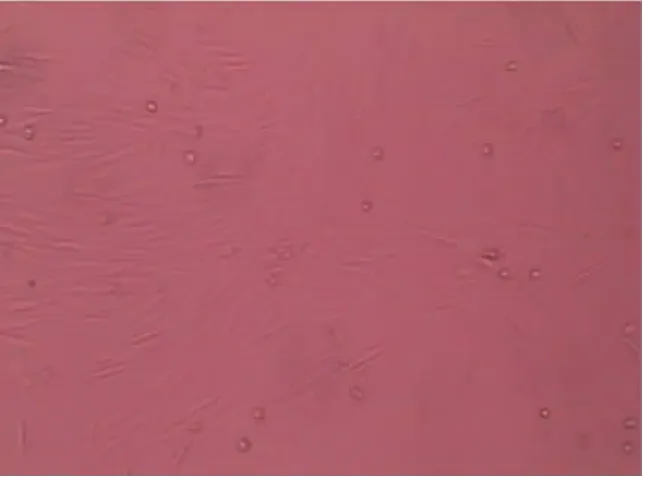
图3 2 w 左右可见由多个细胞首尾相连呈鱼贯样排列
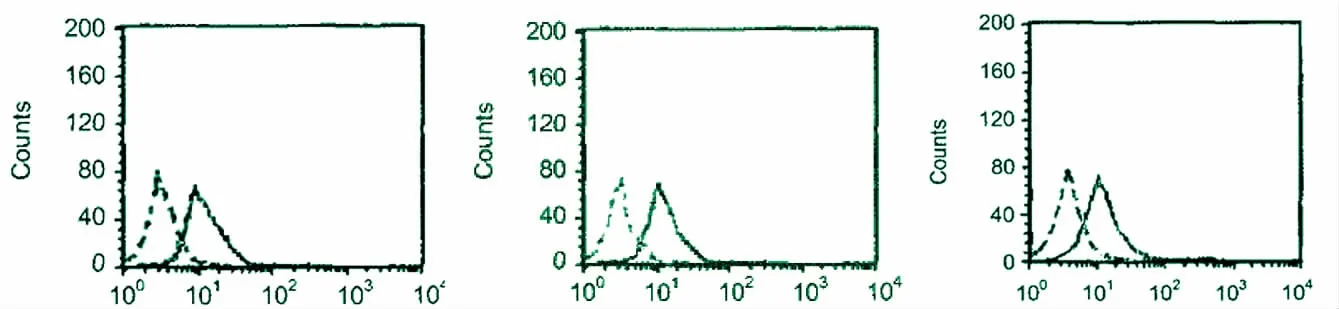
图4 三种表面标记抗体的阳性率
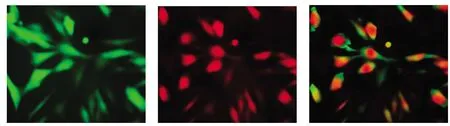
图5 细胞的免疫荧光鉴定
[1]Keramaris NC,Kaptanis S,Moss HL,et al.Pneumaticos S,Maffulli N.Endothelial progenitor cells (EPCs)and mesenchymal stem cells (MSCs)in bone healing [J].Curr Stem Cell Res Ther,2012,7 (4):293-301.
[2]Rumpold H,WOlf D,Koeck R,et a1.EndotheloiaI progenitor cell:a source for therapeutic vasculogenesis [J].CeMoI Med,2004,8 (4):509-518.
[3]Wu B,Lu ZM,Wang Y,et al.Isolation,culture and identification of rabbit bone marrow-derived vascular endothelial progenitor cells.Zhongguo Shi Yan Xue Ye Xue Za Zhi.2010,18(2):454-457.
[4]Li DW,Liu ZQ,Wei J,et al.Contribution of endothelial progenitor cells to neovascularization [J].Int J Mol Med,2012,30 (5):1000-1006.
[5]于德水,吕刚,曹阳,等.BMSCs 移植对大鼠脊髓损伤后VEGF 表达及细胞凋亡的影响[J].中国矫形外科杂志,2011,08:658-661.
[6]Kalka C,Masuda H,Takahashi T,et al.Transplantation of exvivo expanded endothelial progenitor cells for therapeutic neovascularization [J].Proc Natl Acad Sci USA,2000,97(7):3422-3427.
[7]Kawamoto A,Gwon HC,Iwaguro H,et al.Therapeutic potential of exvivo expanded endothelial progenitor cells for myocardial ischemia [J].Circulation,2001,103 (5):634-637.

