急性肝功能不全小鼠对不同pH 值氨的耐受性
林丽萍,张金添,朱婷婷,李继香,林丽晶,方梦寒,林弘月,郑剑聪
(莆田学院医学院,福建 莆田 351100)
临床中严重肝病患者,若出现上消化道大出血的并发症,造成消化道内蛋白质的增多,可因细菌分解蛋白质产氨增多;高蛋白饮食,未经完全消化的蛋白成分在肠道潴留;肝硬变晚期合并肾功能障碍,通过肾脏排出的尿素减少,弥散入肠增加;以上因素均可使肠道的产氨量增加,诱发肝性脑病的发生[1]。因此,减少肠道氨的量及浓度可减少肝性脑病的发生发展[2]。本实验通过化学毒物四氯化碳制作小鼠急性肝功能不全模型[3],观察造模期间小鼠的生理变化及病理检查变化[4],给予不同pH 值氨的溶液后肝性脑病临床表现出现的快慢及严重程度,以及急性肝功能不全小鼠对不同pH值氨的耐受性[5]。
1 试剂与材料
1.1 试剂
四氯化碳(分析纯 中国东阳化工厂),植物油(市售花生油),甲醛溶液(分析纯 福建省三明市三圆化学试剂有限公司)
1.2 动物
SD 小鼠(上海斯莱克实验动物有限责任公司),体重约15~25 g,购于福建疾病控制中心。标准饲料,饮水不限。适应喂养后开始实验。
2 方 法
2.1 动物分组及处理
(1)随机选取SD 小鼠50 只,随机分为A、B、C、D、E 组,每组10 只,并标记如A1、A2…A10 等,A、B、C、D 组造模做实验组,E 组正常喂食作为正常对照组,不做其他处理,直至取肝组织做病理;(2)将标记好的小鼠称重并按10 mL/kg 的剂量给予实验组小鼠0.4%四氯化碳花生油溶液,记录注射时间并观察注射后小鼠的一般状态;(3)距上次给药后42 h 开始禁食6 h,再灌胃给予原剂量的0.4%四氯化碳花生油溶液; (4)24 h后,重复第(2)、(3)步;(5)并于6 h 后开始禁食6 h,再次称量小鼠并记录,再通过灌胃给予0.4%四氯化碳花生油溶液;(6)从末次给药开始禁食不禁水16 h 后按0.5 mL/10g 分别腹腔注射给予A 组0.3 mol/L (pH =5)的氯化铵溶液、B 组pH=7 的氯化铵溶液、C 组pH =9 的氯化铵溶液、D 组pH=7 的生理盐水溶液;(7)经第6 步后观察肝性脑病表现,再将实验组小鼠及对照组小鼠脊髓离断处死,解剖取肝脏用10%甲醛溶液固定做病理切片检查(HE 染色)。
2.2 检测指标
观察一般状况: (1)造模期间小鼠的一般生理状况及变化:包括毛色变化、饮食饮水状况、排便排水、活动等; (2)实验组与对照组的肝脏肉眼观察及显微病理变化;(3)给予不同pH 的氯化铵溶液后小鼠出现角膜消失、抽搐出现、朴翼样震颤和角弓反张等临床表现的严重程度及快慢[4]2849-2851。
2.3 统计方法
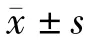
3 结 果
3.1 一般生长状况
实验组小鼠造模期间总共死亡3 只,进食减少,毛色黯淡,行动迟缓,尿黄,有的小鼠体重减轻,总的体重增幅明显小于正常对照组,正常对照组小鼠无死亡,生长状况良好,反应灵敏,毛色光滑,饮食饮水排便正常。
3.2 给予不同pH 值的氯化铵溶液后结果如下。
3.2.1 一般状况
实验组各组出现不同程度的兴奋性先增高后降低如光声刺激先增强后减弱,舔嘴、啄米样动作、作呕表现,行动迟缓且偶有跨阈步态,意识障碍,尿黄色乳糜状,翻正反射消失,角膜反射消失,扑翼样震颤,角弓反张,进而出现死亡或症状转缓等变化。A、B、C 组结果见表1,D 组虽有肝功能不全的模型基础,但给予生理盐水后无明显异常,死亡率为零。
3.2.2 组织病理学检查
(1)大体改变(图1):①实验组:肝脏颜色变浅,质地较坚韧,表面凹凸不平有细小颗粒状,无光泽,边缘圆钝,肝脏体积变小;②对照组:肝脏颜色鲜红,肝缘锐利,肝实质柔软,表面光滑细腻有光泽;(2)肝组织病理切片HE 染色光镜下观察:①实验组:肝小叶结构紊乱,可见局部肝实质缺损,肝细胞坏死。肝细胞脂肪变性及水样变性,汇管区及坏死区大量炎性细胞浸润 (见图2A、B);②对照组:肝小叶结构正常,肝细胞排列规整,无脂肪浸润,无变性坏死,汇管区无炎性细胞浸润(见图2C、D)。
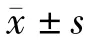
表1 急性肝功能不全小鼠肝性脑病临床表现的出现时间(,n=10)
3.3 急性肝功能不全小鼠肝性脑病临床表现出现时间的方差分析
4 讨 论
化学毒物四氯化碳可特异性引起肝损害,将其溶于植物油,经灌胃及腹腔注射给药制作急性肝功能不全模型[6]。四氯化碳造成肝细胞损伤的机制可能是自由基的形成及引发的链式过氧化反应,产生自由基- CCl3,发生脂质过氧化,使内质网改变,溶酶体破裂和线粒体损伤及Ca2+通透变化,引起肝细胞急性损伤和破坏,再腹腔注射不同pH值的0.3 mol/L 的氯化铵溶液引起血氨急剧升高,在肝功能严重障碍的基础上,一方面由于代谢障碍,ATP 不足以供给鸟氨酸循环;另一方面,鸟氨酸循环的酶系统严重受损;以及鸟氨酸循环的各种底物缺失等均可使由氨合成尿素明显减少,导致氨浓度增加[1]232-246。氨进入脑内与很多因素有关,氨属于弱碱性,在血中主要以铵离子形式存在,正常情况下铵离子不易通过血脑屏障,当血浆pH 增高时NH3增多,可自由通过血脑屏障,进入脑内[7]。进入脑内的氨增多一方面使脑内的神经递质平衡失调,兴奋性递质的量减少,而抑制性递质的量增多;另一方面氨增多会干扰脑细胞的能量代谢,导致脑细胞完成各种功能所需的能量严重不足,还影响到钠钾泵的活性,影响膜电位、细胞的兴奋及传导等活动,所以pH 越高,氨通过血脑屏障越多,进而表现出肝性脑病的临床表现越严重[8]。
如实验结果所示,随着A、B、C 组给予的氯化铵溶液pH 值的升高,各项症状出现的时间较早,且B、C 两组的症状更为典型;C 组可能由于氨进入脑内的量更多,症状更严重,死亡率(70%)比A、B 两组(分别为50%和60%)高,且可能由于病情比较严重,肝性脑病的症状并未全部表现出来便死亡。故提示血氨浓度越高,肝性脑病的程度将越重[9]。而D 组虽有肝功能衰竭的模型基础,但给予生理盐水后无明显异常,死亡率为零,也提示血氨升高是诱导肝性脑病发生的重要因素。
由于小鼠的个体差异,所以给予不同pH 值的氯化铵后,有的小鼠在给药后由于耐受性差,病情急剧发展较严重,未经历相关病程直接死亡或缺失相关症状而死亡;有些小鼠耐受性较好,经历相应病程出现相应症状后症状转缓或死亡,故可能造成实验结果未如预期理想。
综上所述,四氯化碳可造成小鼠急性肝功能不全[10],且急性肝功能不全小鼠对氨的耐受性随着氯化铵溶液pH 值的升高而降低,肝功能不全症状表现的更严重。

图1 对照组及实验组肝脏病理大体观
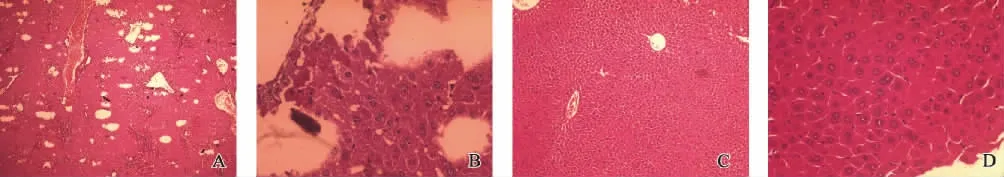
图2 肝组织病理切片(HE 染色)
[1]金惠铭,王建枝.病理生理学[M].第7 版.北京:人民卫生出版社,2011:232-246.
[2]潘辰,许利军,周锐,等.乙型肝炎肝衰竭患者发生肝性脑病的多因素分析[J].中华肝脏病杂志,2012,20 (6):434-437.
[3]胡还忠.医学机能学实验教程[M].第2 版.北京:科学出版社,2005:439-440 .
[4]文志萍,秦冬梅,曹文江.四氯化碳皮下注射制备大鼠肝纤维化模型的建立[J].时珍国医国药,2011,22 (12):2849-2851.
[5]高利民,冯义朝,王恬,等.肝性脑病发病机制的研究进展[J].国际消化病杂志,2010,30 (2):65-67.
[6]赖力英,杨旭,许向青,等.四氯化碳诱导大鼠急性肝功能衰竭动物模型的建立[J].中国现代医学杂志,2005,15 (11):1655-1657.
[7]刘冀,朱建忠,隋月林,等.四氯化碳诱导大鼠肝性脑病模型的制备[J].中国比较医学杂志,2012,22 (12):33-37.
[8]熊益群,周大桥,李航森,等.实验性大鼠肝性脑病动物模型的研究[J].中国实验动物杂志,2002,12 (60):340-342.
[9]段志军,张春乐.大鼠肝性脑病模型的研究进展[J].世界华人消化杂志,2010,18 (30):3204-3209.
[10]张锦雀 黄丽英.肝损伤模型研究进展[J].福建医科大学学报,2009,43 (1):86-88.

