复方马钱子的抗肿瘤作用探讨
刘迎辉,林海红,杜钢军
(河南大学药学院 药物研究所,河南 开封 475004)
化疗在肿瘤治疗中一直占重要地位,而化疗对机体自身的毒性和肿瘤耐药是化疗失败的主要原因[1]。中药可作用于肿瘤发生、发展的多个环节,在改善肿瘤患者体质、降低化疗药物毒性、增强化疗药物的疗效方面独具特色[2]。
马钱子以番木鳖之名始载于《本草纲目》,为辛温大毒之品,具有通络止痛、散结消肿之功效[3]。药理实验[4]证明,马钱子有较好的抗炎、镇痛、免疫调节、抗血栓、抗心律失常等作用。复方马钱子是一种复方中药,其中的有效成分能对抗马钱子中士的宁的惊厥作用,提高疗效,改善患者的生活质量。
实验采用小鼠H22肝癌皮下移植肿瘤模型,研究复方马钱子的抗肿瘤作用。
1 实验材料
1.1 动物与瘤株
C57BL/6小鼠和昆明鼠,体质量18~25g,河南省医学实验动物中心提供;HCT-116 大肠癌细胞、H22肝癌细胞,由本实验室传代保存。
1.2 药品与试剂
RPMI 1640培养基、MTT、胎牛血清(Sigma公司);青霉素和链霉素(华北制药集团公司产品);Na+检测试剂盒、K+检测试剂盒、Cl-检测试剂盒、葡萄糖检测试剂盒(上海荣盛生物药业有限公司)。
1.3 复方马钱子的制备
取10g复方马钱子药粉,用含体积分数为52%乙醇的高粱酒500mL浸泡1周,过滤得到药酒。加热挥发酒精至100mL,加蒸馏水重新至500mL用于实验。
1.4 仪器
ELX 800UV型酶标仪(美国Bio-Tek公司);SB-3C-1A型洁净工作台(100级洁净等级,上海博迅实业有限公司医疗设备厂);XD-1014 倒置生物显微镜(南京江南光电集团股份有限公司);CO2培养箱(NAPCO 公司)。
2 实验方法
2.1 复方马钱子对荷瘤小鼠体质量、肿瘤及免疫器官的影响
取生长良好的荷H22肝癌的昆明鼠处死,抽取其腹水,加无菌生理盐水稀释10倍,于小鼠前肢右腋皮下接种0.2mL/只,建立肝癌模型[5]。随机分为2组,每组10 只。对照组:口服灌胃生理盐水0.2mL/10g;给药组:口服灌胃复方马钱子提取液0.2mL/10g。肿瘤接种后当日开始给药,给药1次/d,疗程13d。治疗后1次/d测量小鼠体质量,待肿瘤长出后用游标卡尺隔天测肿瘤直径1次,肿瘤大小按下列公式计算。
肿瘤体积(mm3)=肿瘤长度×肿瘤宽度×肿瘤宽度/2。
全程治疗结束后,次日处死小鼠,剥离腋部肿瘤、脾脏、胸腺并称重,计算肿瘤抑制率及脏器指数。
抑瘤率=(1-T/C)×100%。式中:C为对照组平均瘤重(g);T为实验组平均瘤重(g)。
脏器指数=内脏器官质量(mg)/体质量(g)。
2.2 复方马钱子对小鼠淋巴细胞增殖的影响[6]
将C57BL/6小鼠脱颈处死,无菌取出脾脏,置平皿中,加D-Hank,s 液,将其研磨成细胞匀浆。以Tris-NH4Cl溶液溶解红细胞后,用含体积分数为10%胎牛血清的RPMI 1640培养液(内含青霉素和链霉素各100U/mL)调成2×106个/mL,接种于96孔板,100μL/孔。补充含不同浓度(浓度梯度分别为1、2、4g/L)复方马钱子的培养基100μL/孔,每组4个复孔。置于体积分数5%CO2培养箱内37°C培 养48h,加5g/L的MTT溶液(PBS配置)100μL/孔,继续培养4h,加MDSO 100μL/孔,于酶标仪490nm 测吸光度。计算细胞生长指数和促进率,讨论复方马钱子对小鼠淋巴细胞增殖的影响。
细胞生长指数=A(加药组)/A(对照组)×100%。
促进率=[(OD 加药组-OD 对照组)/OD 加药组]×100%
2.3 复方马钱子对肿瘤细胞增殖的影响
将HCT-116大肠癌细胞用含体积分数10%胎牛血清的RPMI 1640 培养液(内含青霉素和链霉素100U/mL)调成2×106个/mL,接种于96孔板,100μL/孔。加含不同浓度(浓度梯度分别为1、2、4g/L)复方马钱子的培养基100μL/孔,每组4个复孔。置于体积分数5%CO2培养箱内37°C 培养48h,加5g/L MTT溶液(PBS配置),100μL/孔,继续培养4h,加MDSO,100μL/孔,于酶标仪490nm 测吸光度,计算细胞生长指数和生长抑制率,讨论复方马钱子对肿瘤细胞增殖的影响。
细胞生长指数=A(加药组)/A(对照组)×100%。
抑制率=[(OD 对照组-OD 加药组)/OD 对照组]×100%。
2.4 复方马钱子对荷瘤小鼠体内离子、葡萄糖的影响
小鼠接种、分组及给药方案同“2.1”。全程治疗结束后,于次日小鼠眶静脉取血,分离血清,-20℃储存备用。
2.4.1 血清中Na+含量的测定 用Na+试剂盒测定,采用比浊法,测定原理为:在分散剂和除干扰剂的存在下,Na+与6-氢氧化锑钾在分散剂的存在下与Na+形成均一的浊度。在630nm 波长测定吸光度值,计算其含量。
钠离子含量(mmol/L)=测定管吸光度/标准管吸光度×标准管浓度。
2.4.2 血清中K+含量的测定 用K+试剂盒测定,采用比浊法,其原理为:在碱性介质中,经蛋白沉淀剂处理后的血清样本中的K+与NA-TPB 反应产生浑浊并有稳定的悬浮液。浑浊度与样本中K+浓度成正比。在440nm 波长测定吸光度值,计算其含量。
钾离子含量(mmol/L)=测定管吸光度/标准管吸光度×标准管浓度×样本测试前稀释倍数(10)。
2.4.3 血清中Cl-含量的测定 用Cl-试剂盒测定,采用比浊法,其原理为:用硫氰酸汞处理Cl-形成有色络合物,颜色深度与Cl-浓度呈正比。在480nm波长测定吸光度值,计算其含量。
氯离子含量(mmol/L)=测定管吸光度/标准管吸光度×标准管浓度。
2.4.4 血清中葡萄糖含量的测定 用葡萄糖试剂盒测定,采用葡萄糖氧化酶-过氧化物酶法。其原理为:样品中的葡萄糖经葡萄糖氧化酶作用生成葡萄糖酸和过氧化氢,后者在过氧化物酶作用下,将还原性4-氨基安替吡啉与酚偶联缩合成可被分光光度计测定的醌类化合物。在波长520nm 处以磷酸盐缓冲液替代血样空白反应管调零,读取标准管和样品管的吸光度值,计算其含量。
葡萄糖含量(mmol/L)=样本管吸光度/标准管吸光度×标准管浓度。
2.5 统计学处理
采用Excel进行组间单因素方差分析。计算资料采用均数±标准差表示,两样本均数比较采用t检验,P<0.05表示显著性差异,P<0.01表示非常显著性差异。
3 结果
3.1 对荷瘤小鼠体质量、肿瘤及免疫器官的影响
3.1.1 对荷瘤小鼠体质量的影响与对照组小鼠相比较,复方马钱子给药组的小鼠体质量呈明显下降趋势,见图1。
3.1.2 对荷瘤小鼠肿瘤生长的影响与对照组小鼠相比较,复方马钱子对肿瘤有明显的抑制作用,抑瘤率为61.75%,见图2、表1。

图1 复方马钱子对小鼠体质量的影响
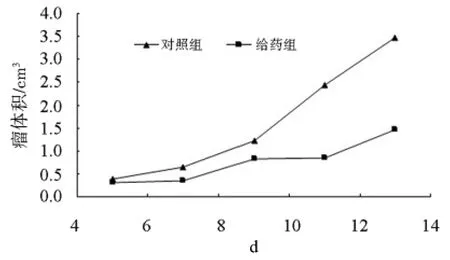
图2 复方马钱子对肿瘤生长的影响
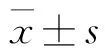
表1 复方马钱子对荷瘤小鼠肿瘤生长的影响(,n=10)
3.1.3 对荷瘤小鼠免疫器官指数的影响与对照组小鼠比较,复方马钱子组小鼠胸腺指数和脾脏指数显著下降,肝脏指数无明显改变,见表2。
3.2 对肿瘤细胞增殖的影响
复方马钱子对HCT-116大肠癌细胞成剂量依赖性抑制作用,对淋巴细胞增殖无明显影响,见表3、表4。
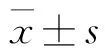
表2 荷瘤小鼠免疫器官指数(,n=10)
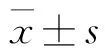
表3 复方马钱子对HCT-116大肠癌细胞增殖的影响(,n=6)
3.3 对荷瘤小鼠体内离子的影响
与正常组(非荷瘤小鼠)相比,对照组小鼠血清中Na+、Cl-含量降低(P<0.01),K+、Glu 含量升高(P<0.01)。与对照组相比较,给药组血清中K+、Cl-、Glu含量升高,但Na+改变不明显,见表5。
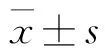
表4 复方马钱子对小鼠淋巴细胞增殖的影响(,n=6)
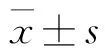
表5 复方马钱子对荷瘤小鼠血清中Na+、K+、Cl-、Glu含量的影响(,n=10)
4 讨论
总生物碱是马钱子中最主要的有效成分,目前的研究[7]表明,马钱子总生物碱中至少有16 种生物碱成分,主要成分是士的宁和马钱子碱,而士的宁过量中毒可引起肢体颤动、惊厥、呼吸困难,甚至昏迷,严重的可危及生命[8]。实验中,给予0.2L/10g的复方马钱子剂量,小鼠并未出现明显的士的宁中毒症状,说明复方马钱子中的成分能有效对抗士的宁所致的惊厥,降低毒副作用,提高患者的生活质量。
现代医学表明,马钱子不但有较好的抗肿瘤、抗转移作用,还可明显缓解患者临床症状,改善生活质量,延长生存期,提高机体免疫力,已成为抗肿瘤中药研究的一个热点[9]。实验研究[10]发现,复方马钱子对肿瘤有显著的抑制作用,抑瘤率为61.75%,恶性肿瘤的发生与机体的免疫力低下或缺失密切相关。实验中,小鼠胸腺指数和脾脏指数均下降,说明复方马钱子对免疫器官有抑制作用,而对肝脏毒性作用不明显。
在肿瘤发生发展过程中,离子通道的表达和活性发生改变,这种异常表达和活性改变又与肿瘤细胞增殖和凋亡密切相关[11]。另外,葡萄糖的高消耗和逃避失常凋亡,也被认为是肿瘤细胞的特征性改变。实验显示,与正常组相比,荷瘤小鼠对照组血清中Na+、Cl-含量显著降低,K+含量显著升高,说明肿瘤的发生引起了机体电解质紊乱;与对照组相比,复方马钱子给药组血清中的K+、Cl-含量显著增加,说明复方马钱子可调节离子通道而使电解质趋于正常,但具体机制尚不清楚,还需进一步探讨。荷瘤小鼠与正常组相比血清中葡萄糖含量升高,给药组与对照组相比葡萄糖含量显著下降,说明肿瘤的发生使机体代谢加强,而给药后的作用调节使代谢趋于正常水平。
[1]Papazisis K T,Kalemi T G,Zambouli D,et al.Synergistic effects of protein tyrosine inhibitor genistein with camptothecins against three lines in vitro[J].Caner Lett,2006,233(2):255-264.
[2]杜钢军,林海红,许启泰,等.灯盏花素促进阿霉素诱导的k562细胞凋亡[J].中国药理学通报,2007,23(8):1043-1045.
[3]石瑞.马钱子的临床应用[J].中国民间疗法,2010,3(18):64.
[4]王欣,李平.马钱子的药理作用[J].中医药临床杂志,2008,4(20):198-200.
[5]李佳桓,林海红,杜钢军,等.巴豆不同给药方式对荷瘤小鼠的影响[J].河南大学学报:医学版,2012,31(1):8-11.
[6]吴先闯,林海红,杜钢军,等.TGF-β1 抑制剂灯盏花素对肿瘤诱导的小鼠免疫抑制的逆转作用[J].河南大学学报:医学版,2009,28(3):174-177.
[7]蔡宝昌,吴皓,杨秀伟,等.马钱子中16个生物碱类化合物13CNMR谱的数据分析[J].药学学报,1994,29(1):44-48.
[8]焦杨.马钱子的研究进展[J].医学理论与实践,2009,22(8):918-919.
[9]侯风刚,贯剑.马钱子抗肿瘤研究进展[J].上海中医药杂志,2009,43(2):75-77.
[10]侯清玉,杨秀萍.肿瘤免疫逃逸的研究进展[J].中华肿瘤防治杂志,2010,17(3):228-231.
[11]缪克红,聂敏海.口腔肿瘤细胞离子通道的研究进展[J].广东牙病防治,2010,18(8):446-448.

