八角茴香及其提取物莽草酸抗甲型流感病毒的体外研究*
王 欢,张能英,孙兴泽,周艳萌,吴中明
(1.遵义医学院 医学与生物学研究中心,贵州 遵义 563099;2.遵义医学院 微生物学教研室,贵州 遵义563099;3.遵义医学院 临床医学系2009级,贵州遵义 563099;4.遵义医学院医学与科技学院2010级,贵州遵义 563099)
流感病毒(influenza virus)是引起急性呼吸道传染病流感的病原体,尤其是甲型流感病毒,其传染性强,且抗原性易频繁变异造成大流行。近年来,在各国出现的猪流感、禽流感对人们的生命造成了极大威胁,所以流感的防治一直是世界各国共同关注的热点。中医中药在抗病毒治疗方面由来已久,有研究称八角茴香是抗流感药物达菲的原料来源,因此本研究采用MDCK细胞模型,拟检测八角茴香的水提物及莽草酸是否有抑制流感病毒生长的作用,希望为流感的中草药治疗开辟一条新途径。
1 材料与方法
1.1 材料
1.1.1 细胞 狗肾传代细胞MDCK,购于国家流感中心,由本实验室传代保存。
1.1.2 鸡胚 购自遵义市某养鸡场。
1.1.3 病毒 为H3N2型,由本实验室保存。
1.1.4 药物 八角茴香购于遵义医学院附属医院药剂科,莽草酸购于浙江一新制药股份有限公司(批号:SA-060910)。
1.1.5 主要试剂 DMEM 培养基(Hyclone),新生牛血清(四季青),MTT(Amresco)。
1.2 方法
1.2.1 八角茴香水提物的制备 取干重20 g的八角茴香,加入适量的双蒸水浸泡60 min,加热煮沸30 min,收集滤液,再于药渣中加入适量双蒸水,加热煮沸30 min,收集滤液,如此3次,将3次的滤液混合,浓缩至20 mL,先用普通滤纸过滤,再用0.22 μm一次性滤器过滤除菌,所得液体为药物原液,浓度为1.0 g/mL,分装,4℃ 保存备用。
1.2.2 药物对MDCK细胞的毒性实验 将对数生长期的MDCK细胞消化后接种于96孔板中,细胞浓度为5×103个/100 μL/孔;次日待细胞贴壁后,分别加入不同浓度的药物(八角茴香水提物及莽草酸)每组设6个平行孔,然后将板置于37℃,5%CO2孵箱中培养。72 h后,每孔加入5 mg/mL的MTT溶液10 μL,继续培养4 h,弃去孔中液体,加入 DMSO,100 μL/孔,轻轻摇晃,使其结晶物充分溶解,用全自动酶标仪检测OD490的值,并按下述公式计算细胞存活率及抑制率。

1.2.3 病毒培养及TCID50的测定 将流感病毒接种于9日龄的鸡胚尿囊腔,35℃孵育72 h,无菌操作收获尿囊液。3 000 rpm离心15 min以除去沉淀。取少量进行血凝实验,确定其效价大于1∶1 280后,将余下上清进行分装,置-80℃储存。
取对数生长期的 MDCK细胞,按每孔5×103个加入96孔板中进行培养,100 μL/孔,37℃5%CO2孵箱中培养过夜。次日,将病毒用维持液做连续10 倍稀释,共 8 个浓度(10-1、10-2、10-3、10-4…10-8),加入至已贴壁的细胞中,每个浓度设8个复孔,并设空白对照,置于37℃,5%CO2孵箱中培养3 d,逐日观察记录细胞病变效应(CPE)。按Reed-Muench方法计算TCID50。
1.2.4 药物对病毒在细胞内增殖的影响 在药物的最大无毒范围内取3个浓度,按如下方式分别加入到细胞中:①药物的预防作用组:在贴壁生长的细胞中加入不同浓度的药液100 μL/孔,培养24 h后弃去孔中液体,再加入100 TCID50的病毒液,2 h后换为相应浓度的药液,继续培养;②药物的治疗作用组:在贴壁生长的细胞中先加入 100 TCID50的病毒液,100 μL/孔,2 h 后弃去病毒液换为相应浓度的药液,继续培养。以上各组均重复6孔,同时设有细胞对照组、病毒对照组以及阳性药物(金刚烷胺)对照组,置37℃、5%CO2培养箱继续培养72 h,MTT法测定 OD490值,计算病毒抑制率(%)。

1.2.5 统计学处理 采用SPSS11.0统计软件对实验数据进行单因素方差分析,比较不同浓度药物对细胞的毒性作用以及对病毒的抑制作用。
2 结果
2.1 药物对MDCK细胞的毒性实验 MTT结果显示,在MDCK细胞上,随着药物浓度的增大,OD值越低,其中八角水提物的10 mg/mL组及莽草酸的0.1 mg/mL组对细胞无毒性作用,与相应对照组比较无差异,故将此定为对MDCK细胞的最大无毒浓度(见图1)。
2.2 病毒培养、扩增及滴度测定 病毒经在鸡胚中扩增后,根据实验结果,按Reed-Muench法计算出 H3N2的 TCID50值为10-4/0.1 mL。
2.3 药物对病毒感染细胞生长的影响 1 mg/mL、5 mg/mL、10 mg/mL浓度的八角水提物分别以不同方式作用于病毒感染的细胞,通过MTT法检测细胞存活情况,结果表明:无论是预防用药还是治疗性用药,细胞的存活率均高于病毒对照组(P<0.01),说明病毒生长受到抑制,且该作用随着药物浓度的增加而增强,但是,效果均弱于阳性对照药物金刚烷胺(见表1及图2),提示:在体外细胞模型中,八角水提物对流感病毒的感染有一定的预防和治疗作用。同样方法检测莽草酸的作用,结果表明莽草酸不具有抑制流感病毒生长的作用。
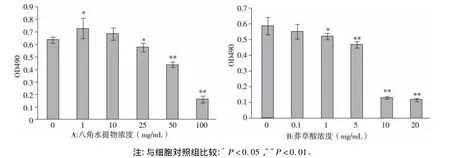
图1 药物对MDCK细胞的毒性作用
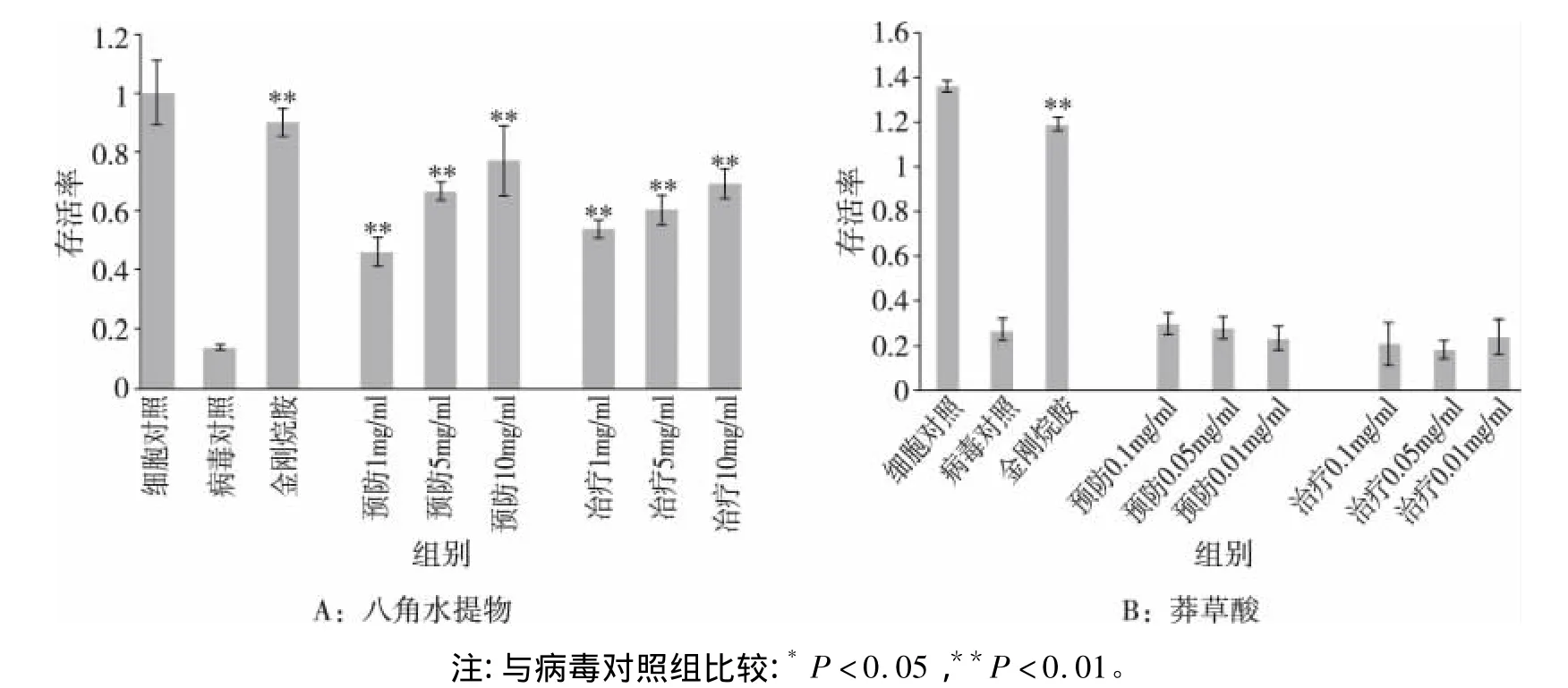
图2 药物对病毒感染细胞生长的影响
表1 八角水提物对甲型流感病毒H3N2增殖的影响(MTT法)(s)
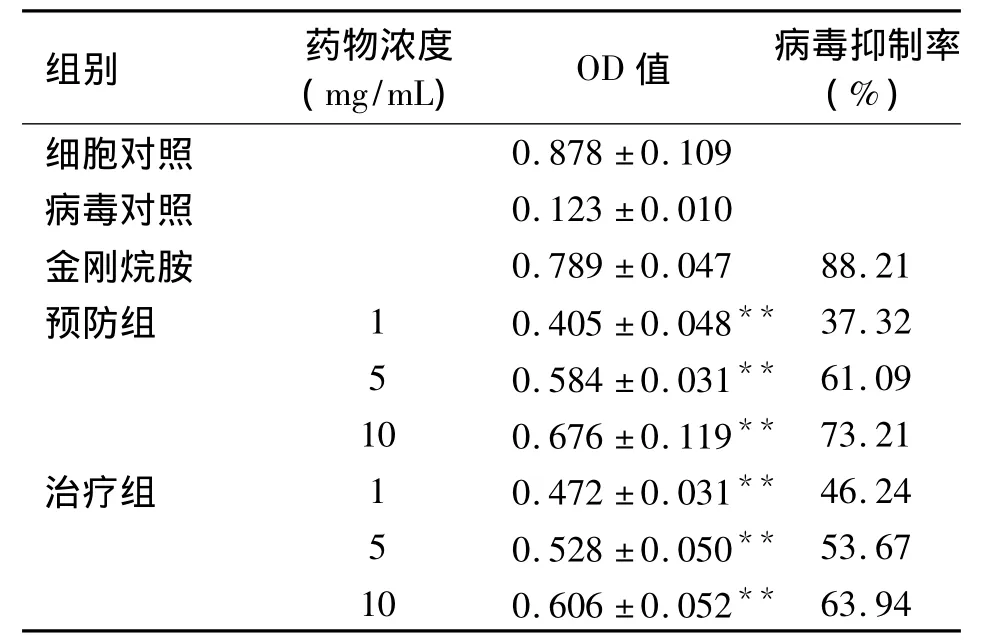
表1 八角水提物对甲型流感病毒H3N2增殖的影响(MTT法)(s)
注:与病毒对照组比较:*P <0.05,**P <0.01。
组别 药物浓度(mg/mL)OD值 病毒抑制率(%)
3 讨论
八角茴香又名大茴香、八角、八月珠等,为木兰科植物八角茴香(illicium verum hook.f.)的干燥成熟果实,性温,味辛,有温阳散寒和理气止痛的功效,其主要含有挥发油和莽草酸[3-4]。挥发油中的茴香烯有抗真菌和细菌的作用[5-6];而莽草酸在抗微生物方面的研究尚未见报道。但Bianco等在研究一种有抑制流感病毒神经氨酸酶作用的化合物时所用到的基本物质奎尼酸,最初就是由莽草酸改建而来[7],也就是现在临床用于抵抗禽流感的有效药物——达菲(奥司他韦),在其生产过程中就会用到莽草酸[8]。因此,本研究以八角茴香水提物及其主要成分莽草酸作为实验对象,研究其抗甲型流感病毒的作用。
通过MTT法检测八角茴香水提物及莽草酸对MDCK细胞的毒性作用,结果显示八角水提物与莽草酸的最大无毒浓度分别为10mg/mL和0.1mg/mL。抗病毒实验结果表明:八角水提物对H3N2型流感病毒的感染有一定的预防和治疗作用,且该作用随着药物浓度的增加而增强,但是,效果弱于阳性对照药物金刚烷胺;而其提取物——莽草酸未显示有抗H3N2的作用。因此我们认为:八角茴香作为一种药物直接用于流感的防治,其效果并不乐观。然而,在流感到来之际,于饮食当中加入适量的八角茴香可以起到一定的预防治疗作用。
[1]胡旭昌,王栓科,康学文,等.组蛋白去乙酰化酶抑制剂联合吉西他滨对骨肉瘤MG-63细胞抑制作用的研究[J].肿瘤,2013,33(6):520 -525.
[2]石丽桥,杨自文,王开梅,等.表没食子儿茶素没食子酸酯体外抗柯萨奇病毒的实验研究[J].时珍国医国药,2011,22(8):1945 -1947.
[3]唐霖,裴利霞.HPLC-ELSD法测定八角茴香中莽草酸的含量[J].中国医药导报,2013,10(8):119 -120.
[4]谢冬惠.八角茴香提取物抗氧化活性分析[J].热带生物学报,2012,3(3):243 -246.
[5]王晓强,郭亚健,杨春澍.高效液相法测定八角属部分植物果实中莽草酸的含量[J].中国中药杂志,2001,26(7):447-449.
[6]赵俊丽,骆志成,武三卯,等.八角茴香挥发油抗念珠菌活性的体外研究[J].中华皮肤科杂志,2004,37(8):475-477.
[7]Bianco A,Brufani M,Manna F,et al.Synthesis of a carbocyclic sialic acid analogue for the inhibition of influenza virus neuraminidase[J].Carbohydr Res,2001,332(1):23 -31.
[8]Saxena R K,Tripathi P,Rawat G,et al.Pandemism of swine flu and its prospective drug therapy[J].Eur J Clin Microbiol Infect Dis,2012,31(12):3265 -3279.

