紫外-可见分光光度法测定不同产地山楂果实中总黄酮含量※
马燕斌 曾建勋 张俊鹏 李瑞明 刘 怡 梁耀荣
紫外-可见分光光度法测定不同产地山楂果实中总黄酮含量※
马燕斌 曾建勋 张俊鹏 李瑞明 刘 怡 梁耀荣
目的建立紫外-可见分光光度法测定不同产地山楂果实中总黄酮含量。方法采用超声法提取山楂果实中的总黄酮,采用紫外-可见分光光度法测定不同产地山楂总黄酮含量,检测波长为500nm。结果芦丁在质量浓度20~120μg/mL(r=0.9993)范围内与吸光度值线性关系良好,平均回收率为100.1%,RSD=0.3%(n=6),来自8个产地的总黄酮含量在3.53%~4.12%之间。结论本方法简便、准确,重复性好,可快速测定山楂果实中总黄酮的含量;不同产地山楂总黄酮的含量存在一定差异,本实验可为控制山楂的质量提供参考依据。
山楂;总黄酮;紫外-可见分光光度法
山楂为蔷薇科山楂属植物,主要分布在北半球温带亚洲、欧洲、美洲各州,目前已有1000多种山楂种属被鉴定[1]。在亚洲、欧洲、美洲,人们广泛食用山楂的提取物作为食品和膳食补充剂。在北美,尤其是加拿大,山楂提取物可能有助于与心脏相关疾病的治疗[2]。许多研究表明,山楂的叶、花和果实的提取物对心血管系统产生有益的影响,具有保护心血管,舒张血管内皮依赖性血管[3],改善冠脉循环[4],降血脂的作用[5]。中国的山楂也具有舒张血管[6]和降血脂的作用[7-8]。
在中国和欧洲,山楂被广泛用于食品和药品生产中,如酒、果酱和大山楂[9]。目前,市场上销售的山楂药品已有七大类70余种,除用于消积化食、补脾健胃之外,也用于防治心血管疾病。山楂制剂的安全性研究发现,常见的不良反应有头晕、胃肠道反应、心慌等,但并未有严重的影响[10-11]。而山楂中的主要活性成分为黄酮类化合物,如金丝桃苷、槲皮素、原花青素[12-13]。由于生长的环境不同,不同产地山楂的质量不同。因此,对山楂中总黄酮的含量进行研究是必要的,本研究对不同产地的山楂果实中总黄酮的含量进行研究,为综合评价不同产地山楂的质量标准提供一定的依据。
1 实验材料
1.1 仪器与试剂主要仪器:SB25-12D台式超声波清洗器(宁波新芝生物科技股份有限公司);UV/VIS916型紫外-可见分光光度计(岛津公司);SHZ-D循环水式真空泵(巩义市予华仪器有限公司);电子分析天平(Sartorius公司)。
1.2 试剂与材料芦丁标准品(批号100080-200707);95%乙醇、亚硝酸钠、硝酸铝、氢氧化钠均购自广州化学试剂厂;山楂果实采自9~10月,产地分别为山东枣庄、安徽芜湖、山西晋城、河南新乡、河南林州、河南南阳、河北承德、广西桂林、辽宁辽阳、云南昆明。
2 方法与结果
2.1 不同产地山楂果实中总黄酮的提取先将山楂粉碎后过10目筛,按十字交叉法取样,精密称取山楂粉末三份,每份5.0g,分别加入70%乙醇100mL,超声提取40min,重复提取2次。提取完成后合并提取液,抽滤,并用少量相应浓度的乙醇洗涤滤渣。向滤液中加入适量体积的乙醇,使其体积与反应前保持一致,4℃保存,备用。
2.2 对照品溶液的制备精密称取在120℃干燥至恒重的芦丁对照品12.53mg,置25mL量瓶中,加适量无水乙醇溶解,加无水乙醇至刻度,摇匀,配制成每1mL中含无水芦丁0.50mg的溶液。
2.3 检测波长的确定吸取一定量的芦丁标准品溶液和山楂总黄酮溶液,分别置于25mL容量瓶中,按“2.4.1”方法立即照紫外-可见分光光度法,在400~600nm的波长处测定吸光度,结果发现芦丁标准品和样品在500.0nm处有最大吸收峰,峰型较好,如图1、图2所示,故选择500.0nm为检测波长。

图1 芦丁标准品的紫外吸收图谱
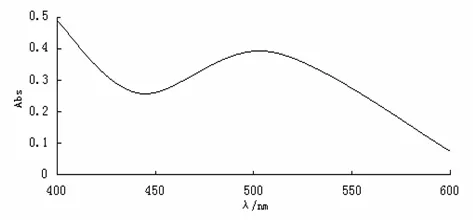
图2 山楂总黄酮的紫外吸收图谱
2.4 方法学考察
2.4.1 线性关系的考察精密量取对照品溶液1.00mL、2.00mL、3.00mL、4.00mL、5.00mL、6.00mL,分别置25mL量瓶中,各加水至6mL,加5%亚硝酸钠溶液1mL,摇匀,放置6min,加10%硝酸铝溶液1mL,摇匀,放置6min,加氢氧化钠试液10mL,再加水至刻度,摇匀,放置15min,以相应试剂为空白,立即照紫外-可见分光光度法,在500nm的波长处测定吸光度。
以芦丁浓度(mg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得芦丁的线性回归方程为A=19.716C-0.043,r=0.9993,表明芦丁的质量浓度在20~120μg/mL范围内与吸光度值线性关系良好。
2.4.2 精密度考察精密吸取六份3.00mL芦丁对照品溶液,按“2.4.1”方法测定吸光度,计算RSD值。结果表明,相对标准偏差RSD为0.5%,精密度良好。
2.4.3 稳定性考察精密吸取3.00mL芦丁对照品溶液和山楂总黄酮溶液,按“2.4.1”方法每隔5min记录一次吸光度值,记录6次。在30min内,两份溶液吸光度值的相对标准偏差RSD分别为0.5%和0.4%,结果表明,30min内样品的稳定性良好。
2.4.4 重现性考察精密称取5.0g山楂六份,按“2.1”项下提取山楂总黄酮,精密量取0.20mL,分别置25mL量瓶中,各加水至6mL,以下按“2.4.1”方法操作,测定吸光度。六份样品的标准偏差RSD为0.3%,表明重现性良好。
2.4.5 加样回收率考察精密量取0.1mL山楂总黄酮溶液,取六份,分别加入一定量的芦丁标准溶液,按“2.4.1”方法测定吸光度,计算其加样回收率。含总黄酮以无水芦丁(C27H30O16)计,结果见表1。
2.5 不同产地山楂总黄酮的测定精密量取0.20mL“2.1项”下提取所得山楂总黄酮提取液置于25mL容量瓶中,各加水至6mL,以下同“2.4.1项”操作,在500nm的波长处测定吸光度。含总黄酮以无水芦丁(C27H30O16)计,不同产地(山东枣庄、安徽芜湖、山西晋城、河南新乡、河南林州、河南南阳、河北承德、广西桂林、辽宁辽阳、云南昆明)的山楂总黄酮的测定结果,如表2所示。

表1 加样回收率实验结果

表2 不同产地山楂总黄酮的含量测定结果(n=3)
3 讨论
中国山楂资源丰富,分布广泛,种类繁多,如伏山楂、毛山楂、桔红山楂、裂叶山楂等,多达18种,6个变种。山楂树结果部位的光照条件对果实的质量影响较大,光照好的部位,其花果多,果实质量好。光照不好的部位结果少,质量差[1]。东北地区平均气温低,气候干燥;华北地区全年平均气温10~16℃,降雨量适中,为我国山楂的主要栽培区,已有许多优良品种;华南地区年平均气温高,降雨丰富,且土壤多为红壤,不宜山楂种植;西南地区分布有云南山楂,生长在海拔1400~3000m的向阳山地。
山楂的质量与其生长的周围环境如光照时间、温度、水分等有密切关系。本研究中,云南山楂中总黄酮的含量明显高于其它产地,这与其自身的品种有直接关系,也与其生长在海拔高、光照时间长的山地有关。河南、河北、山东、安徽、山西所产山楂总黄酮含量在3.53%~4.12%之间,含量较为接近。广西及辽宁所产山楂总黄酮含量最低,分别为3.33%和3.21%。
不同产地的山楂品种不同,生长的周围环境不同,导致其山楂总黄酮含量有所差异。因此,对不同产地的山楂总黄酮进行研究,为其质量标准的进一步研究提供参考,是有必要的。更深入的对山楂的品种、生长环境等因素和山楂总黄酮含量之间相互关系的研究,将是我院下一步研究的重点。
[1] 赵焕谆,丰宝田.中国果树志•山楂卷[M].北京:中国林业出版社,1996:13-15.
[2] Basu SK, Thomas JE, Acharya SN. Prospects for growth in global nutraceutical and functional food markets:a Canadian perspective[M]. Australian Journal of Basic and Applied Sciences, 2007:637-649.
[3] Kim SH, Kang KW, Kim KW, et al. Procyanidins in Crataegus extract evoke endothelium-dependent vasorelaxation in rat aorta[J]. Life Sciences, 2000,67(2):121-131.
[4] Pittler MH, Schmidt K, Ernst E. Hawthorn extract for treating chronic heart failure:Meta-analysis of randomized trials[J]. The American Journal of Medicine, 2003,114(8):665-674.
[5] Quettier DC, Voiselle G, Fruchart JC, et al. Hawthorn extracts inhibit LDL oxidation[J]. Die Pharmazie, 2003,58(8):577-581.
[6] Chen ZY, Zhang ZS, Kwan KY, et al. Endothelium-dependent relaxation induced by hawthorn extract in rat mesenteric artery[J]. Life Sciences, 1998,63(22):1983-1991.
[7] Fan C, Yan J, Qian Y, et al. Regulation of lipoprotein lipase expression by effect of hawthorn flavonoids on peroxisome proliferator response element pathway[J]. Journal of Pharmacological Sciences, 2006,100(1):51-58.
[8] Shih CC, Lin CH, Lin YJ, et al. Validation of the Antidiabetic and Hypolipidemic Effects of Hawthorn by Assessment of Gluconeogenesis and Lipogenesis Related Genes and AMPActivated Protein Kinase Phosphorylation[J]. Evid Based Complement Alternat Med, 2013.
[9] Chang Q, Zuo Z, Harrison F, et al. Hawthorn[J]. Journal of Clinical Pharmacology, 2002,42(6):605-612.
[10] Chang WT, Dao J, Shao ZH. Hawthorn:potential roles in cardiovascular disease[J]. Am J Chin Med, 2005, 33(1):1-10.
[11] Dahmer S, Scott E. Health effects of hawthorn[J]. Am Fam6. Physician, 2010,81(4):465-468.
[12] Svedström U, Vuorela H, Kostiainen R, et al. Highperformance liquid chromatographic determination of oligomeric procyanidins from dimers up to the hexamer in hawthorn[J]. Journal of Chromatography A, 2002,968(1-2):53-60.
[13] Edwardsa JE, Brown PN, Talent N, et al. A review of the chemistry of the genus Crataegus[J]. Phytochemistry, 2012,79(3):25-26.
Analysis of Total Flavonoids inCrataegus Pinnatifida Bge. From Different Areas by UV-VIS Spectrophotometry
Ma Yanbin Zeng Jianxun Zhang Junpeng Li Ruiming Liu Yi Ling Yaorong
ObjectiveTo establish a UV-VIS spectrophotometry method to determine total flavonoids inCrataegus pinnatifida Bge.from different areas.MethodsTotal flavonoids ofCrataegus pinnatifida Bge.was extracted by ultrasonic method, and was determined by UV-VIS spectrophotometry at 500 nm.ResultsThe linearity of rutin was20~120μg/mL(r=0.9993), and the average recovery ratios was 100.1%. The RSD was 0.3%(n=6). The contents of total flavonoids ranged from 3.53% to 4.12%.ConclusionThe method was simple and accurate, and it could be used for the determination of total flavonoids quickly. The contents of total flavonoids was different from different areas.It provided some academic basis for quality standard ofCrataegus pinnatifida Bge..
Crataegus pinnatifida Bge.; Total flavonoids; UV-VIS spectrophotometry
R927.2
A
1673-5846(2013)06-0024-03
中山大学附属第一医院药学部,广东广州 510080
广东省重大科技专项项目(2011A080300004);广东省中医药局科研项目(20121145);广州市生物产业示范工程发展专项项目(2012-243)
马燕斌(1977.6-),女,本科,主管药师,主要研究方向为中药和医院药学。E-mail:179621079@qq.com。
李瑞明(1974.7-),男,本科,主管药师,主要研究方向为医院制剂。E-mail:liruiming321@163.com。

