氟维司群治疗曾接受过芳香化酶抑制剂治疗的复发转移性乳腺癌的临床研究
姜航王涛张少华杜萌吴世凯宋三泰江泽飞
1.解放军医学院,北京 100853;
2.解放军三〇七医院乳腺肿瘤科,北京 100071
氟维司群治疗曾接受过芳香化酶抑制剂治疗的复发转移性乳腺癌的临床研究
姜航1,2王涛2张少华2杜萌2吴世凯2宋三泰2江泽飞2
1.解放军医学院,北京 100853;
2.解放军三〇七医院乳腺肿瘤科,北京 100071
背景与目的:内分泌治疗是激素受体阳性乳腺癌的标准治疗,随着芳香化酶抑制剂(aromatase inhibitors,AI)在临床上广泛使用,其治疗失败的后续治疗成为临床需要解决的问题。本研究旨在评价氟维司群解救治疗曾接受过AI治疗的复发转移性乳腺癌的临床疗效。方法:回顾性分析了56例氟维司群治疗AI耐药的复发转移性乳腺癌患者的临床资料,对临床疗效及其影响因素等进行统计分析。结果:全组患者中位年龄57岁。所有患者均为雌激素和(或)孕激素受体阳性,HER-2阳性率为10.7%。氟维司群的临床获益率为17.9%,客观缓解率为3.6%,中位PFS为3.0(1~17)个月。分为AI反应型和AI耐药型,两者的PFS及临床获益率(clinical benefit rates,CBR)差异无统计学意义(P=0.530,P=0.515)。单因素分析结果显示,术后腋窝淋巴结转移数目、无病生存时间、是否辅助内分泌治疗、总治疗线数、复发转移后转移灶数目是影响接受氟维司群治疗患者的PFS的因素,COX多因素分析显示,氟维司群PFS与无病生存时间、总治疗线数相关(P=0.017和P=0.021)。结论:氟维司群是AI治疗失败后可选择的重要治疗手段。
芳香化酶抑制剂耐药;激素依赖型;氟维司群;晚期乳腺癌
乳腺癌是女性最常见的恶性肿瘤,进展缓慢的激素反应性乳腺癌首选内分泌治疗[1]。三苯氧胺已成为绝经前激素受体阳性乳腺癌患者辅助治疗的标准推荐,而绝经后乳腺癌患者首选第三代芳香化酶抑制剂(aromatase inhibitors,AI)。随着第三代AI在临床的广泛应用,其耐药的后续治疗成为临床关心和亟待解决的问题。本研究回顾性分析了56例转移性乳腺癌患者使用AI治疗失败后,接受氟维司群解救治疗的临床资料。
1 资料和方法
1.1 临床一般资料
回顾性分析2011年3月—2012年10月,解放军三〇七医院收治的56例接受AI治疗至疾病进展后,接受氟维司群解救治疗的转移性乳腺癌患者的临床资料。
入选标准:①经病理证实为乳腺癌患者;②临床资料完整(明确的生存记录,治疗记录等);③ER和(或)PR为阳性;④所有患者在辅助治疗或者解救治疗中接受过AI的治疗;⑤血液、心肺功能、肝肾功能检查基本正常,ECOG 0~3分。
全组患者的中位年龄57岁(39~78岁)。其中4例为初始诊断Ⅳ期。49例患者手术治疗后行辅助内分泌治疗,其中三苯氧胺33例,AI 7例,托瑞米芬1例,两种辅助内分泌治疗8例。复发转移后接受过解救化疗11例,56例患者解救治疗的线数1~16线,中位线数为6线。56例患者解救内分泌治疗包括三苯氧胺、AI、孕激素等,解救内分泌治疗线数1~6线,中位3线。本组患者中内脏转移者45例(80.4%),骨及软组织转移者11例(19.6%,表1)。
1.2 方法
1.2.1 治疗方法
患者均给予氟维司群治疗,两种给药剂量分别为:氟维司群250 mg或500 mg每28 天肌肉注射1次,对于500 mg剂量组在用药第14天加用500 mg氟维司群。绝经前的患者给予氟维司群联合醋酸戈舍瑞林3.6 mg每28 天皮下注射1次。患者每4周或8周随访,直到病情进展。

表 1 56例患者基本情况Tab. 1 Baseline characteristics of the 56 patients
1.2.2 观察指标
按照RECIST疗效评价标准对疗效进行评价。完全缓解(complete remission,CR):所有目标病灶消失;部分缓解(partial remission,PR):基线病灶长径总和缩小≥30%;疾病进展(progressive disease,PD):基线病灶长径总和增加≥20%或出现新病灶;稳定(stable disease,SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。CR+PR为客观缓解,在研究期间发生客观缓解患者的百分比定义为客观缓解率(objective response rate,ORR),CR、PR或SD≥24周为临床获益,临床获益率(clinical benefit rate,CBR)定义为在研究期间发生临床获益患者的百分比。无进展生存期(progression free survival,PFS)定义为由开始治疗至第1次发生疾病进展或任何原因死亡的时间间隔。
本研究根据国外文献报告,将AI反应型定义为复发转移患者接受AI治疗达到CR、PR或SD≥6个月[2]。AI耐药型定义为患者辅助AI治疗过程中或结束后6个月内出现疾病进展,或复发转移患者接受AI未达到临床获益。解救内分泌获益时间定义为既往所有达到临床获益的解救内分泌治疗方案的累计获益时间。
1.2.3 随访
本组患者通过门诊、住院随诊或电话随访,在开始治疗后每1~2个月随访1次,内容包括目前治疗情况,PFS、无病生存期(disease free survival,DFS)、及生存情况,随访截止时间为2012年10月31日。
1.3 统计学处理
数据统计学处理采用SPSS 18.0统计软件进行。分析采用Kaplan-Meier曲线法,单因素分析采用log-rank检验,多因素分析采用COX多因素回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 ORR、CBR临床获益率及PFS
56例AI治疗失败复发转移性的乳腺癌患者接受氟维司群解救内分泌治疗,结果CBR为17.9%(10/56),ORR为3.6%(2/56),中位PFS为3.0(2~17)个月,最长PFS为17个月(表2)。
2.2 影响氟维司群疗效的相关因素分析
2.2.1 影响氟维司群PFS的单因素分析
Log-rank检验单因素分析结果显示,同侧腋窝淋巴结转移数目、DFS、是否接受辅助内分泌治疗、解救治疗线数、复发转移部位数目与氟维司群的PFS相关,而年龄、临床分期、HER-2、ER及PR表达状态与氟维司群的PFS无关(表3,图1)。
2.2.2 AI是否获益对氟维司群PFS影响的单因素分析
本组AI反应型患者46例(82.1%),AI耐药型患者10例(17.9%),接受氟维司群治疗的中位PFS为3.0个月对2.0个月,ORR和CBR比较差异无统计学意义(P均>0.05,表4)。既往AI未获益的患者中,仍有3例患者在疾病进展后使用氟维司群达到临床获益。
本研究中,52例解救治疗接受过AI的患者,氟维司群上一线AI的临床获益率53.8%(28/52)。上一线AI是否获益与氟维司群PFS差异无统计学意义(P=0.459)。上一线AI未获益者后续接受氟维司群治疗仍然有12.5%(3/24)的患者临床获益。

表 2 氟维司群治疗复发转移性乳腺癌与国际大组临床研究的比较Tab. 2 Comparison of efficacy of fulvestrant in advanced breast cancer between this study and some international clinical researches
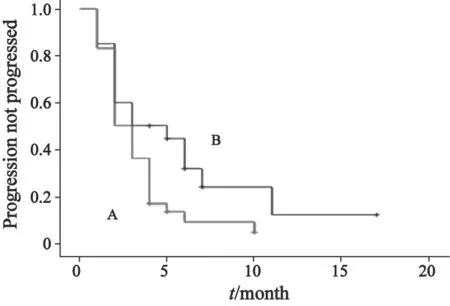
图 1 不同解救治疗线数氟维司群PFS的Kaplan-Meier曲线Fig. 1 Kaplan-Meier curves for PFS in patients with different treantment line
2.2.3 一线AI治疗失败后,氟维司群与孕激素、AI疗效对比
本研究还初步分析了一线AI解救内分泌治疗失败后,接受另一种AI与接受孕激素及氟维司群解救治疗的患者,其CRB及PFS的差异。一线非甾体AI治疗失败的患者(n=38),给予依西美坦、孕激素、氟维司群治疗后,3者的PFS差异无统计学意义(P=0.391);将依西美坦组与氟维司群组对比(n=34),中位PFS分别为2.0个月和3.0个月(P=0.233)。一线依西美坦治疗失败的患者(n=11),给予非甾体AI、孕激素及氟维司群治疗后,3者的PFS差异无统计学意义(P=0.799)。
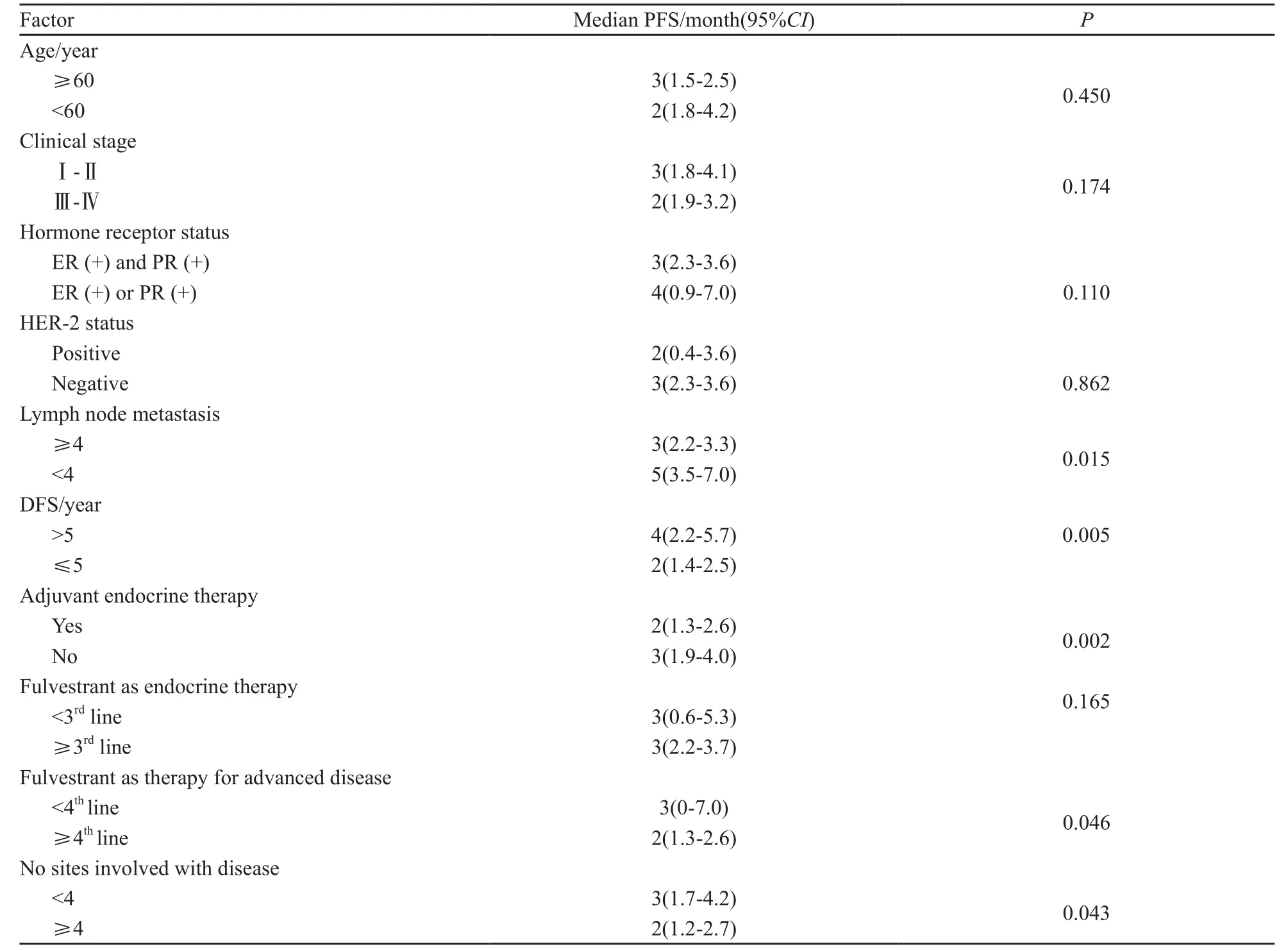
表 3 氟维司群治疗AI耐药的转移性乳腺癌PFS单因素分析Tab. 3 Single-factor analysis with impact on PFS of fulvestrant after AI failure with advanced breast cancer
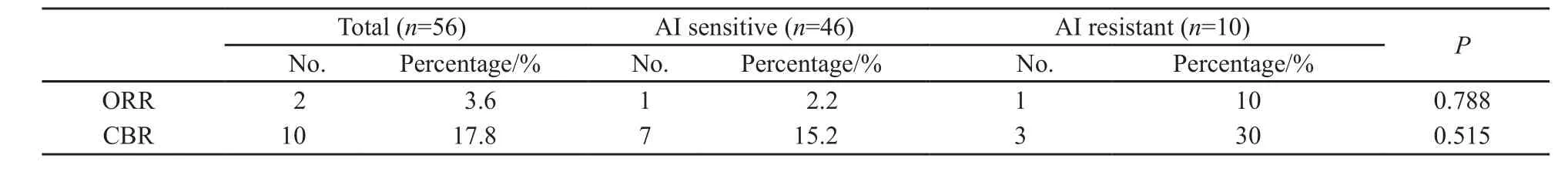
表 4 AI反应型及耐药型的客观缓解率和临床获益率比较Tab. 4 ORR and CBR to AI sensitive and AI resistant
2.2.4 氟维司群治疗后PFS的COX多因素回归分析
收集可能影响本组患者PFS的11项因素,用COX风险回归模型对氟维司群的PFS进行分析。COX回归模型基于最大似然估计后退法P>0.10为标准剔除变量,结果显示氟维司群PFS与年龄、HER-2、ER和PR表达状态、手术分期、同侧腋窝淋巴结转移数目、复发转移部位数目、解救内分泌治疗获益间等因素均无关,但与DFS、解救治疗线数因素相关(P=0.017; P=0.021)。
3 讨 论
目前第三代AI已成为绝经后乳腺癌患者的标准治疗,其耐药后的治疗成为我们关心的问题。氟维司群是一种新型的雌激素受体拮抗剂以及下调剂,它能高亲和力地结合、阻断并下调ER,使激素受体上的转录活性区域AF1和AF2均失活,并加速了ER的丧失,相对于三苯氧胺仅阻断AF2,氟维司群发挥了纯抗雌激素作用,且无受体的激动作用[4]。2011年NCCN指南推荐复发转移性乳腺癌患者AI治疗失败可选孕激素或氟维司群,非甾体类AI治疗失败可选甾体类AI、孕激素或氟维司群,但对于何种患者在何时选择何种治疗并无明确推荐。
本研究56例患者大部分为多重治疗的患者,中位解救内分泌治疗线数3线,中位解救治疗线数6线,氟维司群中位PFS为3.0个月,CBR为17.9%。而国外大型研究显示三苯氧胺治疗失败的二线氟维司群治疗,TTP为5.5个月,CBR分别为43.5%[3];AI治疗失败的二线氟维司群治疗,TTP为3.7个月,CBR分别为32.2%[2]。本组患者治疗线数偏晚,故PFS、CB较文献报告差。本组统计结果显示,DFS长、术后淋巴结转移数目少、瘤负荷小、治疗线数早的患者,氟维司群可能更获益。
研究中既往AI是否获益以及上一线AI是否获益均对氟维司群治疗PFS无影响。上一线AI未获益的患者,后续接受氟维司群治疗仍然有12.5%患者临床获益。可见,AI治疗失败后氟维司群仍可能获益。目前对于依西美坦解救内分泌治疗失败的后续治疗临床研究较少,本中心曾有AI抑制剂不同顺序治疗乳腺癌的研究[5],本研究初步观察了依西美坦一线解救内分泌治疗失败后非甾体AI、孕激素以及氟维司群的疗效差异,3者PFS差异无统计学意义。
本组患者中最长的PFS为17个月,该患者为40岁女性,2002年行左乳癌改良根治术,淋巴结转移2/9,ER、PR阳性,HER-2阴性。术后行AC-T辅助化疗,三苯氧胺辅助内分泌治疗7年,切除卵巢后,给予来曲唑治疗1年,2011年5月新发肝转移,给予氟维司群解救内分泌治疗,2个月后疗效评价为PR,目前继续氟维司群的治疗。
一项大型临床研究显示,氟维司群500 mg较250 mg治疗复发转移性乳腺癌可能更获益[6],本中心也参与了氟维司群不同剂量对于中国人群的对比研究。临床前研究证明氟维司群与生长因子受体靶向药联合应用,如表皮生长因子受体(EGFR)酪氨酸激酶抑制药(吉非替尼),HER-2靶向治疗药物(曲妥珠单抗),可能比单独使用具有更强的抗肿瘤效果[7]。本研究有6例患者病理证实为HER-2阳性,其中仅1例患者给予氟维司群500 mg联合赫赛汀靶向治疗,4个月后疗效评价为SD,目前患者仍继续该治疗中。
总之,从本研究结果可以看到,氟维司群是AI耐药后重要的治疗手段,治疗线数早可能更获益。“后AI”时代我们应依据指南规范治疗,并探索和优化个体化治疗策略。
[1] 江泽飞. 乳腺癌内分泌治疗的基本原则和新策略[J]. 中华医学杂志, 2012, 92(20): 1372-1373.
[2] CHIA S, GRADISHAR W, MAURIAC L, et al. Double-blind, randomized, placebo-controlled trial of fulvestrant compared with exemestane after prior non steroidal aromatase inhibitor therapy in postmenopausal women with hormone receptorpositive, advanced breast cancer: results from EFECT[J]. J Clin Oncol, 2008, 26(10): 1664-1670.
[3] HOWELL A, PIPPEN J, ELLEDGE R M, et al. Fulvestrant versus anastrozole for the treatment of advanced breast carcinoma: a prospectively planned combined survival analysis of two multicenter trials[J]. Cancer, 2005, 104(2): 236-239.
[4] OSBORNE C K, WAKELING A, NICHOLSON R I. Fulvestrant: an oestrogen receptor antagonist with a novel mechanism of action[J]. Br J Cancer, 2004, 90(1): 2-6.
[5] 张少华, 江泽飞, 宋三泰, 等. 芳香化酶抑制剂不同顺序治疗转移性乳腺癌的临床研究[J]. 中国癌症杂志, 2010, 20(5): 385-389.
[6] DI LEO A, JERUSALEM G, PETRUZELKA L, et al. Results of the CONFIRM phase Ⅲ trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer[J]. J Clin Oncol, 2010, 28(30): 4594-4600.
[7] GEE J M, HARPER M E, HUTCHESON I R, et al. The antiepidermal growth factor receptor agent Gefitinib (ZD1839/ Iressa) improves antihormone response and prevents development of resistance in breast cancer in vitro[J]. Endocrinology, 2003, 144(11): 5105-5117.
Fulvestrant for the treatment of advanced breast cancer after prior aromatase inhibitor therapy
JIANG Hang1,2, WANG Tao2, ZHANG Shao-hua2, DU Meng2, WU Shi-kai2, SONG San-tai2, JIANG Zefei2(1. Medical School of Chinese PLA, Beijing 100853, China; 2. Department of Breast Oncology, 307 Hospital of PLA, Beijing100071, China)
JIANG Ze-fei E-mail: jiangzefei@medmail.com.cn
Background and purpose: Endocrine therapy is a standard option in hormone receptor-positive breast cancer. With aromatase inhibitors (AI) being increasingly used as adjuvant and advanced therapy, it is important to identify subsequent treatment after AI failure. This study aimed to evaluate the efficacy of fulvestrant for advanced metastatic breast cancer following progression on AI. Methods: We analyzed retrospectively the records of 56 metastatic breast cancer patients who were resistant to AI and underwent fulvestrant therapy including clinical effects, influencing factors. Results: The patients’ median age was 57. All the patients had ER-positive and/or PR-positive, and 6 patients (10.7%) were identified as having HER-2 positive disease. Ten patients (17.9%) experienced clinical benefit (CB), overall response rate was 3.6%, median progression free survival (PFS) was 3.0 months (ranged 1-17 months). Patients were categorized as AI sensitive and AI resistant, and progression free survival and clinical benefit of fulvestrant had no correlation (P=0.530, P=0.515). Log-rank test showed that the PFS of fulvestrant had associated with lymph node metastatic status, disease free survival (DFS), whether underwent adjuvant hormonal treatment, advanced treatment lines, the number of metastases, clinical benefit time of hormonal treatment. Cox regression showed that the PFS of fulvestrant had associated with DFS and treatment lines (P=0.017; P=0.021). Conclusion: Fulvestrant was the important choice of treatment for the patients resistant to AI in metastatic breast cancer.
Aromatase inhibitors ; Hormone-dependent; Fulvestrant; Advanced breast cancer
10.3969/j.issn.1007-3969.2013.03.012
R737.9
:A
:1007-3639(2013)03-0224-05
2012-12-18
2013-02-19)
江泽飞 E-mail:jiangzefei@medmail.com.cn

