宫颈癌术后保护骨髓的调强放疗剂量学研究
肖锋李云海王洪林陈洁赵森董海权李永春
1.复旦大学附属肿瘤医院闵行分院放疗科,上海 200240;
2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
3.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
宫颈癌术后保护骨髓的调强放疗剂量学研究
肖锋1李云海1王洪林1陈洁2赵森3董海权1李永春1
1.复旦大学附属肿瘤医院闵行分院放疗科,上海 200240;
2.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
3.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:同步放化疗已成为有高危因素的宫颈癌术后患者的标准治疗,与单纯放疗相比,同步放化疗确实提高了疗效,但同时也增加了血液学不良反应。本研究通过比较对骨髓进行限量的调强放疗(bone marrow-sparing intensity-modulated radiotherapy,BMS-IMRT)与未对骨髓进行限量的调强放疗(conventional intensity-modulated radiotherapy,IMRT)、三维适形放疗(three-dimension conformal radiation therapy,3D-CRT)在宫颈癌根治术后患者靶体积覆盖及危及器官(organ at risk,OAR)保护方面的差异,确定BMS-IMRT的剂量学优势。方法:对10例宫颈癌根治术后患者分别设计出3D-CRT(四野盒式)、IMRT和BMS-IMRT的3种治疗计划并比较靶区及危及器官剂量分布。靶区处方剂量均为45 Gy,危及器官包括骨髓、小肠、膀胱、直肠和股骨头。所有计划在Pinnacle3 (Version 9.2 f) 治疗计划系统上完成,最终的剂量计算采用串筒卷积迭加算法进行。结果:3组的靶区覆盖率相似(P>0.05)。BMS-IMRT组的骨髓V5、V10、V20、V30及V40均低于3D-CRT组(P<0.05),且V20、V30、V40低于IMRT组(P<0.05),而BMS-IMRT组与IMRT组小肠、膀胱、直肠的受量差异无统计学意义(P>0.05)。结论:对于宫颈癌术后患者,BMS-IMRT计划在降低骨髓剂量方面优于IMRT和3D-CRT。宫颈癌术后放疗计划设计中增加骨髓的限量有助于降低急性骨髓抑制的发生率。
宫颈肿瘤;放射方法;调强;剂量学
以顺铂为基础的同步放化疗已成为有高危因素的宫颈癌术后患者的标准治疗,与单纯放疗相比,同步放化疗确实提高了疗效,但同时也增加了不良反应,尤其是3、4级急性血液学不良反应发生率明显升高,常导致放化疗中止,甚至危及患者生命。因此,如何减少急性血液学不良反应的发生已成为实施同步放化疗急需解决的重要课题。有研究报道,放疗所导致的血液学不良反应与骨髓受照剂量及体积相关[1]。因此,通过改进放疗方式减少骨髓受照剂量有可能减少急性骨髓抑制的发生,从而保证同步放化疗的顺利进行。调强放疗(conventional intensity-modulated radiotherapy,IMRT)能减少盆腔内正常组织的受量,本研究的目的就是探讨对骨髓进行限量的调强放疗(bone marrow-sparing intensity-modulated radiotherapy,BMS-IMRT)在降低骨髓受照剂量、体积方面的优势与特点,确定是否有必要对骨髓进行限量,限量后是否会增加其他组织的受照剂量,为BMS-IMRT进一步运用于临床提供剂量学参考。
1 资料和方法
1.1 研究对象
选择2010年7月—2011年8月在复旦大学附属肿瘤医院闵行分院治疗的10例宫颈癌根治术后患者,年龄33~55岁,中位年龄46岁,按FIGO分期ⅠB1期3例,ⅠB2期3例,ⅡA期4例。手术方式均为广泛子宫、双附件切除+盆腔淋巴结清扫术。
1.2 CT模拟定位
将60%泛影葡胺5 mL稀释于1 000 mL纯净水中,嘱咐患者分别于CT扫描前2 h、1 h各口服500 mL,于扫描前1 h开始憋尿以保证膀胱充盈。患者取仰卧位,扫描前阴道内放置阴道标记物,制作腹盆腔的体位固定模。CT采用飞利浦公司85 cm大孔径CT模拟定位机,CT扫描同时静脉注射碘普罗胺100 mL进行影像对比增强。CT扫描范围自第2腰椎上缘至坐骨结节下5 cm,扫描层厚、间隔均为5 mm,扫描图像经局域网传输至Pinnacle3(Version 9.2f) 治疗计划系统。
1.3 靶体积及危及器官的界定
根据ICRU62号报告,子宫颈癌术后盆腔临床靶体积(clinical target volume,CTV)包括阴道上段1/2及残端、阴道旁软组织和盆腔淋巴引流区域,上界为髂血管分叉上5 mm,下界为阴道标记下3 cm。CTV靶区的勾画根据RTOG宫颈癌术后靶区勾画指南[2],其中盆腔淋巴引流区域的勾画根据Taylor的盆腔淋巴结勾画指南[3]。计划靶体积(planning target volume,PTV)为CTV边界在三维上均匀外扩1 cm。同时勾画危及器官(organ at risk,OAR):小肠、直肠、膀胱、骨髓及双侧股骨头。小肠包括造影剂显示的肠管及其周围肠系膜组织、上界达PTV以上2 cm。直肠上界为直乙交界处、下界为肛门。膀胱包括充盈状态下全部膀胱。股骨头左、右侧分别勾画(包括股骨颈)。骨髓包括腰骶骨、髂骨、坐骨、耻骨、双侧股骨头及股骨上段[1],范围为PTV上、下各2 cm。
1.4 危及器官的剂量体积限制条件
OARs剂量及体积限制条件见表1。
1.5 治疗计划设计
对每例患者均按照3D-CRT(四野盒式)、IMRT和BMS-IMRT的3种治疗模式制定治疗计划,在Pinnacle3(Version 9.2 f)软件系统中完成。3种计划的处方剂量均设定为45 Gy,要求95% PTV接受100%处方剂量,98%PTV接受95%处方剂量;射线均选用6 MV X线。3D-CRT计划:采用正向原理设计4个野,入射角分别为0。、90。、180。、270。,权重比为1∶1∶1∶1。IMRT计划:采用逆向原理设计,7野等中心照射,入射角分别为0。、51。、102。、153。、204。、255。、306。,计划优先顺序为PTV>直肠>膀胱>小肠>股骨头。BMS-IMRT计划:计划优先顺序为PTV>骨髓>直肠>膀胱>小肠>股骨头,其余同IMRT。每例患者实际采用BMS-IMRT计划,使用医科达Precise直线加速器,单次剂量1.8 Gy,共25次。

表1 危及器官剂量体积限制条件Tab. 1 The dose-volume constraints of OARs
1.6 治疗计划的评估及比较指标
所有计划在Pinnacle3(Version 9.2 f) 治疗计划系统上完成,最终的剂量计算采用串筒卷积迭加算法进行,并进行评价和比较:①靶区分析指标为D95(Gy)(靶区95%体积所接受的剂量)、V95%(95%等剂量线所包括的体积百分比)、均匀性指数(homogeneity index,HI)和适形度指数(conformity index,CI)。HI值越小(接近1),表示靶区剂量均匀性越好。CI值范围是0~1,值越大,表示适形度越好。②正常组织的分析指标是受到特定剂量水平照射的体积百分比。
1.7 统计学处理
数据处理采用SPSS 17.0软件,对3种计划的各参数行单因素方差分析检验,P<0.05为差异有统计学意义。
2 结 果
2.1 等剂量线和DVH图
图1为1例患者3种计划的等剂量分布图,显示了3种计划的靶区覆盖率相似,但BMS-IMRT计划中骨髓受量一定程度减少。图2为1例患者的PTV及骨髓DVH图,可见3种计划的骨髓受量BMS-IMRT<IMRT<3D-CRT,而PTV相似,尤其是BMS-IMRT与IMRT接近一致。图3为该患者的小肠、膀胱、直肠DVH图,可见BMS-IMRT与IMRT的小肠、膀胱、直肠受量相似,均低于3D-CRT。

图1 BMS-IMRT、IMRT及3D-CRT计划的剂量分布横断面图Fig. 1 Axial dose distributions obtained with bone marrow-sparing intensity-modulated radiotherapy
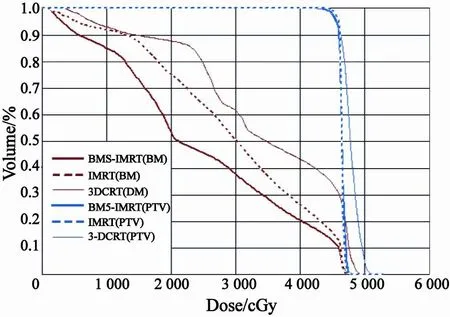
图 2 BMS-IMRT、IMRT及3D-CRT计划的PTV及骨髓DVH图Fig. 2 Dose-volume histograms for planning target volume (PTV) and bone marrow comparing bone marrow-sparing intensity-modulated radiotherapy
2.2 PTV靶区覆盖率及均匀性、适形度
3组的D95、V95差异均无统计学意义(P>0.05),说明3种计划的靶区覆盖率相似(表2)。3组HI、CI差异有统计学意义(P<0.05),进一步两两比较发现,BMS-IMRT组均匀性指数略逊于IMRT组(P=0.031),但优于3D-CRT组(P=0.001);BMS-IMRT组适形度指数与IMRT组差异无统计学意义(P=0.313),优于3D-CRT组(P=0.000)。
2.3 危及器官的剂量、体积

图 3 BMS-IMRT、IMRT及3D-CRT计划的小肠、膀胱、直肠DVH图Fig. 3 Dose-volume histograms for small bowel, bladder and rectum comparing bone marrow-sparing intensity-modulated radiotherapy
3组骨髓各剂量的体积百分比差异均有统计学意义(P=0.000),进一步两两比较发现,BMS-IMRT组的骨髓V5、V10、V20、V30及V40均低于3D-CRT组(P<0.05),且V20、V30、V40低于IMRT组(P<0.05);而IMRT组仅骨髓V5、V20、V40低于3D-CRT组(P<0.05)。
BMS-IMRT组与IMRT组相比,两组小肠、膀胱、直肠的受量差异无统计学意义(P>0.05)。与3D-CRT组相比,BMS-IMRT组、IMRT组均降低了膀胱高剂量的受照体积(P=0.009,表3)。

表 2 BMS-IMRT、IMRT 及3D-CRT计划的靶区剂量学比较Tab. 2 Dosimetric comparison of target volume among BMS-IMRT, IMRT and 3D-CRT
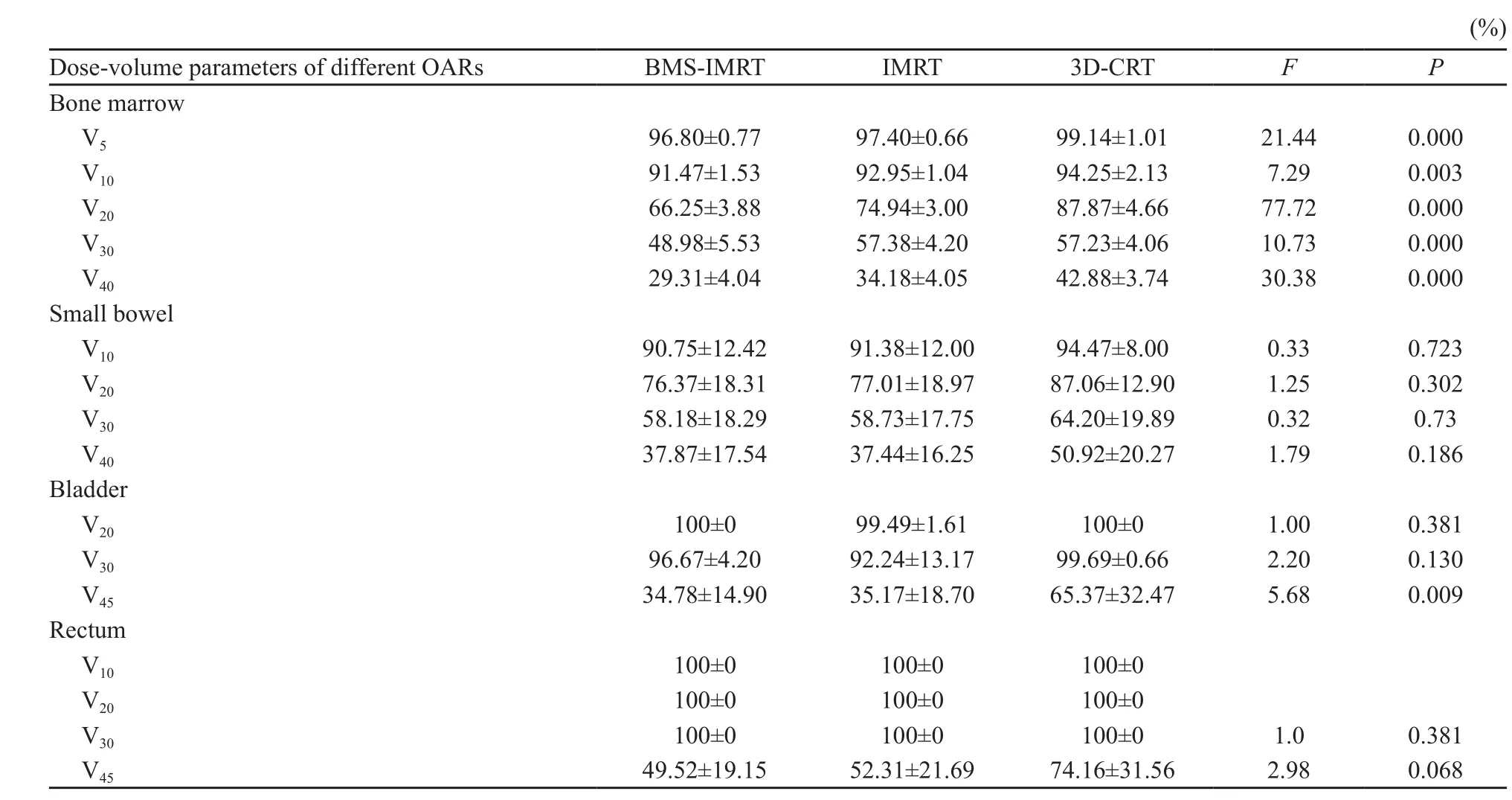
表3 BMS-IMRT、IMRT和3D-CRT不同OARs达不同剂量的体积均值比较Tab.3 Comparison of the dose-volume parameters of OARs for BMS-IMRT, IMRT and 3D-CRT
3 讨 论
目前有高危因素的宫颈癌术后患者的标准治疗为以顺铂为基础的同步放化疗,然而同步放化疗使得急性血液学不良反应明显增加,3度以上骨髓抑制为单纯放疗的2~10倍[4],主要为白细胞及中性粒细胞减少,常导致患者并发感染,需输液及住院治疗,甚至导致放化疗的拖延或中止,进而影响疗效。宫颈癌患者同步放化疗中顺铂联合紫杉醇或托泊替康较单用顺铂有更好的疗效,然而3度以上血液学不良反应发生率高达70%,限制了化疗的实施[5-6]。因此,宫颈癌术后同步放化疗实施中急需解决的问题是如何减少急性血液学不良反应发生。
IMRT技术在降低急性血液学不良反应方面有明显优势。Brixey等[7]的研究证实,实施同步放化疗的宫颈癌术后患者中,IMRT组较3D-CRT组血液学不良反应发生率低,且骨髓的V20、V40、V45均较3D-CRT组低。本研究比较了靶区剂量学在IMRT计划和3D-CRT计划的差异,显示在靶区覆盖率相似的前提下IMRT计划的骨髓V5、V20、V40低于3D-CRT计划,这与Brixey的剂量学研究结果一致。然而Yang等[8]的Meta分析发现IMRT与3D-CRT计划的骨髓剂量参数无差异,笔者分析了其引用的文献中IMRT均未对骨髓进行限量。因此,IMRT须通过优化骨髓剂量限制达到降低血液学不良反应的发生。Kloppl等[9]对83例子宫内膜癌和宫颈癌术后患者行同步放化疗,放疗重点保护了骨髓,骨髓V10均值为88%,V20均值为74.3%,与历史对照组RTOG9708相比,4度血液学不良反应为0 vs 13%(P=0.002)。由此可见,在放疗过程中,有效降低骨髓受照剂量及体积具有显著临床意义。本研究是将BMS-IMRT与IMRT、3D-CRT进行剂量学比较,焦点在于BMS-IMRT在保护骨髓方面有何剂量学优势。
成人的骨髓超过一半位于低位的腰骶骨、髂骨、坐骨、耻骨及近端的股骨[1],而这些区域在盆腔放疗中均受到不同程度的照射,放疗后骨髓造血干细胞受损将导致骨髓抑制。单纯放疗时骨髓抑制并不常见,这是因为未受照射的骨髓可代偿性造血;而同步化疗损伤了所有造血干细胞,降低了代偿能力,进而增加了血液学不良反应的发生率。从放射生物效应分类来看,骨髓属于并行器官,因此照射体积的减少对于降低急性血液学不良反应的发生具有关键意义。但是骨髓抑制的程度究竟与骨髓剂量的哪些参数相关目前尚无定论。大多数学者的研究证实,接受同步化疗及盆腔调强放疗的患者骨髓抑制的程度与骨髓的V10、V20密切相关[1,10-12]。Albuquerque等[13]通过对40例接受同步放化疗的宫颈癌患者研究发现,骨髓的V20为2度以上骨髓抑制的独立预测因子(r=0.8,P<0.0001),且V20>80%者2度以上骨髓抑制发生的风险增加4.5倍。Rose等[14]建立了同步放化疗的宫颈癌患者血液学不良反应的正常组织并发症概率(normal tissue complication probability,NTCP)模型,进一步证实了骨髓的V10,V20与白细胞减少呈负相关,骨髓V10≥95%、V20≥76%的患者易发生3度以上血液学不良反应。Bazan等[15]的研究表明盆腔同步放化疗患者中V20>75%发生3度以上血液学不良反应发生率为V20<75%的26倍(P=0.004 5);使用Lyman模型计算的顺铂同步化疗组NTCP参数为n=0.94,m=0.48,TD50=33 Gy。Bazan等[16]使用Lyman模型计算的肛管癌同步放化疗发生3度以上血液学不良反应的NTCP参数为n=1,m=0.175,TD50=32 Gy。上述研究结果显示,急性血液学不良反应的发生与骨髓的低剂量照射体积,尤其是V10、V20密切相关。本研究表明,骨髓的V10、V20均以3D-CRT最高,3D-CRT组骨髓的V20>80%,V10接近95%,提示同步放化疗时应用3D-CRT需慎重,有可能引起急性血液学不良反应增加。
关于骨髓限量,Mutyala等[11]建议,宫颈癌术后顺铂同步放化疗患者骨髓限量为:V10<95%、V20<80%、V30<64%。本研究中,IMRT组的V10均<95%,而V20部分超过75%,因此,对骨髓限量时可不考虑V10,而重点限制V20,综合上述内容,推荐V20≤75%。由于Bazan等[15]的研究使用Lyman模型计算TD50接近30 Gy,故推荐对V30限量≤50%。本研究中,BMSIMRT组的骨髓受量在各剂量体积百分比均低于3D-CRT组,且V20、V30、V40低于IMRT组,这提示BMS-IMRT计划在降低骨髓剂量方面优于IMRT和3D-CRT。
本研究还证实,BMS-IMRT计划与IMRT相比,两者靶区覆盖率及适形度差异无统计学意义,小肠、膀胱、直肠的受照剂量和体积差异无统计学意义,这表明BMS-IMRT在降低骨髓剂量的同时并未损失靶区,也未增加其他正常组织器官的受量。这与Platta等[17]使用螺旋断层放疗的研究结果一致。
总之,BMS-IMRT较IMRT、3D-CRT在保护骨髓方面更有剂量学优势,降低骨髓剂量体积有助于降低急性血液学不良反应的发生率。因此,为保证宫颈癌术后同步放化疗顺利进行,推荐放疗计划设计中增加骨髓的限量,值得临床推广应用。当然,BMS-IMRT计划的剂量学优势的临床意义尚有待进行大规模的临床试验来证实,宫颈癌术后同步放化疗的急性血液学不良反应的NTCP模型尚需进一步完善,我们期待着新技术如质子放疗进一步保护骨髓功能[18]。
[1] MELL L K, KOCHANSKI J D, ROESKE J C, et al. Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensitymodulated pelvic radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1356-1365.
[2] SMALL W, MELL L K, ANDERSON P, et a1. Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy in postoperative treatment of endometrial and cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(2): 428-434.
[3] TAYLOR A, ROCKALL A G, REZNEK R H, et al. Mapping pelvic lymph nodes: guidelines for delineation in intensitymodulated radiotherapy[J]. Int J Radiat 0ncol Biol Phys, 2005, 63(5): 1604-1612.
[4] VALE C, TIERNRY J F, STEWART L A, et a1. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials[J]. J Clin Oncol, 2008, 26(35): 5802-5812.
[5] LONG H J, BUNDY B N, GRENDYS E C, et al. Randomized phase Ⅲ trial of cisplatin with or without topotecan in carcinoma of the uterine cervix[J]. J Clin Oncol, 2005, 23(21): 4626-4633.
[6] MOORE D H, BLESSING J A, MCQUELLON R P, et al. Phase Ⅲ study of cisplatin with or without paclitaxel in stageⅣB, recurrent, or persistent squamous cell carcinoma of the cervix[J]. J Clin Oncol, 2004, 22 (15): 3113-3119.
[7] BRIXEY C J, ROESKE J C, LUJAN A E, et al. Impact of intensity-modulated radiotherapy on acute hematologic toxicity in women with gynecologic malignancies[J]. Int J Radiat Oncol Biol Phys, 2002, 54(5): 1388-1396.
[8] YANG B, ZHU L, CHENG H, et al. Dosimetric comparison of intensity modulated radiotherapy and three-dimensional conformal radiotherapy in patients with gynecologic malignancies: a systematic review and meta-analysis[J]. Radiat Oncol, 2012, 7: 197.
[9] KLOPPL A H, MOUGHAN J, PORTELANCE L, et al. Hematologic Toxicity on RTOG 0418: a phaseⅡstudy of postoperative IMRT for gynecologic cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 78(3): 258.
[10] MELL L K, SCHOMAS D A, SALAMA J K, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in anal cancer patients treated with concurrent chemotherapy and IMRT[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1431-1437.
[11] MUTYALA S, THAWANI N, VAINSHTEIN J M, et al. Dose constraint recommendations and a predictive nomogram of incidence of hematological toxicity for cervix cancer patients treated with concurrent cisplatin and IMRT[J]. Int J Radiat Oncol Biol Phys, 2008, 72: 359-360.
[12] GIANGRECO D T, ALBUQUERQUE K, NORTON J, et al. Predictors of hematologic toxicity and implications for bonemarrow sparing pelvic IMRT for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2007, 69: 399.
[13] ALBUQUERQUE K, GIANGRECO D, MORRISON C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1043-1047.
[14] ROSE B S, AYDOGAN B, LIANG Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(3): 800-807.
[15] BAZAN J G, LUXTON G, KOZAK M M, et al. Normal tissue complication probability modeling of acute hematologic toxicity in patients receiving pelvic IMRT and concurrent chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 84(3): 350.
[16] BAZAN J G, LUXTON G, MOK E C, et al. Normal tissue complication probability modeling of acute hematologic toxicity in patients treated with intensity-modulated radiation therapy for squamous cell carcinoma of the anal canal[J]. Int J Radiat Oncol Biol Phys, 2012, 84(3): 700-706.
[17] PLATTA C S, BAYLISS A, MCHAFFIE D, et al. A dosimetric analysis of tomotherapy based intensity modulated radiation therapy with and without bone marrow sparing in gynecologic malignancies[J]. Technol Cancer Res Treat, 2013, 12(1): 19-29.
[18] SONG W Y, HUH S N, LIANG Y, et al. Dosimetric comparison study between intensity modulated radiation therapy and three-dimensional conformal proton therapy for pelvic bone marrow sparing in the treatment of cervical cancer[J]. J Appl Clin Med Phys, 2010, 11(4): 3255.
《中国医药科学》杂志征订启事
《中国医药科学》杂志是中华人民共和国卫生部主管,海峡两岸医药卫生交流协会和二十一世纪联合创新(北京)医药科学研究院主办的国家级综合性医药科技期刊,国内统一刊号:CN 11-6006/R,国际标准刊号:ISSN 2095-0616,邮发代号:82-519。现已被中国知网、中国学术期刊网络出版总库、《中国学术期刊(光盘版)》全文检索系统、万方数据数字化期刊群、中国核心期刊(遴选)数据库、中文科技期刊数据库、解放军医学图书馆CMCC和CMCI全文收录,系中国学术期刊综合评价数据库统计源期刊。
全国各地邮局均可订阅,脱订者可直接通过发行部订阅。本刊为半月刊,每月出版2期,每期定价20元,订阅全年24期优惠价360元。国内外公开发行,本刊设有封面人物、业界关注、专家论坛、基础医学、药物研究、论著、综述、药理与毒理、临床研究、药物与临床、影像与介入、麻醉与镇痛、影像与接入、医学检验、临床病理、中医中药、医药教育、经营管理等栏目。内容涉及国内外医疗、教学、科研和管理工作者在医药科研领域中所取得的新理论、新成果、新经验、新技术、新方法。欢迎内科、外科、口腔科、耳鼻咽喉科、眼科、麻醉科、皮肤科和妇产科等相关专业的科研、教学、临床和护理人员订阅与投稿。根据全国继续医学教育委员会《继续医学教育学分授予与管理办法》的规定,在本刊发表论文可获得国家级继续医学教育学分。凭订阅单复印件投稿,同等条件优先录用。欢迎各医药单位、院校、厂家刊登产品和广告。
地 址:北京市朝阳区百子湾西里402号楼1004室 《中国医药科学》杂志社发行部
邮 编:100124 电 话:010-59693870-8017 传 真:010-59693848
联 系 人:缐红宇 联系信箱:zgyykxhrd@163.com
Dosimetric study of protecting bone marrow by intensity-modulated radiotherapy for patients with cervical cancer after hysterectomy
XIAO Feng, LI Yun-hai, WANG Hong-lin, CHEN Jie, ZHAO Sen, DONG Hai-quan, LI Yong-chun (1.Department of Radiation Oncology, Fudan University Shanghai Cancer Center Minhang Branch, Shanghai 200240, China; 2. Department of Gynecologic Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 3. Department of Radiation Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Yun-hai E-mail: liyunhai@csco.org.cn
Background and purpose: Concurrent chemoradiotherapy is the standard treatment modality for patients with high-risk cervical cancer after hysterectomy. The delivery of cisplatin-based chemotherapy with radiotherapy improved survival compared with radiotherapy alone, but may be associated with high rates of acute hematologic toxicity. The purpose of this study was to investigate the dosimetric benefits of bone marrow-sparing intensity-modulated radiotherapy (BMS-IMRT) compared with conventional intensity-modulated radiotherapy (IMRT) and three-dimension conformal radiation therapy (3D-CRT) techniques in the treatment of patients with cervical cancer after hysterectomy. Methods: The four-field box 3D-CRT, IMRT and BMS-IMRT were generated on 10 cervical cancer patients after hysterectomy, which actually treated with BMS-IMRT techniques. The prescribed dose to the PTV was 45 Gy. All plans had 95% of PTV volume
the prescription. The organs at risk included bone marrow, small bowel, rectum, bladder and femoral head. All plans were created in the Pinnacle3 (Version 9.2 f) and the final doses werecalculated using the collapse cone superposition and convolution algorithm. The dosimetric comparisons of target and organs at risk were performed among the three techniques. Results: The PTV coverage in 3D-CRT, IMRT and BMSIMRT plans was similar (P>0.05). The BMS-IMRT reduced the bone marrow V5(volume receiving 5 Gy), V10, V20, V30, V40and V20, V30, V40, compared to the 3D-CRT and IMRT, respectively (P<0.05). For the small bowel, bladder and rectum, no statistically significant dose differences were found between BMS-IMRT and IMRT (P>0.05). Conclusion: For patients with cervical cancer after hysterectomy, the BMS-IMRT is superior to the IMRT and 3D-CRT in reducing dose to bone marrow volume. The IMRT with bone marrow sparing may reduce acute hematologic toxicities.
Cervical neoplasms; Radiotherapy;intenstive-modulated; Dosimetry
10.3969/j.issn.1007-3969.2013.03.008
R737.33
:A
:1007-3639(2013)03-0200-07
2012-12-31
2013-02-05)
上海市闵行区卫生局科研课题经费资助(No: 2010MW12)。
李云海 E-mail:liyunhai@csco.org.cn

