Smad4静默对K-ras突变小鼠胰腺PanIN细胞增殖及转移能力的影响
齐晓光胡毅汪进良谈文龙王琪王立夫Tuveson DA
1.解放军总医院肿瘤综合治疗科二病区,北京 100853;
2.上海交通大学医学院免疫研究所,上海 200025;
3.上海交通大学医学院附属瑞金医院消化内科,上海200025;
4.英国剑桥大学肿瘤科,剑桥CB2 ORE
Smad4静默对K-ras突变小鼠胰腺PanIN细胞增殖及转移能力的影响
齐晓光1胡毅1汪进良1谈文龙2王琪3王立夫3Tuveson DA4
1.解放军总医院肿瘤综合治疗科二病区,北京 100853;
2.上海交通大学医学院免疫研究所,上海 200025;
3.上海交通大学医学院附属瑞金医院消化内科,上海200025;
4.英国剑桥大学肿瘤科,剑桥CB2 ORE
背景与目的:由己建立的小鼠基因打靶模型证实,K-ras突变启动了胰腺癌前病变—胰腺上皮内瘤变(pancreatic intraepithelial neoplasia,PanIN),p53、p16失活均可单独促进小鼠PanIN发展为浸润性胰腺癌。作为人胰腺癌中另一失活频率高发的抑癌基因Smad4,本课题组前期研究提示,应用RNA干扰技术沉默PanIN细胞株中内源性Smad4表达,促使PanIN细胞恶性转化。基于此目的,本研究进一步探讨siRNA干扰Smad 4基因对PanIN细胞体内外增殖及转移能力的影响,从而有助于阐明PanIN恶性转化的新机制。方法:构建和筛选能特异性静默PanIN细胞中Smad4表达的最佳siRNA稳定表达质粒,稳定转染最佳siRNA表达质粒进入PanIN细胞,用Zeocin筛选稳定转染克隆,挑选阳性克隆、扩增,稳定转染后细胞命名为PanIN-S。本研究运用细胞计数、克隆形成实验等分别比较两组在活细胞率和体外增殖能力的影响,同时为进一步验证Smad 4基因静默对PanIN细胞体外迁移、侵袭能力的影响,本研究采用Transwell和Mitigel assay检测其干扰前后体外运动、侵袭能力。动物实验中,建立PanIN及PanIN-S细胞组裸鼠移植瘤模型,并应用免疫组化方法检测并比较两组PCNA、VEGF和MMP-9的表达及其差异。结果:成功构建了Smad4基因siRNA体系;体外实验中与PanIN组相比,PanIN-S组细胞增殖、侵袭能力明显增强,差异有统计学意义(P<0.05);动物模型免疫组化结果显示,与PanIN组相比,PanIN-S组PCNA、VEGF和MMP-9表达显著增高(P<0.05)。结论:K-ras突变基础上小鼠PanIN细胞Smad4基因静默促使PanIN细胞的恶性转化;PanIN基础上Smad4静默促使小鼠PanIN细胞体内外增殖及转移能力的增强,其增殖及转移可能与PCNA、VEGF和MMP-9高表达有关。
siRNA干扰;Smad4基因;胰腺上皮肉瘤变细胞;细胞增殖;转移
胰腺癌一旦诊断大约85%有局部和(或)远处转移,失去手术机会,预后极差,基于此,胰腺癌的早期诊断一直是该领域研究的热点与难点问题之一,为此深入研究胰腺癌的癌前病变胰腺管内上皮瘤变(pancreatic intraepithelial neoplasia,PanIN)的分子恶性转化机制[1],可能是胰腺癌早期诊断并寻找有效治疗方法的关键所在。PanIN是近几年提出的新术语并被认为是胰腺癌前病变之一[2]。
本课题组前期研究表明,PanIN细胞的致瘤性,但并未见肺脏、肝脏、胰腺等器官转移,其病变类型类似于结肠腺瘤,组织病理学检查证实为PanIN1-PanIN2[3]。进一步研究采用siRNA干扰技术静默Smad4基因的表达,证实PanIN基础上的Smad4基因静默能导致进展期胰腺癌的发生,其病理结果符合胰腺导管腺癌[4-5]。然而,Smad4静默后对PanIN细胞恶性转化机制尚未阐明,故研究提示,本研究在前期研究的基础上,进一步探讨Smad4基因静默后其恶性转化机制,为胰腺癌的靶向治疗提供新的思路。
1 材料和方法
1.1 实验材料
1.1.1 细胞
PanIN细胞由英国剑桥大学Tuveson D.A.教授惠赠,其为 K-ras突变小鼠基因打靶胰腺PanIN模型并经体外建系而来,在基因突变分析PanlN细胞中除可检测到K-rasG12D突变外无p16、Tp53、Smad4突变或缺失,LoxP-Stop-LoxP-K-rasG12D的建立参照参考文献[5]。
1.1.2 动物
无特殊病原体(SPF)级BALB/c裸鼠10只,5周龄,雌雄不限,由中国科学院上海实验动物中心提供。
1.1.3 试剂
Smad4抗体(H-552,Santa Cruz,1∶500),TRIzol试剂(Invitrogen公司),RT-PCR试剂盒(Takara公司),LipofectamineTM2000试剂盒(Invitrogen公司),PCNA抗体(Cell Signaling公司1∶2000);VEGF抗体(Cell Signaling Technology,1∶100 );MMP-9抗体(Santa Cruz,1∶50),免疫组化试剂盒购自福州迈新生物技术开发有限公司,Smad4等引物由上海英骏生物技术公司合成[4]。
1.2 体外实验
1.2.1 细胞计数及生长曲线
分别取对数生长期的PanIN、PanIN-S细胞,0.25%胰酶消化,0.4%台盼蓝染色,并用计数板进行活细胞计数,以绘制体外生长曲线,其具体方法如下:用10%胎牛血清的RPMI-1640培养液悬浮细胞,接种至5个6孔板(每组设3个复孔),每孔细胞数为5 000个,置于37 ℃、CO2体积分数为5%的培养箱中培养,每24 h计数1次,每组计数后取平均值。计数期间每3天换液1次。以培养时间为横坐标,细胞数为纵坐标,绘制生长曲线。
1.2.2 软琼脂克隆形成实验
分别取PanIN、PanIN-S细胞,接种于6孔板(细胞数均为5 000个/孔),每个细胞设3个复孔对照,观察干扰前后在半固体培养基中的生长情况。6孔板底层为0.6%琼脂糖培养基,上层为0.3%琼脂糖培养基,培养箱中培养14~20 d,计数细胞数>50的克隆数,上述实验至少重复3次。细胞集落形成率=细胞集落数/接种的细胞总量×100%。
1.2.3 Transwell小室体外运动实验
0.25%胰酶消化各组PanIN细胞、PanIN-S细胞,计数并用无血清1640培养基稀释细胞至浓度为1×106/mL。在Transwell小室(Chemicon公司)下室加入含10%胎牛血清的1640培养基500 µL,上室加入无血清培养基稀释的细胞悬液200 µL,置于37 ℃、CO2体积分数为5%的条件下培养48 h。弃上室液体,用棉签轻轻拭去滤膜上表面的未穿透的细胞,经甲醇固定15 min,常规苏木素染色,选择5个高倍镜(×200)视野,计数滤膜下表面的细胞数(穿膜细胞数),以穿膜细胞数表示其运动能力,每组设3个复孔,实验重复3次。
1.2.4 Matrigel基质体外侵袭实验
0.25%胰酶消化各组PanIN细胞、PanIN-S细胞,计数并用无血清RPMI-1640培养基稀释细胞至浓度为1×106/mL。在含有Matrigel基质的Transwell小室(Chemicon公司)下室加入含10%胎牛血清的1640培养基500 µL,上室加入无血清培养基稀释的细胞悬液200 µL,置于37 ℃、CO2体积分数为5%的条件下培养48 h。弃上室液体,用棉签轻轻拭去滤膜上表面的Matrigel基质,经甲醇固定15 min,常规苏木素染色,选择5个高倍镜(×200)视野,计数滤膜下表面的细胞数(穿膜细胞数),以穿膜细胞数表示其侵袭能力,每组设3个复孔,实验重复3次。
1.2.5 移植瘤中PCNA、VEGF和MMP-9表达检测
小鼠PanIN及PanIN-S胰腺移植瘤的构建及病理鉴定参照参考文献[4];两组移植瘤分别石蜡包埋固定,石蜡切片脱蜡水化,3%过氧化氢室温温育10 min以消除内源性过氧化物酶活性;微波抗原修复20 min,滴加正常山羊血清封闭液20 min,加入第一抗体4 ℃下过夜后洗片,加入第二抗体并在室温下温育30 min后洗片,加入ABC并在室温下温育30 min洗片,加入DAB试剂盒并行显色反应,脱水、封片(PCNA 1∶2 000;VEGF 1∶100;MMP-9 1∶50);PCNA主要表达于细胞核,细胞核中出现棕黄色颗粒者为阳性细胞,VEGF和MMP-9主要表达于细胞质中,以细胞质中出现棕黄色颗粒为阳性,随机选取5个视野(×400),计算阳性细胞百分率,其数据处理由我院图像分析处理室专用软件完成。
1.3 统计学处理
采用SPSS 11.0统计分析软件进行数据分析,计量资料除特别说明外,采用表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PanIN细胞干扰前后细胞生长能力的变化
随着实验时间的延长,两组细胞数目有不同程度的增加,但PanIN-S组细胞数目较PanIN组增加明显,差异有统计学意义(P<0.05,图1)。
2.2 PanIN细胞干扰前后细胞增殖能力的变化
在体外软琼脂克隆形成中,随着实验时间的延长,与PanIN组相比,PanIN-S组细胞活力及增殖增强,差异有统计学意义(P<0.05,图2)。
2.3 PanIN细胞干扰前后细胞转移、侵袭能力的变化
与PanIN细胞组相比,PanIN-S细胞组细胞迁移及侵袭能力明显增加,差异有统计学意义(P<0.05,图3)。

图 1 两组细胞生长能力比较Fig. 1 Comparison of the growth curve between PanIN and PanIN-S cells
2.4 PCNA、VEGF和MMP-9在PanIN及PanIN-S移植瘤中的表达
PCNA主要表达于增殖的肿瘤上皮细胞中,以细胞核中出现棕黄色颗粒为阳性,结果显示,PanIN-S组表达阳性率显著高于PanIN组,分别为89.3%±10.1%、69.7%±8.5%,且差异有统计学意义(P<0.05,图4-6)。
VEGF和MMP-9主要表达于细胞质中,以细胞质中出现棕黄色颗粒为阳性结果显示,PanIN-S组表达阳性率显著高于PanIN组,且差异有统计学意义(P<0.05)。
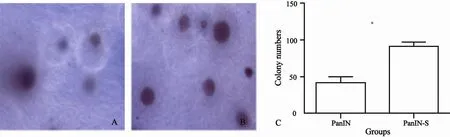
图 2 两组间软琼脂克隆形成数目比较Fig. 2 Comparison of the cloning numbers of cells in soft agar in different groups
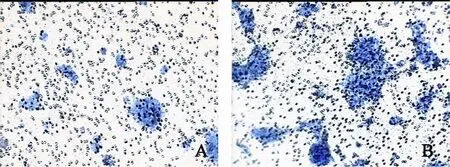
图 3 Transwell和Matrigel体外运动、侵袭实验Fig. 3 Cell migration and invasive assay by transwell (×200)

图 4 两组移植瘤中PCNA表达Fig. 4 The expressions of PCNA in PanIN and PanIN-S groups (×400)
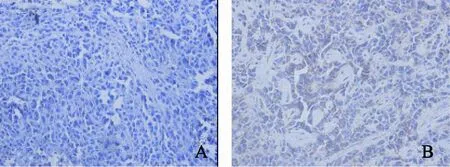
图 5 两组移植瘤中VEGF表达Fig. 5 The expressions of VEGF in PanIN and PanIN-S groups (×400)
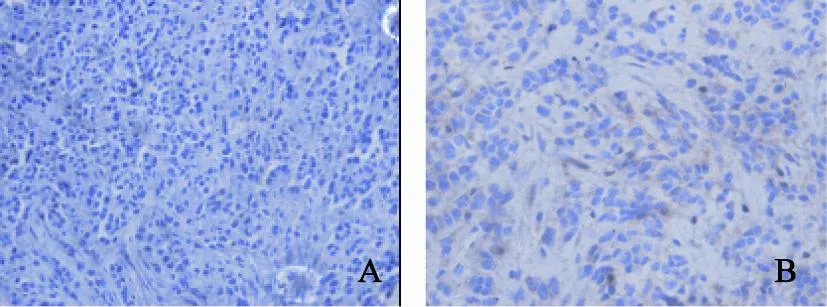
图 6 两组移植瘤中MMP-9表达Fig. 6 The expressions of MMP-9 in PanIN and PanIN-S groups (×400)
3 讨 论
由于PanIN是近几年提出的新术语并被认为是胰腺癌前病变,至今尚无他人分离和建立PanIN细胞株。以前获得的有关Smad4在早期PanIN细胞中表达而在后期PanIN和胰腺癌中缺失的证据主要来源于对外科术后PanIN和胰腺癌的混合性组织以及胰腺癌细胞株的分析而不是来自对PanIN细胞的研究[4]。文献报道,在PanIN及胰腺癌中Smad4基因突变率约50%,在其他肿瘤中Smad4基因的失活频率通常<10%,表明Smad4基因在PanIN及胰腺癌发生中是较特异的肿瘤抑制基因,深入研究其恶性转化机制具有重要意义[6]。抑癌基因Smad4是TGF-β信号传导途径中的关键性中间传导分子[7],而TGF-β是一种具有多功能活性的细胞因子,在组织的发育、再生、修复中起重要作用,并与肿瘤发生、转移等生物学改变密切相关。正常情况下,TGF-β-Smad4 信号传导途径通过阻断细胞周期中的G1/S转换和促进细胞凋亡而抑制细胞生长。Smad4缺失将促进上皮-间质的转换、细胞失控性生长等生物学效应,进而导致肿瘤的发生。
本研究采用台盼蓝染色细胞计数以及软琼脂克隆形成实验等方法证实,Smad4基因静默可促进PanIN细胞生长、增殖能力的增强,与Duda等[8]的研究结果一致。
Smad4参与调节细胞的增殖,可以解释其在PanIN恶性转化中的作用,而Smad4作为TGF-β-Smad4信号传导途径中关键分子,是否影响PanIN细胞的其他生物学行为,将是我们下一步研究关注的内容。本研究采用Transwell、侵袭实验及黏附实验,观察Smad4干扰前后PanIN细胞体外运动、侵袭能力,与PanIN组相比,PanIN-S组细胞迁移及侵袭能力明显增强,差异有统计学意义(P<0.05),与Han等[9]研究结果一致。
PCNA是一种酸性蛋白,仅在增生细胞中合成和表达,为DNA合成和复制所必需,在细胞增殖过程中起重要作用,是评价细胞增殖状态的重要指标。本实验中研究发现,PanIN-S组PCNA阳性表达率显著高于未干扰PanIN组,提示Smad4基因沉默可显著促进PanIN细胞增殖,并可发展为进展期胰腺导管腺癌,与体外研究结果一致。
肿瘤的发生,不仅涉及细胞增殖,其与血管形成、细胞外基质改变等亦密切相关;VEGF是体内一种强效力的促血管生成因子,能直接或间接参与血管生成,在肿瘤的发生、发展及预后中具有极其重要的地位。本研究采用免疫组化技术标记PanIN及PanIN-S移植瘤组织,结果显示,PanIN组VEGF阳性表达率较低,而PanIN-S组,其表达明显增加,提示VEGF可能与其远处转移高度相关。MMP-9是基质金属蛋白酶(MMPs)家族中的重要一员,主要功能是降解Ⅳ型胶原,而Ⅳ型胶原又是基底膜的主要成分,而基底膜的降解既是肿瘤浸润和转移过程中的关键步骤,同时又是肿瘤血管形成的重要环节,本研究结果显示,PanIN-S组表达阳性率显著高于PanIN组,且差异有统计学意义(P<0.05),提示Smad4静默小鼠转移性胰腺癌模型中,其远处转移可能与MMP-9高表达有密切关系。以上研究均与体外实验结果相符。
综上所述,本研究证实K-ras突变基础上小鼠PanIN细胞Smad4基因静默增强PanIN细胞增殖、侵袭能力;其增殖及转移可能与PCNA、VEGF和MMP-9高表达有关,有望为胰腺癌的靶向治疗提供新的思路,具有重要的潜在应用价值。
[1] KAWADA N, UEHARA H, TAKADA R, et al. Microinvasion of high-grade pancreatic intraepithelial neoplasia[J]. Case Rep Gastroenterol, 2013, 7(1): 30-36.
[2] HUSAIN K, CENTENO B A, CHEN D T, et al. Prolonged survival and delayed progression of pancreatic intraepithelial neoplasia in LSL-K-rasG12D/+;Pdx-1-Cre mice by vitamin E δ-tocotrienol[J]. Carcinogenesis, 2013, 34(4): 858-863.
[3] 王立夫, Hingorani S R, Tuveson D A. 内源性K-ras激活突变和Tp53失活突变共同作用产生干细胞胰腺癌[J]. 外科理论与实践, 2005, 10(3): 236-240.
[4] 齐晓光, 慎睿哲, 王立夫, 等. Smad4基因沉默促进裸鼠移植瘤增殖和微血管形成的研究[J]. 中国癌症杂志, 2009, 19(7): 585-590.
[5] HINGORANI S R, WANG L, MULTANI A S, et al. Trp53R172H and K-rasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice[J]. Cancer Cell, 2005, 7(5): 469-483.
[6] HRUBAN R H, TAKAORI K, CANTO M, et al. Clinical importance of precursor lesions in the pancreas[J]. J Hepatobiliary Pancreat Surg, 2007, 14(3): 255-263.
[7] LE GENDRE O, SOOKDEO A, DULIEPRE S A, et al. Suppression of AKT phosphorylation restores rapamycinbased synthetic lethality in SMAD4-defective pancreatic cancer cells[J]. Mol Cancer Res, 2013, 11(5): 474-481.
[8] DUDA D G, SUNAMUR A M, LEFTER L P, et al. Restoration of Smad4 by gene therapy reverses the invasive phenotype in pancreatic adenocarcinoma cells[J]. Oncogene, 2003, 22(44): 6857-6864.
[9] HAN L, ZHANG H W, Zhou W P, et al. The effects of genistein on transforming growth factor-β1-induced invasion and metastasis in human pancreatic cancer cell line Panc-1 in vitro[J]. Chin Med J (Engl), 2012, 125(11): 2032-2040.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
Smad4 silencing on PanIN cells accelerates K-ras G12D-mediated pancreatic neoplasia
QI Xiaoguang1, HU Yi1, WANG Jin-liang1, TAN Wen-long2, WANG Qi3, WANG Li-fu3, TUVESON DA4(1. Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China; 2. Shanghai Institute of Immunology, Shanghai Jiao Tong University, School of Medicine Shanghai 200025, China; 3. Department of Gastroenterology, Ruijin Hospital, Shanghai Jiao Tong University, School of Medicine, Shanghai 200025, China; 4. Cambridge Research Institute, Cancer Research UK, Cambridge CB2 ORE, UK)
WANG Li-fu E-mail: lifuwang2010@yahoo.cn
Background and purpose: Pancreatic intraepithelial neoplasia (PanIN) may be a precursor lesion of infiltrating pancreatic ductal adenocarcinoma. The mutation of the phenotypic impact of K-ras G12D alone, silencing of p53 and p16 could promote this process. The role of Smad4 in this progression was poorly understood. In our previous studies, we investigated that RNA interference silence of Smad4 to promote the PanIN cell malignant transformation. In the present study, we investigate. The further explores the siRNA interference of Smad4 expression on PanIN cells could lead to proliferation and metastasis in vitro and in vivo. Methods: Smad4 knock-down PanIN cells (PanIN-S) were established by stable transfection with lentiviral-mediated Smad4 RNA interference. In vitro,silence of Smad4 enhanced the proliferation of PanIN cells as determined by cell counting. A soft agar assay was used to assess the anchorage-independent growth ability of cells. Cell migration and invasion assays were performed using transwell chambers with or without Matrigel. In xenograft model experiments, PCNA, VEGF and MMP-9 staining was separately used to evaluate cell proliferation and angiogenesis and migration (VEGF and MMP-9). Results: Effect of siRNA of Smad4 gene in PanIN cells was confirmed by real-time RT-PCR and western blot. In vitro, silence of Smad4 enhanced the proliferation of PanIN cells as determined by cell counting. Soft agar assay showed that there were more colony cell numbers in PanIN-S cells compared with PanIN cells (P<0.05). Using the transwell assay, we observed that PanIN-S cells migrated faster than PanIN cells and similar results were obtained by Matrigel assay (P<0.05). Furthermore, immunohistochemical analysis of the harvested tumors suggested that Smad4 silencing was associated with cell proliferation (PCNA reactivity) and angiogenesis and migration (VEGF and MMP-9), and the expressions of PCNA, VEGF and MMP-9 in PanIN-S group were significantly increased (P<0.05). Conclusion: Silence of Smad4 in PanIN cells enhanced progression to invasive adenocarcinoma of the pancreas by promoting cell growth, migration and invasion. Smad4 might be a new diagnostic marker in pancreatic cancer and prove to be a feasible and novel target for therapeutic intervention.
siRNA interference; Smad4 gene; PanIN cell; Proliferation; Migration
10.3969/j.issn.1007-3969.2013.07.001
R735.9
:A
:1007-3639(2013)07-0481-06
2013-03-22
2013-05-18)
国家自然科学基金(No:30672385)。
王立夫 E-mail:lifuwang2010@yahoo.cn

