线粒体突变及不稳定在胃癌中的研究
张 伟
山东泰安解放军88医院消化科,山东泰安271000
胃癌的发生、发展存在许多基因通路,单独用核基因结构或表达异常,有时很难阐明肿瘤发生过程中的一些生物学行为的变化。除核基因外,细胞质中的线粒体mtDNA基因组异常是否也参与了肿瘤的形成,必须从不同角度探索遗传物质与肿瘤的关系,这也是近年来线粒体及mtDNA受到肿瘤研究者高度重视的一个原因。我们利用激光显微切割技术分离胃癌组织及其切缘的正常组织,对胃癌中线粒体D-loop调控区D-loop-(CA)n基因进行突变筛查及测序分析,同时进行线粒体D-loop非编码区(CA)n重复序列的不稳定(mtMSI)检测,了解胃癌mtDNA突变频率、类型、突变位点的分布及mtDNA不稳定的变化,探讨胃癌mtDNA突变、mtDNA不稳定在胃癌发生、发展中的作用。
1 材料与方法
1.1 材料
1.1.1 一般资料:61例胃腺癌及其切缘正常组织标本,男47例,女14例,年龄29~76岁,肠型34例,弥漫型27例。胃癌患者均知情并签署知情同意书。
1.1.2 主要仪器:带PEN膜的载玻片:德国PALM公司;激光捕获显微切割操作仪:德国PALM公司;恒温水浴锅:上海跃进医疗仪器厂;PCR扩增仪:美国PE公司;医用微波炉:日本松下公司;光学显微镜:日本Olympus公司;离心机:德国Eppendorf公司;WAVETM核苷酸片段分析系统:美国Transgenomic公司。
1.1.3 试剂:二甲苯、无水乙醇、伊红、Tris碱、EDTA、氯化钠、SDS、氯仿、异戊醇及醋酸钠均购自北京化工厂;蛋白酶K、Taq plus DNA多聚酶(2 U/μl)均购自北京鼎国生物科技中心。Pfu DNA聚合酶 (2 U/L)、10 mmol/LdNTP、10 ×PCR buffer(不含 Mg2+)、20 mmol/L MgCl2均为美国Promega公司并均购自上海博亚公司。
1.1.4 线粒体D-LOOP-(CA)n基因扩增区域、引物序列及片段长度:扩增区域459-639;引物序列:上游引物 5'-CCTCCCACTCCCATACTACTAA-3',下游引物 5'-GTGATGTGAGCCCGTCTAAACA-3';片段长度 180 bp。
1.2 方法
1.2.1 激光显微切割石蜡切片的制备、染色过程:石蜡标本依病理学常规方法制备5 μm连续切片3张。1张用于HE染色,观察组织中癌巢分布情况并标记定位;另2张同常规方法40℃捞片,贴于带PEN膜的载玻片上,56℃烤片过夜,依下列步骤处理后不封片用于显微切割:二甲苯脱蜡2 min×2次,无水乙醇水化1 min,96%乙醇水化1 min,70%乙醇水化1 min,双蒸水冲洗,伊红染色1 min,双蒸水冲洗,96%乙醇脱水1 min,96%乙醇脱水1 min,无水乙醇脱水1 min,无水乙醇脱水1 min,37℃ 30 min烤干。
1.2.2 激光显微切割胃癌及其切缘正常组织:采用德国PALM公司LCM系统进行切割。将待切割的组织切片置于倒置显微镜载物台上,对照HE切片,在显微镜下选定要切割的区域,并将该区域调节至视野中心,用紫外激光微束进行显微切割,将肿瘤组织与周围间质完整分割开来,并切割正常胃黏膜组织作对照。切割后利用激光压力弹射,使被切割细胞与载玻片分离,弹射入加有2 μl裂解液的Eppendorf管的管盖,弹射的细胞将粘在管盖的内表面,盖上管盖,13 000 r/min离心1 min(离心半径10 cm),之后在Eppendorf管中加入上述同样含蛋白酶K的裂解液至50 μl,蛋白酶K 55℃消化过夜后,99℃煮10 min,灭活蛋白酶K,4℃保存。
1.2.3 显微切割组织基因组DNA提取:在上述切割样品中加入等体积的氯仿与异戊醇混合物(24∶1);室温离心15 s;将水相移入一新管,如交界处有白色沉淀,重提有机相,合并水相;加入1/10体积的3 mol/L pH 5.2醋酸钠,混匀;加入2~2.5倍体积的冰无水乙醇;置干冰上5 min或更长时间;离心5 min,去上清;加1 ml室温70%乙醇,颠倒数次,离心5 min;去上清,干燥沉淀,溶于TE。
1.2.4 PCR扩增反应体系 (50 μl):10×Buffer 5.0 μl;10 mmol/L dNTP 1.5 μl;20 mmol/L MgCl23.75 μl;上游引物 (10 μmol/L)1.5 μl;下游引物 (10 μmol/L)1.5 μl;Pfu DNA 聚合酶 (2 U/μl)1.25 μl;DNA 模板 (50 ng/μl)2.0 μl;ddH2O 33.5 μl。PCR扩增条件:95℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸45 s,共40个循环;最后72℃延伸5 min。
1.2.5 产物鉴定:PCR产物用2.0%琼脂糖凝胶电泳(60 V,30 min),紫外观察PCR产物含量和特异性。
1.2.6 DHPLC分析:DHPLC筛选突变:5 μl扩增PCR产物,不需纯化,预先在PCR扩增仪上95℃变性3 min,以1℃/min的速度缓慢降温至45℃,以形成异源双链和同源双链DNA分子混合物。将待分析PCR产物放入DHPLC进样室。检测器为紫外分光光度计(260 nm),紫外检测系统在260 nm波长处读取洗脱液中DNA成分的最大吸光值,吸光值经系统处理后,信号被输送到监视屏上形成DHPLC色谱曲线即DHPLC峰型图。每份样品在各自最佳变性温度和洗脱条件下按点突变方式分析。DHPLC筛选突变的判断标准:匹配的同源双链除溶剂峰、引物峰和杂质峰外,在目标产物处应出现1个单峰,且峰的对称参数应接近于1,如峰数超过1个,或出现肩峰及不对称峰,则表明存在匹配的异源双链,异源双链将被测序以识别。PCR产物经DHPLC检测获得的阳性片段,都经DHPLC重新检测证实。
DHPLC检测微卫星不稳定:①每次检测标本均取待检测组织、待检测组织相对应的正常组织及1例完全正常胃黏膜组织的3种PCR产物用于DHPLC检测,此例完全正常胃黏膜组织作为DHPLC内标。自动进样,进样量5 μl/针;流动相为0.1 mol/L N-三乙基乙酰胺(TEAA,色谱纯)和不同浓度的乙腈梯度洗脱,梯度由控制软件WAVEMarker 4.0根据待测核苷酸序列自动生成,流速0.9 ml/min;检测器为紫外分光光度计(260 nm)。② 反应时间、条件:检测时间15.6 min,使用以下乙腈浓度梯度:开始8.75%,3 min增至13.75%,7 min增至16.25%,维持0.5 min,然后在0.5 min内增至25%,维持0.5 min进行洗脱,然后在0.5 min内降至8.75%,并持续1 min进行平衡。
DHPLC检测微卫星不稳定判断标准:① 待检测组织与其相对应的正常组织、内标的DHPLC波峰不重叠,则判断为微卫星不稳定。② ≥30% ~40%阳性位点为高MSI(MSI-H);<30% ~40%阳性位点为低MSI(MSI-L);无阳性位点为MSS。
1.2.7 序列测定:PCR产物送上海博亚公司,经过树脂纯化,用Big Dye Terminator Cycle Sequencing Ready Reaction Kit(PE,Fostercity,CAUSA)进行双向测序反应。测序反应产物经酒精沉淀后在ABI377DNA测序仪上电泳。
1.2.8 序列分析:应用MEDLINE提供的BLAST应用程序,比较测序获得的各片段序列与数据库中序列差异。与人类mtDNA Cambridge标准序列对比,获得突变位点及突变类型。与mtDNA突变数据库和肿瘤mtDNA突变文献资料对比,并分析突变所导致的氨基酸改变。
1.3 统计学处理 用SPSS 8.0统计软件包进行统计计算。对于符合正态分布的计量资料组间比较采用t检验或F检验(方差分析),不符合正态分布的资料采用Mann-whitney U检验。频数比较用卡方(chisquare)检验。P<0.05为差异有统计学意义。
2 结果
2.1 D-loop调控区突变及不稳定 D-loop调控区是胃癌mtDNA突变率较高的区域,61例胃癌组织样本中,DHPLC及测序检出31例D-LOOP-(CA)n异常,占50.8%,胃癌组织与非癌组织DHPLC峰型存在差异,正常胃黏膜组织测序无异常,为获得性体细胞突变。突变以单个碱基转换为主,碱基插入或丢失为辅。有2个位点位于D-loop区,491位点有12例胃癌正反向测序均发现碱基T→C。另外514位点共有18例测序示(CA)5→(CA)4及(CA)5→(CA)7。29.5%(18/61)发生重复序列(CA)n的线粒体不稳定;在18例(29.5%)线粒体不稳定(mtGI)中有16.4%(10/61)同时发生点突变,有8例同时存在nMSI-H,mtMSI与nMSI之间差异有统计学意义(P<0.05)。
2.2 线粒体D-loop-(CA)n的PCR扩增结果 线粒体D-loop-(CA)n的PCR扩增片段为180 bp(见图1)。
图1 D-loop-(CA)n的PCR扩增片段Fig 1 D-loop-(CA)n gene PCR amplification fragment
2.3 DHPLC筛选胃癌及其切缘正常组织的线粒体突变色谱图 D-loop-(CA)n基因胃癌及其切缘正常组织检出典型DHPLC异源双链色谱图(见图2)。
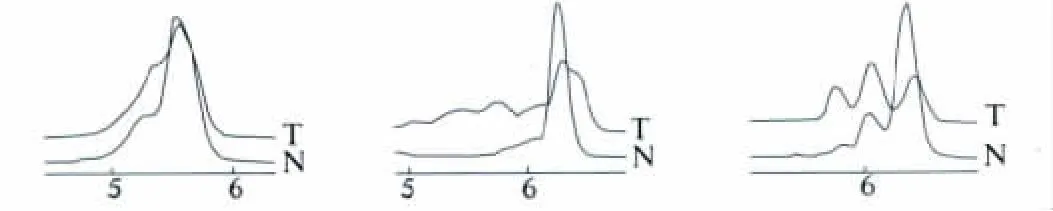
图2 癌组织比正常组织显示出额外的峰型 T:癌组织;N:正常组织Fig 2 Cancer tissue showed extra peak pattern compared with normal tissue T:Cancer tissue;N:Normal tissue
3 讨论
线粒体及mtDNA异常在细胞代谢、凋亡、能量转化、增殖、分化和信号传导等各个方面都发挥着重要作用。线粒体基因组按照其功能可分为几个功能单元,即调控mtDNA复制、转录的D-loop区,与线粒体核糖核蛋白体组成相关的rRNA基因群,编码蛋白参与电子传递链酶复合体Ⅰ、Ⅲ、Ⅳ组成的NDx、COx、Cytb基因群,ATP合成相关的复合体Ⅴ基因群。组成这几个功能单元的基因,有共同的生物学作用,各单元中任何一个基因异常都可能影响该单元的功能。mtDNA是线粒体自身的遗传物质,由于其所处的环境及其自身的某些缺陷,易受致癌物的攻击,而成为致癌物损伤的靶点,使mtDNA突变或发生微卫星不稳定性(mtMSI)改变。mtDNA异常一直是衰老、母系遗传性疾病研究的热点,现有研究也证实许多肿瘤存在线粒体基因突变或表达异常[1]。研究资料表明肿瘤细胞mtDNA的变异率是核DNA的10倍[2],mtDNA突变是导致肿瘤发生的一种起始因素。
为进一步了解线粒体突变及不稳定是否存在于胃癌中,mtDNA异常是否参与胃癌的发生、发展及其机制,我们利用激光显微切割获取纯净的胃癌组织,选取mtDNA的非编码调控区D-loop-(CA)n基因,通过变性高效液相色谱及测序分析等技术研究了61例胃癌组织及对应正常组织mtDNA的突变及不稳定,进一步了解mtDNA异常与核基因组异常的关系及其在胃癌发生、发展中的作用。本研究结果说明胃癌组织中存在体细胞突变。结果显示胃癌组织样本中D-loop调控区D-LOOP-(CA)n基因有较高频率的突变,提示线粒体D-LOOP-(CA)n基因功能异常可能参与了胃癌癌变,与文献结果一致[3],而且胃癌mtDNA基因组突变率与其他肿瘤mtDNA基因组突变率具有可比性。Fliss等[4]在肺癌、膀胱癌、头颈部肿瘤组织标本中,检出的体细胞突变频率分别为50%(6/14)、64%(9/14)和46%(6/13)。与文献资料相比,本研究检测结果基本上反映了胃癌mtDNA基因组突变的状况。
另外本实验结果显示mtDNA不稳定性(mtGI)是线粒体基因组突变的另一种形式,推测D-loop区出现的高频率mtGI可能对线粒体DNA的复制或转录调控产生一定影响。Habano等[5]报道胃癌中16%的病例出现mtMSI表型,且mtMSI常与mtDNA损伤或突变同时存在。本实验在18例线粒体不稳定(mtMSI)中有16.4%(10/61)同时发生D-loop点突变,表明线粒体不稳定与线粒体突变有关;其次18例mtMSI中有8例同时存在nMSI-H,mtMSI与nMSI比较差异有统计学意义(P<0.05),胃癌除表现细胞核基因不稳定以外,还表现为线粒体基因不稳定,与文献报道相似[6-7]。由此表明线粒体DNA不稳定、线粒体突变与核基因组不稳定可能共同参与了胃癌的发生、发展。
[1]Penta JS,Johnson FM,Wachsman JT,et al.Mitochondrial DNA in human malignancy[J].Mutat Res,2001,488(2):119-133.
[2]Wallance DC.Mitochondrial DNA sequence variation in human evolution and disease[J].Proc Natl Acad Sci U S A,1994,91(19):8739-8746.
[3]Hiyama T,Tanaka S,Shima H,et al.Somatic mutation of mitochondrial DNA in Helicobacter pylori-associate chronic gastritis in patients with and without gastric cancer[J].Int J Mol Med,2003,12(2):169-174.
[4]Fliss MS,Usadel H,Caballero OL,et al.Facile detection of mitochondrial DNA mutations in Tumors and bodily fluids[J].Science,2000,287(5460):2017-2019.
[5]Habano W,Sugai T,Yoshida T.Mitochondrial gene mutation,but not large-scale deletion,is a feature of colorectal carcinomas with mitochondrial microsatellite instability [J].Int J Cancer,1999,83(5):625-629.
[6]Sano K,Takayanagi K,Kaneko T,et al.Application of short tandem repeat of genomic DNA and mitochondrial DNA for identification of mixed-up tissue specimens[J].Pathol Int,2000,50(1):1-6.
[7]Machado AM,Figueiredo C,Touati E,et al.Helicobacter pylori infection induces genetic instability of nuclear andmitochondrial DNA ingastriccells[J].Clin Cancer Res,2009,15(9):2995-3002.

