早期断奶对仔猪小肠碱性磷酸酯酶活力的影响
王秋菊崔一喆*孙 鹏朱 双
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江省农垦总局北安分局龙门农场,五大连池 164145)
小肠碱性磷酸酯酶(alkaline phosphatase,AKP)在细胞分化、致病菌脂多糖内毒素的解毒、维持内腔pH,组织内磷酸盐消化和脂肪吸收等方面起重要作用。AKP是细胞分化作用酶,是小肠肠道消化和吸收功能发生改变的标志酶[1]。小肠AKP的生理功能包括水解磷酸盐[2]、跨细胞溶质运输[3]以及参与脂肪的吸收[4]等。最近,有研究显示小肠AKP能够增加碳酸氢盐分泌进肠道的活力,从而允许酸性的胃的消化物被中和后进入小肠,给小肠AKP活力的发挥创建有利条件[5]。同样,人们也认识到了小肠AKP作为内源的解毒因子对肠道黏膜免受致病菌脂多糖危害的防御功能[6-7],并且这个功能靠肠内营养维持着[8]。因此,理解断奶仔猪小肠AKP消化能力以及细胞内AKP含量的变化将会增进肠道生理学的知识,同时为提高保育期仔猪营养和生长提供理论基础。
尽管出生后发育和4~6周龄断奶仔猪体内的AKP活力变化已经被报道过[9],但关于小肠细胞内AKP活力和含量的研究还未见报道。因此,本试验旨在研究早期断奶对仔猪小肠和小肠细胞内AKP活力的影响。
1 材料与方法
1.1 试验动物分组与饲养管理
试验于2010年5月在黑龙江省齐齐哈尔市养猪示范基地进行。选取10日龄、体重[(4.48±0.26)kg]相近的“杜×长 ×大”三元杂交仔猪40头(分别由40头母猪生产),随机分为2组,每组20个重复,每个重复1头仔猪,2组仔猪分别以随母猪哺乳和早期断奶方式饲养。试验期10 d。
哺乳仔猪:在哺乳仔猪舍,随母猪继续哺乳10 d;断奶仔猪:在保育仔猪舍饲养,饲喂玉米-豆粕型商业断奶饲粮10 d,每天07:00、12:00和17:00共饲喂3次,自由饮水。饲粮营养水平参考NRC(1998),断奶饲粮组成及营养水平见表1。
断奶仔猪猪舍为封闭式,通风良好,水泥地面;采用单栏隔离饲养,每栏1头仔猪;栏内一角上方距地面0.8 m处悬挂红外取暖灯,灯下地面铺1块0.5 m×1 m的吸热板,以保证仔猪温暖。

表1 断奶饲粮组成及营养水平(干物质基础)Table1 Composition and nutrient levels of the weaner diet(DM basis) %
1.2 试验样品采集与处理
饲养试验结束后第1天清晨,从各组中随机选取12头仔猪,共计24头。屠宰后,打开仔猪腹腔,将十二指肠悬韧带到小肠远端的全部小肠都取出,立即用冰生理盐水冲洗小肠内部。将各段小肠分别称鲜重,并从每部分的中间段取样,装到样品收集管中暂时用液氮冷冻保存[10]。冷冻后的肠段样品,用研钵在液氮存在的条件下研磨成粉末状,-80℃冷冻保存。
1.3 样品制备
组织匀浆:称取约1.3 g粉末状的冷冻的小肠组织样品,按照1 g样品20 mL匀浆缓冲液的比例,用冷藏的含有蛋白酶抑制剂的匀浆缓冲液将样品解冻,并用多层匀浆仪将样品匀浆。匀浆时,每个样品16 000 r/min匀浆3 min,且每隔1 min,停顿20 s。匀浆后的样品,称量并记录匀浆液的总体积,取2 mL匀浆液样品于-80℃超低温冷冻保存。
细胞内质:根据 Mei等[11]的试验方法,采用Mg2+-沉淀反应和4℃差异离心的方法制备细胞内质样品。具体为组织匀浆液于4℃、2 000×g离心15 min。上清液用1 mol/L MgCl2溶液混合,并将离心管平铺在冰上,放入水浴振荡器,低速振荡15 min,使得混合液中 MgCl2终浓度为10 mmol/L。将混合液于 4℃、2 400×g离心15 min。丢弃上层泡沫层,上清液即为细胞内质样品。称量细胞内质样品总体积,并从中取2 mL样品于-80℃冷冻保存。
细胞顶膜:将余下的细胞内质样品分装于真空超速低温离心机专用离心管中,用含有10 mmol/L MgCl2的重悬浮缓冲液平衡各离心管质量,使得各离心管质量之差小于0.001 g,达到平衡。于4℃、19 000×g真空超速离心30 min。吸取上清液,得到的沉淀即为粗制的细胞顶膜样品。将沉淀用重悬浮缓冲液重新悬浮到距离离心管管口5 cm处,重新平衡各离心管的质量,于4℃、39 000×g真空离心30 min,沉淀为目的细胞顶膜样品。将沉淀用悬浮缓冲液重新悬浮成0.5 mL细胞顶膜悬浮液,全部于 -80℃冷冻保存。
1.4 小肠AKP活力的测定
1.4.1 制备标准曲线
采用对硝基苯酚反应测定小肠AKP的活力。首先制备2.5 mmol/L对硝基苯酚标准贮存液,并分别 稀 释 为 0.521、1.042、3.125、6.250 和10.417 μmol/L的磷酸对硝基苯酚底物溶液。然后用0.25 mol/L NaOH溶液分别稀释6个梯度的标准品测定液,各标准品管硝基苯酚终浓度为0、6、40、60、90 和120 nmol/L。每个标准浓度做3 个平行。吸取标准溶液到比色皿中,在分光光度计400 nm读取吸光度值,制作标准曲线。
1.4.2 样品测定
用已制得的小肠组织匀浆、细胞内质和细胞顶膜样品,根据其蛋白质含量,将样品稀释至蛋白质浓度为1.0 mg/mL,用于AKP活力的测定。具体步骤为:每个样品做3个平行,移取80 μL稀释样品溶液到每个试管中,并放在装有冰的盒子内预冷。在每个试管中分别加入1.920 mL底物溶液,涡旋混合均匀,37℃水浴孵育样品20 min。孵育结束后,在每个试管中加 2 mL 0.5 mol/L NaOH溶液并涡旋混合均匀,停止反应。同时做空白对照,在每个空白试验管中加入2 mL 0.5 mol/L NaOH溶液,再加入80 μL样品。将所有试管于1 500 r/min离心10 min,以沉淀蛋白质。吸取上清液到比色皿中,用紫外分光光度计在400 nm处读取吸光度值。
AKP活力单位定义为:37℃每分钟催化产生1 μmol对硝基苯酚的酶量(mg prot)为1个活力单位。
测定结果根据米-门二氏方程式酶动力学基本方程式,通过Fig.P曲线拟合程序获得AKP活力的动力学参数估计。米氏常数(Km)为最大酶活力(Vmax)达到1/2时,酶作用底物的浓度;Km越大,酶亲和力越小。小肠各肠段AKP的消化能力(Vcap)根据Weis等[12]的公式进行计算。

式中,Vcap为某一肠段AKP的消化能力[mol/(kg BW·d)],Vmax为该肠段的AKP最大酶活力[μmol/(mg prot·min)],W 为该肠段的鲜重(g),P为该肠段的蛋白质含量(mg prot/g,鲜重基础),BW为仔猪的体重(kg)。
1.5 小肠AKP相对含量的测定
1.5.1 总蛋白质含量的测定
根据Bradford分析方法,使用牛血清蛋白(级分IV)作为标准品,测定组织匀浆、细胞内质和细胞顶膜样品中总蛋白质的含量。
1.5.2 免疫印迹(Western-blot)法
制得蛋白质含量为1 μg/μL的样品,以β-肌动蛋白为内参,进行Western-blot。小肠AKP一抗用兔抗人多克隆抗体,1∶15 000稀释;β-肌动蛋白一抗用鼠抗人单克隆抗体,1∶20 000稀释;二抗均用兔抗人免疫球蛋白G,1∶20 000稀释。
1.6 数据统计分析
试验数据采用SAS 9.0软件中one-way ANOVA及t检验进行分析。以P<0.05为差异显著。结果采用Fig.P曲线拟合软件绘制柱状图和曲线图。
2 结果
2.1 早期断奶对仔猪生长性能的影响
由表2可见,在10 d的饲养试验期间,断奶仔猪的平均日采食量为148.50 g/d,料重比为3.58,与哺乳仔猪相比,断奶仔猪的末重显著降低(P<0.05),同时断奶仔猪的平均日增重极显著低于哺乳仔猪(P<0.01)。提示早期断奶对仔猪生长有极强的抑制作用。

表2 仔猪的生长性能Table 2 Growth performance of piglets(n=20)
2.2 早期断奶对仔猪小肠AKP活力的影响
由表3可见,与哺乳仔猪相比较,断奶仔猪十二指肠、空肠和回肠Km分别显著提高了27%、17%和6%(P<0.05);断奶仔猪整个小肠 Km显著提高了17%(P<0.05);表明断奶仔猪整个小肠和小肠各段的AKP亲和力均显著降低(P<0.05)。
断奶仔猪十二指肠、空肠和回肠AKP最大酶活力较哺乳仔猪分别显著降低了26%、36%和26%(P<0.05),且整个小肠的AKP最大酶活力显著降低了30%(P<0.05)。
与哺乳仔猪相比,断奶仔猪十二指肠、空肠和回肠的AKP消化能力分别显著降低了39%、22%和20%(P<0.05),整个小肠AKP消化能力显著降低了23%(P <0.05)。
小肠各肠段AKP活力动力学曲线如图1所示,可见哺乳仔猪各肠段AKP活力均高于断奶仔猪,且各肠段变化趋势一致。

表3 仔猪小肠各肠段AKP的Km、最大酶活力和消化能力Table 3 Km,maximal enzyme activity and digestive capacity of alkaline phosphatase in different segments of small intestine of piglets(n=72)
空肠AKP的消化能力约占整个小肠AKP消化能力的72%(表3)。因此,对空肠细胞内质和细胞顶膜中AKP消化能力进行了进一步的分析,观察AKP消化能力在空肠中的再分配。
由表4可见,断奶与哺乳仔猪相比较,空肠细胞内质和细胞顶膜AKP的Km分别显著提高了48%和49%(P<0.05),提示空肠细胞内质和细胞顶膜AKP的亲和力均显著降低(P<0.05)。
断奶和哺乳仔猪空肠细胞顶膜AKP最大酶活力占空肠AKP最大酶活力的90%左右,断奶没有显著影响空肠细胞内质AKP的最大酶活力(P>0.05),而断奶仔猪空肠细胞顶膜AKP最大酶活力比哺乳仔猪显著降低了10%(P<0.05)。
断奶和哺乳仔猪空肠细胞顶膜中AKP消化能力占空肠AKP消化能力的98%以上。与哺乳仔猪相比,断奶仔猪空肠AKP的消化能力在细胞内质和细胞顶膜中分别显著降低了17%和13%(P <0.05)。
由仔猪空肠细胞内质和细胞顶膜中AKP活力动力学曲线(图2)可见,断奶仔猪空肠细胞内质和细胞顶膜中AKP活力均低于哺乳仔猪,且随底物浓度增加,变化趋势一致。

图1 仔猪小肠AKP活力动力学曲线Fig.1 Kinetic curves of activity of small intestinal alkaline phosphatase of piglets

表4 仔猪空肠细胞内质和细胞顶膜AKP的Km、最大酶活力和消化能力Table 4 Km,maximal enzyme activity and digestive capacity of jejunal intracellular and cell apical membrane-bound alkaline phosphatase of piglets(n=72)
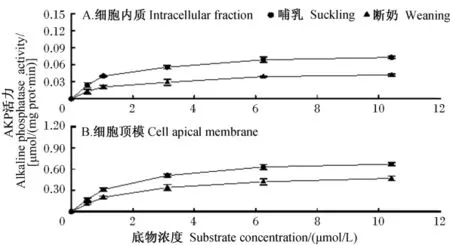
图2 仔猪空肠细胞内质和细胞顶膜中AKP活力动力学曲线Fig.2 Kinetic curves of activities of jejunal intracellular and cell apical membrane-bound alkaline phosphatases
2.3 早期断奶对仔猪空肠AKP相对含量的影响
由图3可见,从空肠组织匀浆、细胞内质和细胞顶膜中成功鉴定出60 ku的AKP。与哺乳仔猪相比,断奶仔猪空肠组织匀浆、细胞内质和细胞顶膜的AKP相对含量分别显著降低了48%、53%和64%(P <0.05)。
通过皮尔森相关性分析得到,哺乳和断奶仔猪空肠组织匀浆(r=0.51,P=0.023)、细胞内质(r=0.41,P=0.032)和细胞顶膜(r=0.52,P=0.020)的小肠AKP最大酶活力与相对含量均呈显著正相关。

图3 仔猪空肠组织匀浆、细胞内质和细胞顶膜中AKP相对含量Fig.3 Relative content of alkaline phosphatase in jejunal tissue homogenate,intracellular fraction and cell apical membrane of piglets(n=72)
3 讨论
断奶过程伴随着包括仔猪在内的多数哺乳动物幼仔的采食量下降[13],且使幼仔经受营养和环境的双重压力[14],因此与正常哺乳的幼仔相比,由于胃肠道未发育成熟,断奶导致仔猪生长性能降低。在试验究中,早期断奶仔猪显示出明显的断奶应激症状,断奶仔猪的平均日采食量为148.50 g/d,低 于 NRC(1998)饲 养 标 准 中240 g/d,断奶仔猪的平均日增重极显著低于同期哺乳组仔猪。Gu等[15]研究表明,哺乳动物新生儿在离开它们的母亲断奶时,遭受着巨大的肠道结构和功能的变化,直接影响到仔猪肠道的消化与吸收功能,进而影响仔猪的生长发育。
AKP被称为经典的非特异性金属酶二聚体。这些酶在自然界广泛存在于从细菌到哺乳动物的生物体中,存在于最基本的生命过程中。尽管AKP作用的生理机制仍然不明确,但无机磷酸盐缺乏会诱导许多物种产生AKP(尤其是原核生物),并且在磷酸盐代谢中起重要作用。
大多数生物体中的AKP以二聚体的形式存在,它可以催化磷酸单酯水解生成无机磷酸盐和酒精。小肠AKP是一种可以水解磷酸酯的肠刷状缘蛋白,在解毒致病菌内毒素、保持肠腔pH、有机磷的消化和脂肪的吸收过程中发挥作用,其基因表达依赖肠上皮细胞分化。小肠AKP被认为是小肠消化和吸收功能发生变化的重要标记酶[16]。小肠AKP的生理功能包括水解磷酸酯[17]、溶质的跨细胞膜转运、参与脂肪的吸收[18-19]。作为肠黏膜内源性解毒因子,小肠AKP对于防御肠腔致病细菌内毒素中毒的作用已明确[20-21],这种作用可以通过肠内营养来维持。Fan等[22]研究显示,仔猪肠上皮细胞在哺乳到19日龄时完全被替换掉,而空肠上皮细胞在新生仔猪中的生存期为10 d,仔猪出生后空肠AKP催化活力从哺乳到断奶呈降低趋势。但目前为止,关于断奶对小肠AKP活力影响的研究很少。
从本试验结果可以看出,空肠AKP消化能力占整个小肠AKP消化能力的72%,起主导作用;在空肠中,细胞顶膜AKP消化能力占空肠AKP消化能力的98%以上。与正常哺乳仔猪相比,早期断奶对小肠AKP最大酶活力、消化能力和酶亲和力都有显著影响,早期断奶显著地降低了仔猪整个小肠肠段AKP的最大酶活力和消化能力。本试验验证了早期断奶仔猪空肠中AKP消化能力、最大酶活力以及小肠AKP的亲和力降低,为早期断奶造成仔猪的易感性和阻碍生长做出理论解释,即断奶仔猪易感染肠道疾病的原因之一是空肠AKP的保护作用降低。
本试验的主要目的是研究早期断奶仔猪与哺乳仔猪小肠AKP活力的差异。结果显示,断奶显著降低了仔猪小肠AKP消化能力和空肠前端的AKP最大酶活力。目前关于断奶对小肠AKP活力和其基因表达影响的研究报道很少,本试验结果发现断奶仔猪小肠AKP最大酶活力和消化能力都降低,与Miller等[23]的研究结果相反,该研究结果显示3周龄和5周龄断奶的仔猪小肠AKP活力没有显著变化。2点原因可以解释为什么本试验与该研究结果不一致。第一,断奶时间不同,本试验仔猪在10日龄断奶10 d后测定,Miller等[23]的研究是在仔猪5周龄时断奶后5 d测定;第二,本试验测定了小肠AKP的最大酶活力,而Miller等[23]的研究中只用了一个 AKP的底物浓度(1.5 mmol/L)。因此,本试验测定的小肠AKP特定活力较Miller等[23]研究的最大酶活力低很多。图1和图2可以证明比最大酶活力低时测定的小肠AKP特定活力受到底物浓度的影响,而小肠AKP的消化能力和含量并不受底物浓度的影响。
Western-blot分析证实仔猪空肠前端细胞内质和细胞顶膜中的小肠AKP分子质量大约为60 ku,比人类肠道中的AKP分子质量小[24]。在新出生的小鼠空肠中检测到小肠AKP分子质量约为65 ku[25]。小鼠小肠AKP的编码mRNA的无细胞翻译产生2种小肠AKP单体,分子质量分别为62和65 ku[26]。理论上,空肠前端细胞内质和细胞顶膜中AKP的相对含量是小肠AKP生物合成和运输以及降解的净平衡[27]。哺乳和断奶仔猪,肠细胞顶膜的小肠AKP的最大酶活力大部分(98%)是空肠前段AKP的活力,暗示着在细胞中有很小的膜内AKP蛋白池。因此,早期断奶仔猪空肠前段AKP含量的下降主要是由于小肠AKP的蛋白质从头合成降低了,这仍需要从体外对小肠AKP进行标记和生物合成来继续研究和确定。另一方面,与早期断奶仔猪相比,哺乳仔猪的空肠前段AKP的亲和力也有显著变化。有研究显示,新出生仔猪空肠AKP亲和力从哺乳到断奶后期是逐渐降低的[23]。小肠AKP亲和力、最大酶活力和含量的在空肠前段的改变显示,早期断奶改变了小肠AKP的含量并降低了它的亲和力。这个小肠AKP亲和力的变化主要是由小肠AKP的糖基化的发生导致[22]。因此,空肠AKP最大酶活力和消化能力的降低是由小肠中AKP含量和亲和力降低的联合作用导致的。再者,已知新生儿在正常哺乳情况下,肠上皮细胞在出生19 d后完全更换,且新生儿空肠上皮细胞的寿命为10 d,可以推断,早期断奶通过影响肠上皮细胞更换过程中小肠AKP的蛋白质合成和转运来降低小肠AKP的消化能力。小肠AKP在肠道中有重要作用,包括解毒作用、维持腔内pH,消化有机磷酸盐和吸收脂肪,小肠AKP的消化能力、活力降低就会伴随着小肠AKP含量的降低,也就如本试验的结果所示。本试验结果为研究小肠中小肠AKP活力的调控机制提供了信息,也许可以用来解释早期断奶仔猪对肠道疾病和生长受阻易感性。
4 结论
总之,小肠AKP在小肠上皮黏膜中起重要作用,早期断奶可降低小肠AKP活力、亲和力、消化能力及含量,使仔猪承受腹泻和生长受阻的风险。
[1]陈彤,杨小燕,祁保民.猪增生性肠炎消化系统酶活性的变化[J].安徽农业大学学报,2011,38(2):267-270.
[2]CARVER J D,WALKER A.The role of nucleotides in human nutrition[J].Journal of Nutritional Biochemistry,1995,6:58 -72.
[3]GASSER K W,KIRSCHNER L B.The inhibition and disposition of intestinal alkaline phosphatase[J].Journal of Composive Physiology,1987,157:461 -467.
[4]ZHANG Y,SHAO J,XIE Q,et al.Immunolocalization of alkaline phosphatase and surfactant-like particle proteins in rat duodenum during fat absorption[J].Gastroenterology.1996,110:478 -488.
[5]AKIBA Y,MIZUMORI M,GUTH P H,et al.Duodenal brush border intestinal alkaline phosphatase activity affects bicarbonate secretion in rats[J].American Journal of Physiology,2007,293:G1223 - G1233.
[6]肖英平,洪奇华,刘秀婷,等.谷氨酰胺对断奶仔猪生长性能营养物质表观消化率空肠碱性磷酸酶活性及与肠道健康相关因子基因表达的影响[J].动物营养学报,2012,24(8):1438 -1446.
[7]GEDDES K,PHILPOTT D J.A new role of intestinal alkaline phosphatase in gut barrier maintenance[J].Gastroenterology,2008,135:8 -12.
[8]GOLDBERG R F,AUSTEN W G,ZHANG X,et al.Intestinal alkaline phosphatase is a gut mucosal defense factor maintained by enteral nutrition[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105:3551 -3556.
[9]FAN M Z,ADEOLA O,ASEM E K.Postnatal ontogeny of kinetics of porcine jejunal brush border membrane-bound alkaline phosphatase,aminopeptidase N and sucrase activities[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2002,132:599 -607.
[10]BURRIN D G,STOLL B,JIANG R,et al.Minimal enteral nutrient requirements for intestinal growth in neonatal piglets:how much is enough?[J].American Journal of Clinic Nutrition,2000,71:1603 -1610.
[11]MEI J,XU R J.Transient changes of transforming growth factor-beta expression in the small intestine of the pig in association with weaning[J].British Journal of Nutrition,2005,93:37 -45.
[12]WEIS S L,LEE E A,DIAMOND J.Evolutionary matches of enzyme and transporter capacities to dietary substrate loads in the intestinal brush border[J].Proceedings of the National Academy of Sciences of the United States of America,1997,95:2117 -2121.
[13]WANG X,HALD H,ERNST H A,et al.Over-expression,purification and characterization of an Asc-1 homologue from Gloeobacter violaceus[J].Protein Expression and Purification 2010,71:179 -183.
[14]KIARIE E,NYACHOTI C M,SLOMINSKI B A,et al.Growth performance,gastrointestinal microbial activity,and nutrient digestibility in early-weaned pigs fed diets containing flaxseed and carbohydrase enzyme[J].Journal of Animal Science,2007,85:2982 -2993.
[15]GU X,LI D,SHE R.Effect of weaning on small intestinal structure and function in the piglet[J].Archives of Animal Nutrition-Archiv Fur Tierernahrung,2002,56:275 -286.
[16]HODIN R A,CHAMBERLAIN S M,MENG S.Pattern of rat intestinal brush-border enzyme gene expression changes with epithelial growth state[J].American Journal of Physiology,1995,269:C385 - G391.
[17]CARVER J D,WALKER A.The role of nucleotides in human nutrition[J].Journal of Nutrition Biochemistry,1995,6:58 -72.
[18]GOLDBERG R F,AUSTEN W G,ZHANG X,et al.Intestinal alkaline phosphatase is a gut mucosal defense factor maintained by enteral nutrition[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105:3551 -3556.
[19]POELSTRA K,BAKKER W W,KLOK P A,et al.Dephosphorylation of endotoxin by alkaline phosphatase in vivo[J].American Journal of Pathology,1997,151:1163 -1169.
[20]GEDDES K,PHILPOTT D J.A new role of intestinal alkaline phosphatase in gut barrier maintenance[J].Gastroenterology,2008,135:8 -12.
[21]FAN M Z,STOLL B,BURRIN D G,et al.Enterocyte digestive enzyme activities along the crypt-villus and the longitudinal axis in neonatal pigs[J].Journal of Animal Science,2001,79:371 -381.
[22]FAN M Z,MATTHEWS J,ETIENNE N M P,et al.Expression of brush border L-glutamate transporters in epithelial cells along the crypt-villus axis in the neonatal pig[J].American Journal of Physiology,2004,287:G385-G398.
[23]MILLER B G,JAMES P S,SMITH M W,et al.Effect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients[J].Journal of Agricultural Science,1986,107:579 -589.
[24]ENGLE M J,MAHMOOD A,ALPERS D H.Two rat intestinal alkaline phosphatase isoforms with different carboxyl-terminal peptides are both membrane-bound bya glycan phosphatidylinositol linkage[J].Journal of Biological Chemistry,1995,270:11935 -11940.
[25]MALO M S,BISWAS S,ABEDRAPO M A,et al.The pro-inflammatory cytokines,IL-1beta and TNF-alpha,inhibit intestinal alkaline phosphatase gene expression[J].DNA Cell Biology,2006,25:684 - 695.
[26]YANG X,YANG C,FARBERMAN A,et al.The mammalian target of rapamycin-signaling pathway in regulating metabolism and growth[J].Journal of Animal Science,2008,86:E36 - E50.
[27]HIRASAKA K,TOKUOKA K,NAKAO R,et al.Cathepsin C propeptide interacts with intestinal alkaline phosphatase and heat shock cognate protein 70 in human Caco-2 cells[J].Journal of Physiology Science,2008,58:105 -111.

