清热解毒中药有效组分配伍对内毒素致大鼠感染性脑水肿的保护作用
姚明江 刘建勋 张 鹏 杨 斌 徐 立 王光蕊
(中国中医科学院西苑医院基础医学研究所,中药药理北京市重点实验室,北京,100091)
中药药效评价专题
清热解毒中药有效组分配伍对内毒素致大鼠感染性脑水肿的保护作用
姚明江 刘建勋 张 鹏 杨 斌 徐 立 王光蕊
(中国中医科学院西苑医院基础医学研究所,中药药理北京市重点实验室,北京,100091)
目的:探讨清热解毒中药黄芩、栀子等有效组分配伍而成的注射液(TLQN注射液)对内毒素(LPS)所致大鼠感染性脑水肿的脑保护作用及其可能机制。方法:70只SD大鼠随机分为正常组、模型组、清开灵组(3 mL/kg)、地塞米松组(10 mg/kg)、TLQN注射液低、中、高剂量组(24、47.5、95mg/kg)。经颈内动脉注射LPS(1 mg/kg)建立感染性脑损伤模型,各给药组在注入LPS后立即尾静脉注射相应药物。造模前以及造模6h后各测量一次体温。取各组脑组织标本,干湿法测定脑组织含水量,甲酰胺法检测脑组织伊文思蓝(EB)水平,HE染色后观察各组脑组织病理形态变化,酶联免疫法(ELISA)检测各组血清TNF-α、IL-6含量。结果:模型组体温、脑组织含水量和EB含量明显高于正常组(P<0.01),皮质及海马区存在广泛的神经元、胶质细胞损伤,血清TNF-α及IL-6水平显著升高(P<0.01);TLQN注射液可明显降低模型大鼠体温(P<0.05),减少脑组织含水量及EB含量(P<0.05,0.01),改善脑组织神经元、胶质细胞损伤,显著降低血清TNF-α和IL-6水平(P<0.05)。结论:清热解毒中药有效组分配伍对LPS致大鼠感染性脑损伤有保护作用,其机制可能与抑制TNF-α和IL-6等细胞因子过度产生有关。
清热解毒;组分配伍;脂多糖;感染性脑水肿;炎症
感染性脑水肿是由感染引起的,以血管源性脑水肿为主,同时有细胞毒性脑水肿存在的急性弥漫性混合性脑水肿,可导致颅内压增高、脑疝等并发症,是中枢神经系统感染性疾病重要死亡原因之一。目前治疗感染性脑水肿的手段有限,相关研究不多,制约了治疗感染性脑水肿深层次研究的开展。本研究利用内毒素脂多糖(LPS)建立大鼠感染性脑水肿模型,采用具有清热解毒功效中药有效组分配伍的注射液进行治疗,并观察其对感染性脑水肿大鼠模型体温、脑组织含水量、EB含量、脑组织病理形态学及血清TNF-α、IL-6的影响,探讨清热解毒中药有效组分配伍注射液(TLQN注射液)对感染性脑水肿的治疗作用,旨在为临床治疗提供实验依据。
1 材料与方法
1.1 实验动物及分组 雄性SD大鼠,体重190~210g,由维通利华实验动物技术有限公司提供,许可证号SCXX(京)2007-0001。随机分为7组:正常组、模型组、清开灵组(给药剂量3 mL/kg)、地塞米松组(给药剂量10 mg/kg)、清热解毒中药有效组分配伍注射液(TLQN)低、中、高剂量组(24、47.5、95 mg/kg)。
1.2 药品与试剂 清热解毒中药有效组分配伍注射液(TLQN注射液,其中黄芩苷、栀子苷含量分别为1.7、20 mg/mL)由西苑医院基础医学研究所药学室制备,原注射液设为高剂量组药物,实验前在超净台中以0.9%生理盐水将药物依次倍比稀释,得中、低剂量组药物。水合氯醛(上海国药集团化学试剂有限公司),生理盐水(北京双鹤药业股份有限公司),脂多糖(LPS大肠杆菌O55:B5,sigma公司),伊文思蓝(EB),清开灵注射液,磷酸地塞米松注射液。大鼠血清TNF-α、IL-6试剂盒由加拿大GBD公司生产(批号:T041-40,I046-10)。
1.3 动物模型制作方法 参照田培超[1]等造模方法,将实验动物以4%水合氯醛(1 mL/100g)腹腔注射麻醉,麻醉成功后取仰卧位固定,颈正中切口,分离右侧颈总动脉、颈内动脉、颈外动脉。结扎并电凝断右侧颈外动脉,残端保留5~8 mm,动脉夹暂时夹闭右颈总动脉近心端,从右侧颈外动脉残端向颈内动脉注入LPS(1 mg/kg),注射完成后,结扎穿刺部位,并松开颈总动脉处动脉夹,恢复本侧血供。各给药组在注入LPS后立即尾静脉注射相应药物。
1.4 体温测定及取材 各组于造模前及造模6h后各测量一次体温,作致热前后体温差(ΔT)值的比较。注射LPS 6h后,再次麻醉大鼠,经心脏取血3 mL,随后经股静脉注射20g/L的伊文思蓝(EB,2 mL/kg),5 min后断头处死,立即开颅取脑,并将脑由正中线切开,右侧半脑沿冠状面分为3部分,分别留作EB含量测定、含水量测定及病理染色。全血静置2 h后离心(2500 r/min,4℃,20 min),取上清,-20℃冰箱保存。
1.5 脑组织含水量的测定 干湿法测定脑组织含水量,按以下公式计算:脑组织含水量(%)=(湿质量-干质量)/湿质量×100%。
1.6 血脑屏障通透性的测定 甲酰胺法测定脑组织中伊文思兰的含量,判断血脑屏障的破坏程度。
1.7 脑组织病理形态学观察 所取脑组织块投入10%中性福尔马林固定液,常规石蜡包埋,切片,HE染色后进行皮层及海马病理形态学观察。
1.8 血清TNF-α、IL-6含量的测定 每组随机选取8只动物血清,采用酶联免疫吸附法(ELISA)测定TNF-α、IL-6含量。试剂盒由加拿大GBD公司生产,按照试剂盒要求严格操作。
2 结果
2.1 清热解毒中药有效组分配伍注射液对模型大鼠致热前后温差的影响 造模6 h后,与正常组相比,模型组大鼠体温明显升高(P<0.01)。给药后,与模型组相比,TLQN高剂量组温差与模型组比较有统计学意义(P<0.05)。结果见表1
表1 对模型大鼠体温的影响(±s)
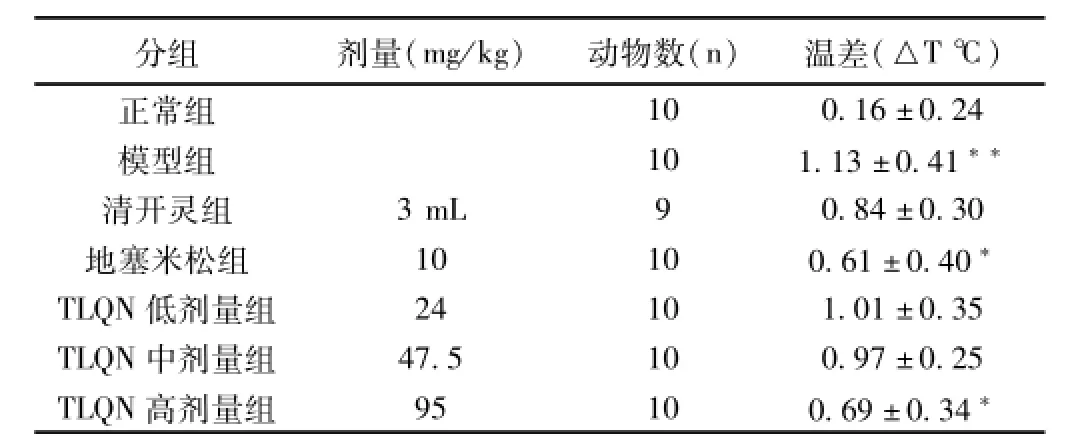
表1 对模型大鼠体温的影响(±s)
注:与正常组比较,**P<0.01;与模型组比较,*P<0.05。
分组剂量(mg/kg)动物数(n)温差(△T℃)10 0.16±0.24模型组10 1.13±0.41**清开灵组3 mL 9 0.84±0.30地塞米松组10 10 0.61±0.40*TLQN低剂量组24 10 1.01±0.35 TLQN中剂量组47.5 10 0.97±0.25 TLQN高剂量组95 10 0.69±0.34正常组*
2.2 清热解毒中药有效组分配伍注射液对模型大鼠脑组织含水量、EB含量的影响 造模6 h后,与正常组相比,模型组大鼠脑含水量、脑内EB含量明显升高(P<0.01)。给药后,与模型组相比,TLQN低、中、高剂量组脑含水量明显减少(P<0.05~0.01),TLQN中、高剂量组脑内EB含量明显减少(P<0.05)。结果见表2。
2.3 清热解毒中药有效组分配伍注射液对模型大鼠脑组织病理形态的影响 大鼠脑组织切片HE染色后,于光镜下观察。正常组皮质区、海马区均未见明显异常,间质未见炎性细胞浸润、充血、出血等;模型组皮质区可见小胶质细胞增生,神经元细胞变性、水肿、坏死,海马区神经元细胞变性、水肿、坏死,细胞排列紊乱,间质血管扩张,水肿;清开灵组、地塞米松组及TLQN各剂量组脑组织病变均较模型组减轻,仅见少量的间质血管扩张,偶有小胶质细胞增生,神经元变性。见图1,图2。
表2 对模型大鼠脑组织含水量、EB含量的影响(±s)
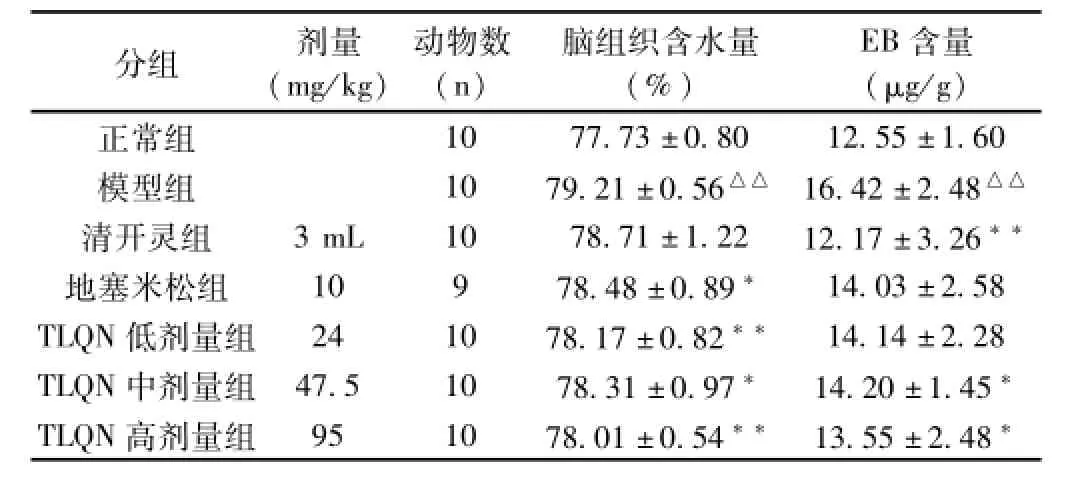
表2 对模型大鼠脑组织含水量、EB含量的影响(±s)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
分组剂量(mg/kg)动物数(n)脑组织含水量(%)EB含量(μg/g )1077.73±0.8012.55±1.60模型组1079.21±0.56△△16.42±2.48△△清开灵组3mL1078.71±1.2212.17±3.26**地塞米松组10978.48±0.89*14.03±2.58 TLQN低剂量组241078.17±0.82**14.14±2.28 TLQN中剂量组47.51078.31±0.97*14.20±1.45*TLQN高剂量组951078.01±0.54**13.55±2.48正常组*
2.4 清热解毒中药有效组分配伍注射液对模型大鼠血清炎症因子TNF-α、IL-6水平的影响 造模6h后,与正常组相比,模型组大鼠血清TNF-α及IL-6水平显著升高(P<0.01)。给药后,与模型组相比,TLQN高剂量组可显著降低血清TNF-α水平(P<0.05),中剂量组可显著降低血清IL-6水平(P<0.05)。结果见表3。
表3 对模型大鼠血清TNF-α、IL-6水平的影响(±s,n=8)

表3 对模型大鼠血清TNF-α、IL-6水平的影响(±s,n=8)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
分组剂量(mg/kg)TNF-α(pg/mL)IL-6(pg/mL)20.85±4.31583.75±92.33模型组31.35±9.78△△758.25±67.27△△清开灵组3mL26.79±4.92671.30±122.76地塞米松组1022.69±6.41*616.42±56.39**TLQN低剂量组2427.79±4.49686.02±123.84 TLQN中剂量组47.529.00±12.63647.11±103.85*TLQN高剂量组9521.21±7.04*正常组700.39±102.24
3 讨论
脑水肿分为血管源性和细胞毒性脑水肿两大类,血管源性脑水肿主要是血脑屏障(bloodbrainbarrier,BBB)受损,血浆成份渗出到细胞外间隙;细胞毒性脑水肿主要特点是细胞膜上的离子泵受损,造成细胞内水钠潴留。感染性脑水肿(感脑)是各种病原体感染导致的脑水肿,其特点是急性、弥漫性兼有血管源性和细胞毒性脑水肿特点的混合性脑水肿[2]。本研究采用LPS诱导大鼠感染性脑水肿模型是最常用、最有效的感染性脑水肿的动物模型[1]。

图1 对模型大鼠皮质区病理形态的影响(HE染色,400×)
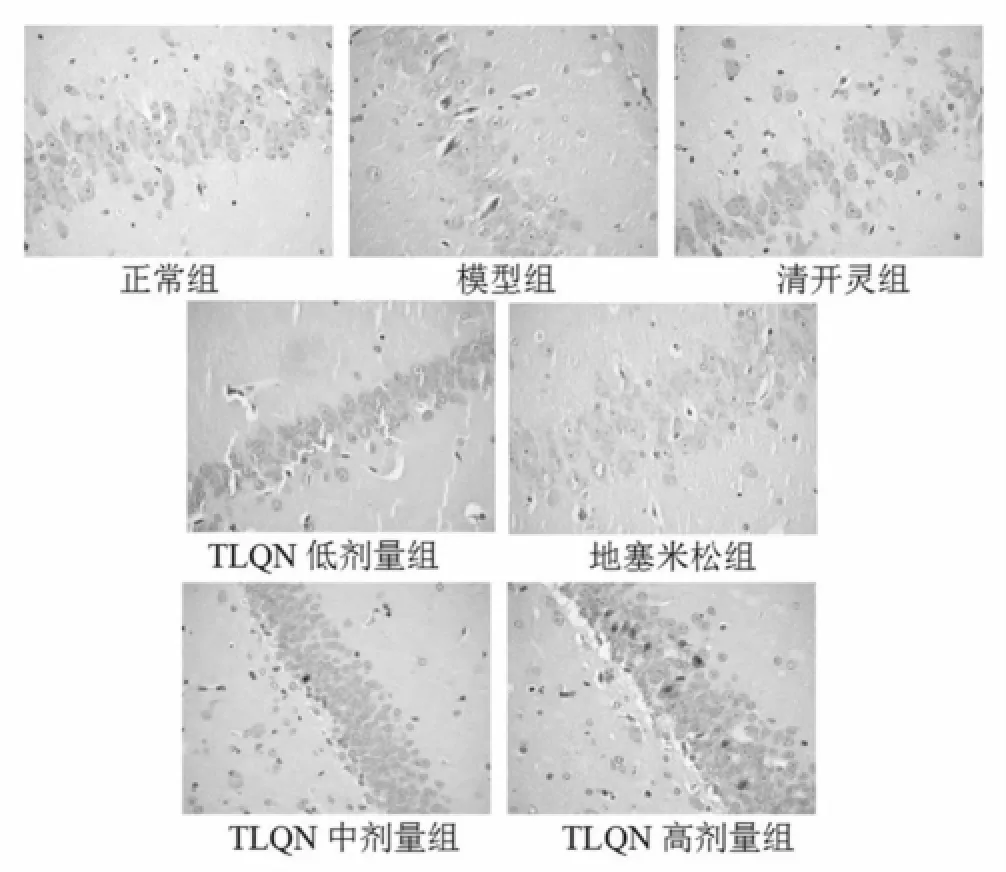
图2 对模型大鼠海马区病理形态的影响(HE染色,400×)
实验结果显示,模型组脑组织含水量和EB含量明显高于正常组,病理形态也显示皮质及海马区广泛的神经元、胶质细胞损伤,说明已成功建立以血脑屏障通透性增高,脑组织含水量增多为特征的感染性脑水肿模型,并伴有体温明显升高的全身性感染的表现。实验结果还显示,模型组大鼠血清TNF-α及IL-6水平较正常组显著升高,说明TNF-α和IL-6参与了LPS诱导的脑水肿发生、发展过程,介导了脑组织的损伤和破坏,并引起相应的病理改变和临床表现。
TNF-α和IL-6是两种主要的促炎症细胞因子,在脑水肿后的炎症反应中起关键性调节作用。TNF-α是使血管内皮细胞黏附分子表达上调的重要细胞因子,可以引起白细胞的黏附、聚集、移行,血脑屏障破坏,兴奋性氨基酸受体活化,或刺激胶质细胞产生大量NO而造成神经毒性作用和脑水肿[3]。IL-6主要由胶质细胞产生,是一种多效性促炎症细胞因子,能调节多种细胞功能,包括细胞增殖、细胞分化、免疫防御机制及血细胞生成等。适当浓度的IL-6是维持中枢神经系统正常生理功能不可缺少的介质,而当IL-6其大量产生时,主要表现为负向免疫调节[4]。
本研究采用的清热解毒中药有效组分配伍注射液(TLQN注射液)是由清热解毒中药黄芩、栀子等有效组分按特定比例配伍而成的复方注射液。黄芩的主要有效成分黄芩苷(Baicailin,BC)具有较强的抗炎、降脂、解热、镇静作用。研究表明黄芩苷对感染性脑水肿有保护作用[5],其机制可能与抑制NF-кB异常活化和IкBa降解有关[6]。还有研究表明[7],黄芩苷能抑制NO的分泌,从而减轻细菌脂多糖对星形胶质细胞损伤。此外,黄芩苷联合抗生素治疗能降低细菌性脑膜炎脑组织白细胞数、蛋白质及乳酸含量,并且可减少脑组织的含水量,明显减轻单纯抗生素治疗早期脑损伤的一过性加重,其机制可能是通过减少脑内IL-1和TNF-α的产生,从而发挥保护脑组织和减轻继发性脑损伤的作用[8]。栀子的主要有效成分栀子苷(Geniposide)有抗炎、解热、利胆等多种药理作用。研究表明,栀子苷具有明显的抗炎活性,对二甲苯、巴豆油引起的小鼠耳肿胀具有显著效果,且其作用方式不同于肾上腺皮质激素类药物,其抗炎活性的原因,可能与其抑制碱性磷酸酶的活性有关[9]。本实验结果显示,TLQN注射液可显著降低模型组动物血清中TNF-α和IL-6水平,同时明显降低模型动物的体温,减少脑组织含水量及EB含量,改善脑组织神经元、胶质细胞损伤。提示该注射液对LPS致大鼠感染性脑损伤有保护作用,其机制可能与抑制TNF-α和IL-6等细胞因子过度产生有关。
[1]田培超,乔晓辉,罗强,等.丙酮酸乙酯对内毒素致幼鼠感染性脑损伤的保护作用[J].实用儿科临床杂志,2008,23(16):1270-71.
[2]Yu PL,Zhou PF,Yang YJ,et al.Brain edemamodel induced with typhoid endotxin in rabbits.In:Inaba I,et al(eds):Brain edema[M].Berlin. Springer-Verlag,1985:113-116.
[3]王怀立,高东培,芦军萍,等.TNF-α、IL-8在脂多糖致大鼠脑水肿中的表达[J].免疫学杂志,2008,18(6):440-446.
[4]庞国象,汤斌,王优,等.急性中枢神经系统感染患儿脑脊液中IL-6和TNF水平的测定及临床意义[J].中华实用中西医杂志,2001,14(1):51-54.
[5]杨于嘉,朱彩云,陈翔,等.黄芩甙对百日咳菌液致大鼠脑水肿的保护作用[J].中华医学杂志,1998,78(8):630-632.
[6]俞燕,杨于嘉.毛定安黄芩甙对大鼠感染性脑水肿NF-кB活性的影响[J].中国当代儿科杂志,2000,2(6):386-389.
[7]刘杰波.黄芩苷对细菌脂多糖致星形胶质细胞损伤保护机制的研究[J],湖南中药导报,2004,10(3):79-83.
[8]唐勇军,李新中,鄢慧明.黄芩苷对兔大肠杆菌脑膜炎的辅助治疗作用及机制探讨[J].解放军医学杂志,2009,31(9):1102-1104.
[9]任治军,张立明,何开泽.栀子主要成分的提取工艺及药理研究进展[J].天然产物研究与开发,2005,17(6):831-836.
(2013-09-12收稿)
Protective Effect of Heat-Clearing An titoxicant Herb Com ponents Com patibility on Infectious Brain Edema in Rats induced by Lipopolysaccharide
Yao Mingjiang,Liu Jianxun,Zhang Peng,Yang Bin,Xu Li,Wang Guangrui
(Institute of Basic Medical Sciences of Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing key Laboratory of pharmacology of Chinesemateria medica,Beijing 100091,China)
Objective:To explore the protective effectof Heat-Clearing antitoxicant herb(Scutellaria baicalensis Georgi,Gardenia jasminoides Ellis,et al)component compatibility(TLQN Injection)on infectious brain edema in rats induced by lipopolysaccharide(LPS)and its possible therapeuticmechanism.Methods:A total of70 SD ratswere divided random ly intomodel group,control group,Qingkailing group(3mL/kg),Dexamethasone group(10mg/kg),TLQN low-dose(24mg/kg),middle-dose(47.5 mg/kg)and highdose(95 mg/kg)group.Models ofacute infectious brain edema of ratswere prepared by injecting LPS(1mg/kg)via left internal carotid artery,and the drugswas injected at the same time as LPSwas given via tail vein.6h after themodels were established,the body temperature,the water content and EB content in the brain wasmeasured,the pathological changeswas observed and the serum TNF-α、IL-6 wasmesured by ELISA.Results:The body temperature,thewater contentand EB content in the brain were higher inmodel group than in control group,as well as injured cortical and hippocampacal neurons and glial cells,the serum TNF-αand IL-6 levels inmodel group were higher than control group;TLQN injection can significantly decrease the body temperature,reduce water content and EB content,improve injured neurons and glial cells,and decrease the serum TNF-αand IL-6 levels.Conclusion:The Heat-Clearing antitoxicant herb component compatibility injection may lighten the degree of infectious brain injury induced by LPS,the possiblemechanism could be it can inhibit the overproduction of cytokines such as TNF-αand IL-6.
Heat-Clearing antitoxicant;Component compatibility;Lipopolysaccharide;Infectious brain edema;Inflammatory response
10.3969/j.issn.1673-7202.2013.10.001
国家自然科学基金项目(编号:30772755);“重大新药创制”科技重大专项(编号:2009ZX09103-317);科技部十二五重大新药创制课题(编号:2012ZX09301002-004)
姚明江,男,博士,助理研究员,研究方向:脑血管与神经系统疾病中药药理学,E-mail:ym j_ren@163.com
刘建勋,男,研究员,博士生导师,主要从事心脑血管药理学研究,Tel:010-62835601,E-mail:liujx0324@sina.com

