酰基保护的4-氨基-3,4-二氢-1(2H)-萘酮的立体选择性还原反应
王 超,黄焰根,孟卫东
(东华大学 生态纺织教育部重点实验室,上海 201620)
酰基保护的4-氨基-3,4-二氢-1(2H)-萘酮的立体选择性还原反应
王 超,黄焰根,孟卫东
(东华大学 生态纺织教育部重点实验室,上海 201620)
1,2,3,4-四氢-1-萘胺及其衍生物是一类重要的药物合成中间体.从光学纯的(R)-和(S)-1,2,3,4-四氢-1-萘胺出发,首先经乙酰化、苯甲酰化和邻苯二甲酰化反应制备相应酰胺,然后在高锰酸钾作用下氧化生成了氨基萘酮衍生物,收率为65%~85%.这些不同酰基保护的氨基萘酮衍生物经硼氢化钠(NaBH4)和二异丁基氢化铝(DIBAL-H)还原后得到两种构型的氨基萘醇混合产物,经二维核磁共振氢谱的核磁欧沃豪斯效应(NOE)推断,此还原反应的主产物是顺式构型的氨基萘醇,当(R)-或(S)-邻苯二甲酰化的氨基萘酮经DIBAL-H还原后主产物为顺式的氨基萘醇4ca和7ba,其非对映异构体过量(de)百分比分别为92.6%和98.2%.
1,2,3,4-四氢-1-萘胺;氧化;还原;顺式构型;光学纯
手性胺是众多具有重要生物活性化合物分子结构中的组成部分,在天然生物碱和氨基酸及其衍生物、药物、除草剂和杀虫剂等分子中都存在着这一结构片段.同时,光学纯的胺在现代药物中是一类重要的合成砌块,也是极具应用价值的拆分剂.1,2,3,4-四氢-1-萘胺及其衍生物是一类重要的药物合成中间体,如图1所示,一直以来在新药合成领域发挥着重要作用.图1(a)化合物是一类治疗肥胖症及精神性疾病药物的中间体[1],图1(b)化合物是一类酪氨酸激酶Jak3抑制剂,对器官移植、自身性免疫疾病及肥大细胞介导的疾病具有良好的治疗效果[2-4],图1(c)化合物是抗抑郁症的畅销药物舍曲林,这些化合物结构中都含有四氢萘胺结构片段[5-6].
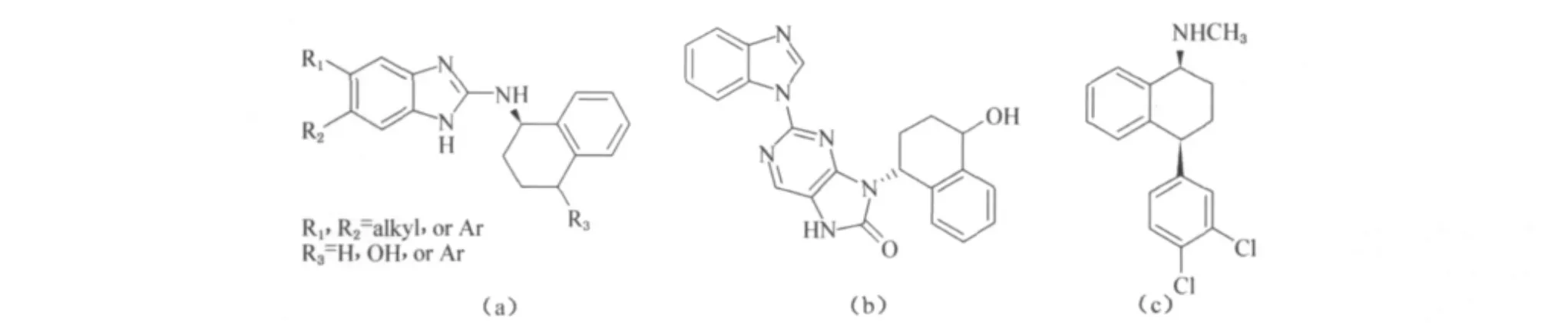
图1 含有1,2,3,4-四氢-1-萘胺结构的药物分子Fig.1 The drug molecules containing the structure of 1,2,3,4-tetrahydronaphthalen-1-amine
本文采用光学纯的(S)-1,2,3,4-四氢-1-萘胺(简称(S)-1)和(R)-1,2,3,4- 四氢-1-萘胺(简称(R)-1)为起始原料,与乙酸酐、苯甲酰氯和邻苯二甲酸酐进行酰化反应,再经氧化反应得到具有光学活性的氨基萘酮3和6,在后续的还原反应中,期望在分子中已有手性中心的诱导下,能够实现对羰基的立体选择性还原,从而构建新的手性中心.在不同酰基保护下的氨基萘酮3和6中的羰基经硼氢化钠(NaBH4)或二异丁基氢化铝(DIBAL-H)还原反应,结果显示,在空间位阻相对较大的邻苯二甲酰基保护下,经DIBAL-H还原后得到的氨基醇4ca和7ba的非对映异构体过量(de)百分比分别为92.6% 和98.2%,其构型经二维核磁共振氢谱的核磁欧沃豪斯效应(NOE)推断皆为顺式构型,反应线路如式1所示.
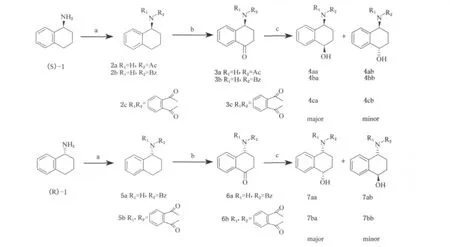
式1 (R)-或(S)-1,2,3,4-四氢-1-萘胺立体选择性合成氨基萘醇Scheme 1 Stereoselective synthesis of aminonaphthyl alcohol with(R)-or(S)-1,2,3,4-tetrahydronaphthalen-1-amine
1 试 验
1.1 药品、仪器与测试方法
药品:(R)-1,2,3,4-四氢-1-萘胺和(S)-1,2,3,4-四氢-1-萘胺按文献[7]方法自制(对映异构体过量(ee)百分比为99%以上);DIBAL-H 的正己烷溶液和硼氢化钠购自阿拉丁试剂(上海)有限公司;其他化学试剂和溶剂购自上海国药集团,部分经纯化处理后使用.
仪器与测试方法:红外光谱由Thermo Nicolet-380型红外光谱仪测定,采用KBr压片法作膜片;1H NMR由Bruker AV400(400 MHz)型核磁共振仪测定,TMS作为内标;de百分比由Varian-310型LC-MS测定;熔点由WRS-2A型微机熔点仪测定;旋光度由美国Rudolph Research全自动旋光仪测定.
1.2 合成方法
1.2.1 酰胺的制备
(1)乙酰化反应[8].依次将(S)-1(9.06 g,61.6 mmol)的二氯甲烷(150 m L)溶液、三乙胺(4.37 g,71.6 mmol)加入250 m L的三颈瓶中,冷却至0℃,用滴液漏斗缓慢加入乙酸酐(7.55 g,74.0 mmol),在0℃下反应4 h,然后加入30 m L水使反应混合物完全溶解,用二氯甲烷(300 m L)萃取3次,有机相经无水硫酸镁干燥后过滤、浓缩,粗产物经柱层析(V(石油醚)∶V(乙酸乙酯)=2∶1)纯化后得到酰胺2a(11.14 g,收率95.6%).熔点:154.5~155.3℃;[α]28D-311.2°(c 0.67,CHCl3);IR(KBr,v/cm-1):3 437,3 214,3 043,2 939,2 843,1 637,1 551,1 440,762,729,612;1H NMR(CDCl3)δ:7.26(t,J=4.5 Hz,1 H),7.22~7.13(m,2 H),7.13~7.07(m,1 H),5.75(s,1 H),5.17(dd,J=13.4,5.5 Hz,1H),2.84~2.70 (m,2H),2.01(s,3H),1.92~1.69(m,4H).
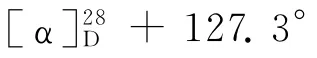
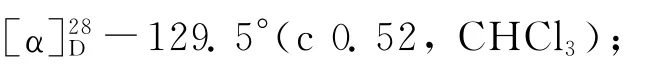
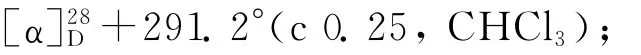
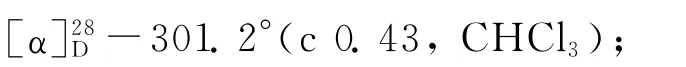
1.2.2 氧化反应[6]
将化合物5b(14.38 g,49.4 mmol)溶于丙酮(105 m L)中,加入硫酸镁(14.00 g)和水(35 m L)后,冷却至5℃,在冷却状态下2 h内少量多次加入高锰酸钾(23.23 g,147 mmol),保持反应体系温度在35℃以下.然后加热混合物体系至40~50℃并保持40 min.过滤,滤饼用丙酮(50 m L)洗涤5次,合并滤液后蒸除其中的丙酮,水相用二氯甲烷(450 m L)萃取3次,合并有机相并用无水硫酸镁干燥后过滤、浓缩,粗产物经柱层析(V(石油醚)∶V(乙酸乙酯)=1∶1)纯化后得到氨基酮6b(12.21 g,收率84.9%).
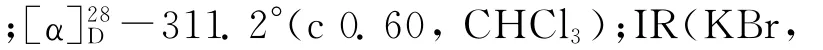
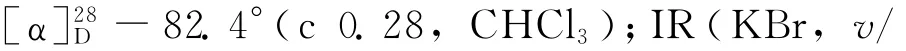
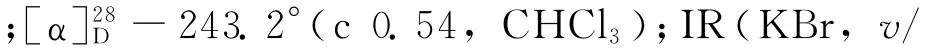
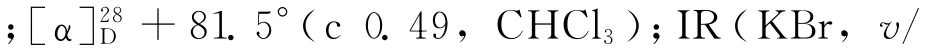
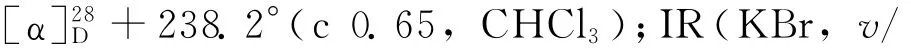
1.2.3 还原反应
(1)NaBH4还原酮[10].将化合物6b(0.43 g,1.45 mmol)溶于甲醇(150 m L)中,冷却至0℃,然后缓慢向其中加入NaBH4(0.45 g,11.9 mmol),在0℃下搅拌3 h.饱和氯化铵溶液(15 m L)淬灭3次,浓缩除去甲醇,再用二氯甲烷(60 m L)萃取3次,有机相用无水硫酸镁干燥后过滤、浓缩.粗产物经柱层析(V(二氯甲烷)∶V(甲醇)=40∶1)纯化后得到氨基醇7ba/7bb(0.40 g,收率94.3%).
(2)DIBAL-H 还原酮.将化合物6b(1.12 g,3.80 mmol)在氮气气氛中溶于四氢呋喃(35 m L),冷却至-78℃,缓慢注入DIBAL-H的正己烷溶液(1mol/L,10 m L),反应2 h,用1 mol/L盐酸(10 m L)淬灭2次,浓缩除去四氢呋喃和正己烷,再用二氯甲烷(60 m L)萃取3次,有机相用无水硫酸镁干燥后过滤、浓缩.粗产物经柱层析(V(二氯甲烷)∶V(甲醇)=30∶1)纯化后得到氨基醇7ba/7bb(1.01 g,收率91.2%).
化合 物 4aa IR(KBr,v/cm-1):3 277,3 070,2 936,2 862,1 643,1 546,1 445,1 372,1 270,1 074,784,740;1H NMR(CDCl3)δ:7.45~7.26(m,4H),6.12(s,1H),5.09~5.07(m,1H),4.76~4.74(m,1H),2.40(s,1H),1.98~1.85(m,6 H),1.33~1.26(m,1 H);LC-MS Found:205.7 [M+H]+,calcd for C12H15NO2:205.7[M+H]+.
化合物4ab1H NMR(CDCl3)δ:7.47~6.78(m,4H),6.47(d,J=7.8 Hz,1H),4.99(t,J=8.7 Hz,1 H),4.58(t,J=9.2 Hz,1 H),1.73~1.41(m,7H); LC-MS Found:205.7 [M+H]+,calcd for C12H15NO2:205.7[M+H]+.
化合物4bb1H NMR(CDCl3)δ:7.98(d,J=9.2 Hz,2 H),7.76~7.25(m,7 H),5.54(t,J=8.9 Hz,1 H),5.04(t,J=7.8 Hz,1H),2.73~2.29(m,4 H);LC-MS Found:265.9[M-H]+,calcd for C18H15NO3:265.9[M-H]+.
化合物4cb1H NMR(CDCl3)δ:7.85~6.75(m,8H),5.65(s,1H),5.47(t,J=8.7 Hz,1H),4.81(t,J=9.3 Hz,1H),2.52~2.21(m,2H),2.19~1.65(m,2H);LC-MS Found:293.9 [M+H]+,calcd for C18H15NO3:293.9[M+H]+.
化合物7ab1H NMR(CDCl3)δ:7.84(d,J=7.6 Hz,2 H),7.61~7.23(m,7 H),5.25(t,J=8.9 Hz,1 H),4.78(t,J=9.7 Hz,1H),2.49~2.23(m,3H),1.75~1.49 (m,1 H);LC-MS Found:265.9 [M-H]+,calcd for C18H15NO3:265.9[M-H]+.
化合物7bb1H NMR(CDCl3)δ:7.89~7.05(m,8 H),5.74 (s,1 H),5.62 (t,J=9.8 Hz,1 H),4.91(t,J=8.4 Hz,1H),2.51~2.05(m,2 H),1.50~1.23(m,2 H);LC-MS Found:293.9[M+H]+,calcd for C18H15NO3:293.9[M+H]+.
2 结果与讨论
以光学纯的(S)-1和(R)-1为起始原料,经乙酰化、苯甲酰化或邻苯二甲酰化反应后得到酰基保护的四氢萘胺2a,2b,2c,5a,5b,然后在 KMnO4作用下将这些化合物中4位的—CH2—氧化生成氨基萘酮类化合物3a,3b,3c,6a,6b,所有产物经红外光谱和核磁共振氢谱得到确认.值得指出的是,在上述两步反应中生成的产物未观察到有明显的消旋化现象.
这些光学纯的氨基萘酮经金属氢化物还原剂还原后所得氨基萘醇产物,反应的立体选择性及收率如表1所示.由表1可知,该还原反应的立体选择性随着底物中手性碳原子上酰氨基团空间位阻的增大而增强,立体选择性也随着还原剂体积的增大而增强,并且与手性碳原子的构型有关.总体而言,R构型的底物还原所得产物的立体选择性优于S构型的底物所得产物.
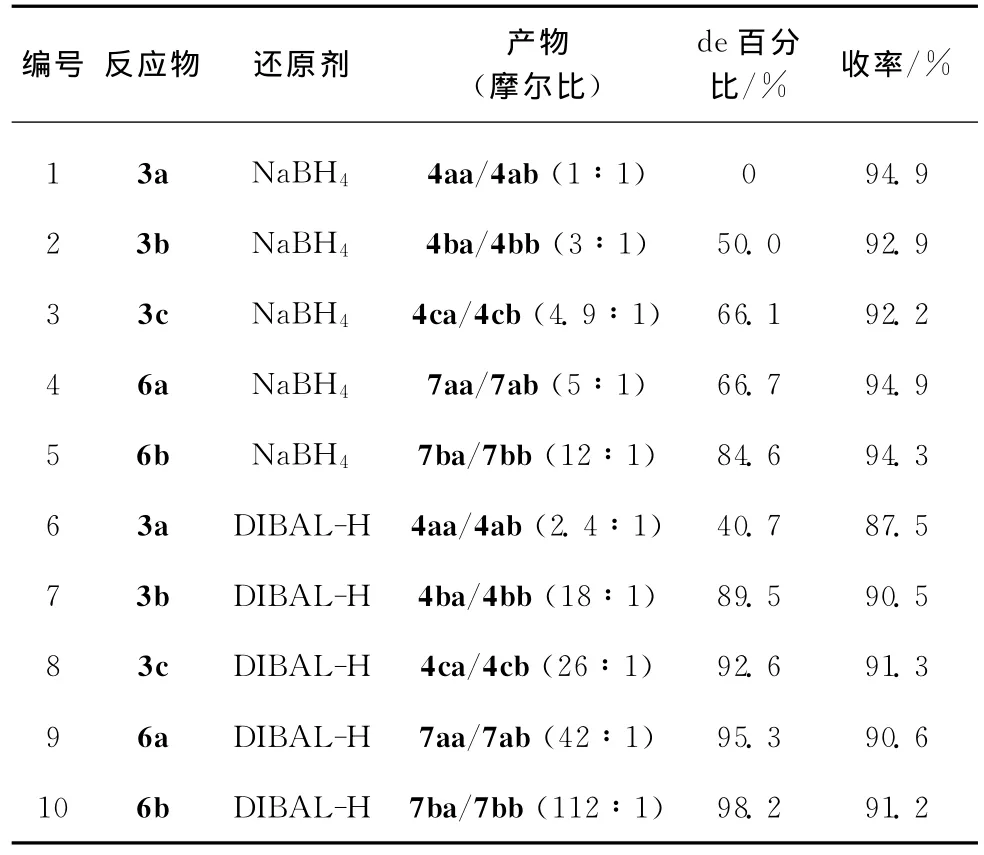
表1 酰氨基萘酮的立体选择性还原反应Table 1 Stereoselective reduction of acyl aminonaphthyl ketones
表1所示的还原产物氨基醇的立体异构体的绝对构型通过分离异构体混合物后由二维核磁共振氢谱推断.将由S构型的底物3c还原所得到的立体异构体之比为26∶1的混合物(编号8)经柱层析分离纯化后分别得到两个纯化合物4ca和4cb,同样地,将R构型的底物6b还原所得到的立体异构体之比为112∶1的混合物(编号10)经柱层析分离纯化后得到了纯的主产物7ba.产物4ca,4cb和7ba的二维核磁共振氢谱如图2所示.由图2(a)发现,4ca中化学位移在5.44(H—C—O上的H)处的信号与化学位移在4.78(H—C—N上的H)处的信号相互间存在NOE作用,故—OH处在六员环上与酰氨基团相同的一面,即4ca绝对构型如图3(a)所示,为顺式构型.由图2(b)发现,4cb中化学位移在5.47(H—C—O上的H)处的信号与化学位移在4.79(H—C—N上的H)处的信号基本无相干性,无NOE作用,故—OH处在六员环上与酰氨基团相反的一面,即其绝对构型如图3(b)所示的反式构型.
由图2(c)发现,产物7ba中化学位移在5.43(H-C—O上的 H)处信号与化学位移在4.76(H—C—N上的H)处的信号存在着NOE作用,表明这两个氢原子处于六员环的同一面,即—OH与酰氨基团处于六员环的同一面,故其绝对构型为如图3(c)所示的顺式构型.
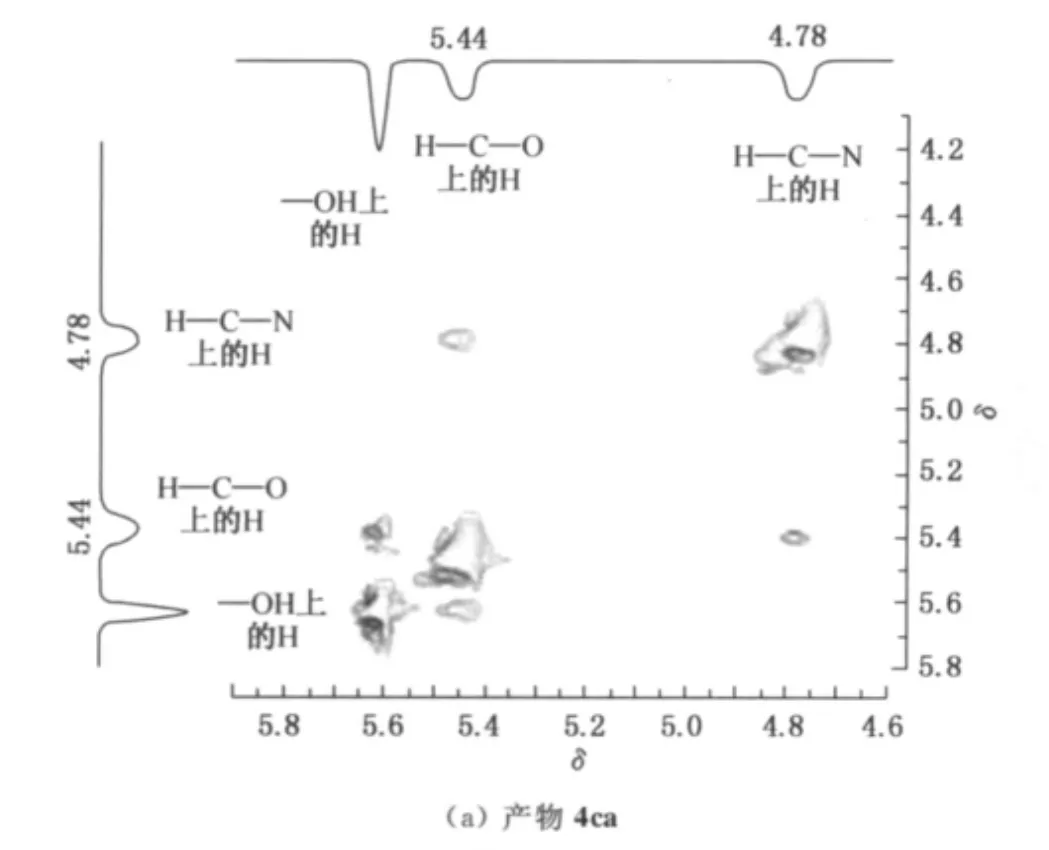
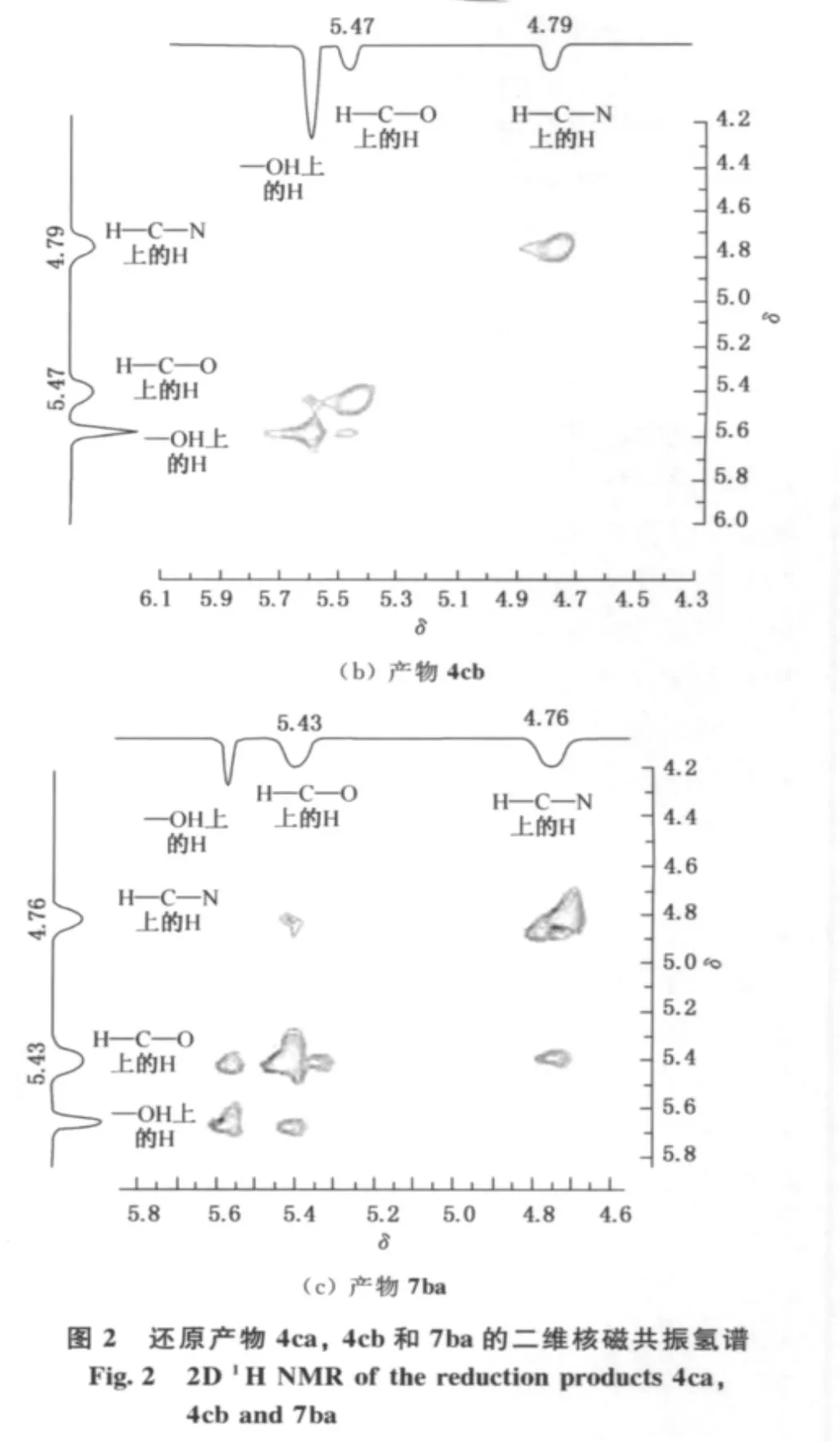
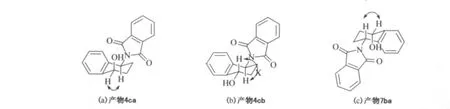
图3 还原产物4ca,4cb和7ba的NOEFig.3 NOE of the reduction products 4ca,4cb and 7ba
通过对不同保护基取代下的还原主产物和副产物的一维核磁氢谱进行比较,可以发现邻苯二甲酰保护的还原产物4ca和4cb在化学位移5.47(H—C—O上的H)处和4.81(H—C—N上的H)处的信号由4ca的多重峰变为4cb的三重峰;同样,产物7ba和7bb的对比可知,在化学位移5.56(H—C—O上的H)处和4.92(H—C—N上的H)处的信号由7ba的多重峰变为7bb的三重峰.这说明还原主产物4ca和7ba中两个手性碳原子上的氢原子除受到邻位—CH2—作用裂分为三重峰外,还受到彼此之间的作用而进一步裂分,而还原副产物4cb和7bb中两个手性碳原子上的氢原子只受到邻位—CH2-作用裂分为三重峰,由此也可以判断还原主产物为顺式构型和副产物为反式构型.
由苯甲酰基保护的还原产物7aa和7ab在化学位移5.54(H—C—O上的 H)处和5.05(H—C—N上的H)处的信号由7aa的多重峰变为7ab的三重峰;同样,产物4ba和4bb对比可知,在化学位移5.39(H—C—O上的H)处和4.86(H—C—N上的H)处的信号由4ba的多重峰变为4bb的三重峰.这说明还原主产物7aa和4ba中两个手性碳原子上的氢原子除受到邻位—CH2—作用裂分为三重峰外,还受到彼此之间的作用而进一步裂分,而还原副产物7ab和4bb中两个手性碳原子上的氢原子只受到邻位—CH2—作用裂分为三重峰.由此推断在苯甲酰基保护下,还原反应中的立体选择性与邻苯二甲酰基保护下的反应是一致的,即还原主产物为顺式构型和副产物为反式构型.
同样地,由乙酰基保护的还原产物4aa和4ab在化学位移4.99(H—C—O 上的 H)处和4.58(H—C—N上的H)处的信号由4aa的多重峰变为4ab的三重峰.这说明还原主产物4aa中两个手性碳原子上的氢原子除受到邻位—CH2—作用裂分为三重峰外,还受到彼此之间的作用而进一步裂分,而还原副产物4ab中两个手性碳原子上的氢原子只受到邻位—CH2—作用裂分为三重峰.由此推断乙酰基保护下的还原产物4aa和4ab的构型分别为顺式构型和反式构型,其立体选择性与上述两类反应是一致的.
这些研究结果表明,在还原反应中,受到底物中已知构型手性碳原子上基团的空间位阻效应的影响,还原剂选择性地从与酰氨基团处于反式的一面进攻羰基,进而生成的产物以顺式构型为主,且酰氨基团和还原剂的体积越大,反应的立体选择性越强.
3 结 语
本文由光学纯的(R)-和(S)-1,2,3,4-四氢-1-萘胺出发,用不同的酰化基团制备酰胺后,再由高锰酸钾氧化生成相应的光学纯氨基萘酮,发现在反应过程中构型保持不变.然后将这些不同酰基保护的氨基萘酮分别用NaBH4和DIABL-H还原,结果得到两种构型的氨基萘醇混合产物,经二维核磁共振氢谱的NOE效应以及一维核磁共振氢谱部分峰型差别推断,此还原反应的主产物是顺式构型的氨基萘醇.该还原反应的立体选择性随着酰氨基团和还原剂的体积增大而增强,当酰氨基团为邻苯二甲酰氨基、还原剂为DIABL-H时,还原后主产物4ca和7ba的de百分比分别为92.6%和98.2%.运用这一策略,本文所合成的光学纯的氨基萘醇类化合物,可作为合成中间体用于药物的合成.
[1]STROBAEK D,HOUGAARD C.Inhibitory gating modulation of small conductance Ca2+-activated K+channels by the synthetic compound NS 8593 reduces IAHP in hippocampal CA1 neurons[J].Mol Pharmacol,2006,70(5):1771-1782.
[2]CKUN F M,LIU X P.In vivo toxicity and pharmacokinetic features of the Janus kinasa 3 inhibitor WHI-p131 [4-(4′-hydroxyphenyl)-amino-6,7-dimethoxyquinazoline[J].Clin Cancer Res,1999,5(10):2954-2962.
[3]MALAVIYA R,CHEN C L,NAVARA C,et al,Treatment of allergic asthma by targeting Janus kinase 3-dependent leukotriene synthesis in mast cells with 4-(3′,5′-dibromo-4′-hydroxyphenyl)-amino-6,7-dimethoxyquinazoline (WHI-p97)[J].J Pharmacol Exp Ther,2000,295(3):912-926.
[4]何新华.酪氨酸激酶Jak3抑制剂的研究进展[J].中国药物化学杂志,2005,15(6):373-377.
[5]SUDBECK E A,LIU X P,NARLA R K,et al.Structurebased design of specific inhibitors of Janus kinase 3 as apoptosis-inducing antileukemic agents[J].Clin Cancer Res,1999,5(6):1569-1582.
[6]WILLIAM M T.Process for preparing sertraline:USA,WO9301162[P].1993-01-21.
[7]ROGER A S,ROBERT L W.Stereoisomers of allenic amines as inactivators of monoamine oxidase type B stereochemical probes of the active site[J].J Med Chem,1988,31(8):1558-1566.
[8]STEFAN G K,CHARLES P V.A facile deprotection of secondary acetamides[J].Org Lett,2009,11(2):433-436.
[9]URAY G,KLEIDERNIGG O P,MAIER N M,et al.Diphenylethanediamine (DPEDA)derivatives as chiral selectors:IV A comparison of 3,5-dinitrobenzoylated(S,S)-and (S,R)-DPEDA-derived chiral stationary phases with Pirkle's standard (R)-phenylglycine-derived phase in normal phase HPLC[J].Chirality,1994,6(2):116-128.
[10]OHLMEYER M J.Purine and imidazopyridine derivatives for immunosuppression:USA,US20080287468A1[P].2008-11-20.
The Stereoselective Reduction of Acyl Protected 4-Amino-3,4-dihydro-1(2H)-naphthalenone
WANGChao,HUANGYan-gen,MENGWei-dong
(Key Laboratory of Science and Technology of Eco-textile,Ministry of Education,Donghua University,Shanghai 201620,China)
1,2,3,4-Tetrahydronaphthalen-1-amine and its derivative were a series of important synthetic intermediates for bioactive compounds.Acylation of optically pure (R)-and (S)-1,2,3,4-tetrahydronaphthalen-1-amine with acetic anhydride,benzoyl chloride and phthalic anhydride followed by oxidation with potassium permanganate to give acylated aminonaphthyl ketones in yields of 65%~85%.These aminonaphthyl ketones were reduced stereoselectively by sodium borohydride(NaBH4)or diisobutylaluminium hydride(DIBAL-H)to afford the aminonaphthyl alcohols mainly in cis-form,which was confirmed by nuclear Overhauser effect(NOE)obtained by 2D1H NMR.When (R)-and (S)-phthalic protected aminonaphthyl ketone was reduced with DIBAL-H,cis-aminonaphthyl alcohols 4ca and 7ba were obtained as major product in diastereomeric excesses'(de)percentages of 92.6%and 98.2%,respectively.
1,2,3,4 -tetrahydronaphthalen -1 -amine;oxidation;reduction;cis-configuration;optically pure
O 625.634
A
2011-12-16
王 超 (1989—),男,山东菏泽人,硕士研究生,研究方向为药物中间体合成、手性化合物制备及其应用.E-mail:qichao@mail.dhu.edu.cn
孟卫东(联系人),女,教授,E-mail:wdmeng@dhu.edu.cn
1671-0444(2013)01-0070-07
