中药成膜剂的制备及其性能试验
冯世德,武 瑞
(1.黑龙江八一农垦大学理学院,黑龙江 大庆163319;2.黑龙江八一农垦大学理学院动物科技学院,黑龙江 大庆163319)
自20世纪40年代,膜剂被作为一种新的剂型提出来,并在之后的几年中迅速地发展起来,如工业、医药业及食品业等。[1]随着科学技术的发展,成膜剂的组方、工艺的选择及优化已经是成熟的技术。但目前在兽药领域关于膜剂的研究甚少,还属于初级阶段。特别是对膜质量标准定位还是模糊不清,据2010年药典[2]对膜剂质量要求记载基本都是立足于药物本身,而无关于膜性能的研究标准。膜的性能不但影响药物的疗效,而且影响皮肤正常功能的发挥[3],所以其也应是成膜质量标准研究中不可缺少的一部分。本试验旨在研制一种新型的中药成膜剂,及对该成膜剂膜的性能进行研究,制定其膜的质量标准,为此类兽药制剂的研究提供依据。
1 试验材料
1.1 试验药品 中药溶液(由蒲公英、金银花、青皮、牛蒡子、当归、连翘、瓜蒌组成,通过水提醇沉提取,最后浓缩得到生药浓度为1g/mL的中药液);脱皮剂(取硫化钠8g,加入40mL乙醇溶解,再加入蒸馏水至100mL);甘油购自天津市百世化工有限公司;吐温-80购自天津市瑞金特化学药品有限公司;羧甲基纤维素购自沈阳市华东试剂厂;氮酮、PVA(聚乙烯醇)均购自国药集团化学试剂有限公司;无水CaCl2、NaNO2购自天津市永大化学试剂有限公司。
1.2 试验仪器 ACCULAB型电子分析天平,沈阳市龙腾电子称量有限公司;DRP-9272型电热恒温培养箱,上海森信实验仪器有限公司;DK-S12型电热恒温水浴锅,上海森信实验仪器有限公司;20分尺型游标卡尺,上海量具刃具厂;DJ1C增力电动搅拌器,江苏环保仪器厂;SC-279CA型冷藏柜,青岛海尔电冰柜有限公司。
1.3 试验动物及处置 3~4个月伊丽莎白兔2只,均购自长春生物制品研究所。将兔两侧腹部用脱毛剂进行脱毛,观察24h后无损伤即可使用。
1.4 离体兔皮制备 用脱毛剂将兔腹部进行脱毛,12h之后,观察兔皮是否有损伤,如有损伤不可使用;若完好,则将兔子处死,取兔腹部皮,将皮下脂肪去除干净,用生理盐水洗净,浸泡在生理盐水中存放于4℃冰箱中,需在24h内使用。
2 试验方法
2.1 中药成膜剂制备组方优化
2.1.1 聚乙烯醇(PVA)浓度的筛选 分别量取1 g、2g、3g、4g和5g的PVA五组,置于5个锥形瓶内,并分别加入100mL中药充分搅拌,放置48h使充分溶胀,95℃水浴锅中搅拌使其完全溶解,将溶液用40目钢塞过滤,向滤液中加入4.33mL氮酮,搅拌均匀即可。抽取2mL溶液,均匀涂抹于3×4 cm2兔腹部,记录每组成膜时间并对外观质量(见表1)进行评分。评分标准=(30-成膜时间)+外观质量,设PVA的最适浓度为A。

表1 外观质量评分标准
2.1.2 吐温-80用量范围的选择 量取由2.1.1得出浓度为A的PVA中药液3组,每组50mL,依次加入0.5mL、0.75mL和1.0mL的吐温-80,放置40℃水浴锅中搅拌均匀,待常温时,加入4.33 mL氮酮,搅拌均匀即可。抽取2mL溶液,均匀涂抹于3×4cm2兔腹部,记录每组成膜时间与外观质量进行评分,选取吐温-80的用量为BmL。再量取PVA复方中药液分为4组,每组50mL,依次加入吐温-80(B-0.10)mL、(B-0.05)mL、(B+0.05)mL和(B+0.10)mL,处理同上,记录每组成膜时间与外观质量进行评分。评分标准=(30-成膜时间)+外观质量,设评分最高组吐温-80用量为CmL。
2.1.3 甘油用量范围的选择 量取由2.1.1得出浓度为A的PVA中药液5组,每组50mL,依次加入吐温-80CmL,放置40℃水浴锅中搅拌均匀,再依次加入0mL、2.5mL、5mL、7.5mL和10mL的甘油,再次放入40℃水浴锅中搅拌均匀,待常温时,加入4.33mL氮酮,搅拌均匀即可。抽取2mL溶液,均匀涂抹于3×4cm2兔腹部,记录每组成膜时间与外观质量进行评分,选取甘油的用量为D mL。再量取PVA中药液分为4组,每组50mL,依次加入吐温-80CmL,放置40℃水浴锅中搅拌均匀,再依次加入甘油(D-1.5)mL、(D-1.0)mL、(D-0.5)mL和(D+0.5)mL,处理同上,记录每组成膜时间与外观质量进行评分。评分标准=(30-成膜时间)+外观质量,设评分最高组甘油用量为E mL。
2.1.4 羧甲基纤维素钠浓度范围的选择 由试验2.1.1~2.1.3得出的试验结果配制溶液分为5组,每组50mL,将溶液放于55℃水浴锅中预热,分别加入1.7%、1.8%、1.9%、2.0%和2.1%用无水乙醇浸润的羧甲基纤维素钠,充分搅拌直至完全溶解。抽取2mL溶液,均匀涂抹于3×4cm2兔腹部,记录每组成膜时间与外观质量进行评分,评分标准=(30-成膜时间)+外观质量。
2.1.5 正交试验选择最优组方 本试验选取L9(3)3正交试验表,以成膜时间与外观质量为评分标准,对吐温-80、甘油及羧甲基纤维素钠3个因素进行筛选,正交试验因素与水平见表2按正交试验获得3因素最适用量。
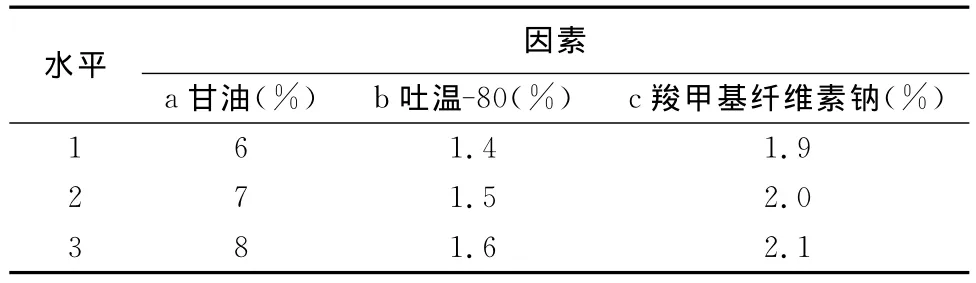
表2 正交试验因素与水平
2.2 中药成膜剂膜性能研究
2.2.1 膜粘附力的测定 按照以上试验结果配制3组中药成膜剂,每组取样3次,分别将9组药液均匀涂在3×4cm2兔腹部。成膜之后,将靠近腹内侧一端膜掀起大约0.5cm左右,用夹子夹住下方,夹子上系一塑料袋,用点滴管将水匀速滴入塑料袋中,直到膜破裂为止,记录重量。
2.2.2 膜透气性试验 将中药成膜剂均匀涂抹在6×6cm2兔腹部,待完全成膜后,整张取下,选取厚度达到0.1μm~0.2μm之间的膜进行试验。将无水CaCl25g放入自制透气装置中,用药膜将瓶口封住。放入RH≥65%(放入饱和NaNO2水),温度37℃的恒温箱中。每1h称量1次,记录重量变化。透气装置随着时间重量而发生变化的速率,反映了水蒸气在药物膜中的透过速率。以时间为横坐标,质量变化为纵坐标,绘制直线获得斜率。从直线的斜率可求出薄膜的透气量:

式中:S为直线的斜率;A为试样的测试面积。
2.2.3 中药液紫外吸收波长的选择 将中药液用0.9%生理盐水稀释,使生药浓度达到25mg/mL,注入比色皿中,用0.9%生理盐水做空白对照,在400~470nm波长范围内扫描吸收光谱,并绘制紫外吸收光谱图,选择最大吸收波长。
2.2.4 线性关系的考察 将中药液用0.9%生理盐水稀释,分别配制生药浓度为25mg/mL、20mg/mL、15mg/mL、10mg/mL、5mg/mL和0mg/mL中药溶液。在418nm处测定吸收值,以吸收值为纵坐标,生药浓度为横坐标绘制标准曲线。
2.2.5 膜释药性试验 自制释药装置,用生理盐水填充皮下内环境,将装置放置37℃水浴锅中,在兔皮表面3×4cm2面积上均匀涂2mL药液,每隔0.5h在取药口抽取5mL液体,再抽取5mL生理盐水补充。将抽出液注入比色皿中,于418nm处进行紫外扫描,根据2.2.4中得到的线性方程进行计算得到释药浓度。
3 结果与分析
3.1 中药成膜剂制备组方优化结果
3.1.1 中药成膜剂组方筛选用量范围结果 通过单因素对成膜时间及外观质量的影响,得出当PVA浓度为5%时,成膜性、完整性好,且综合评分最高。按照相同的评分标准得出吐温-80最适用量范围1.4%~1.6%;甘油最适用量范围6%~8%,羧甲基纤维素钠最适用量范围1.9%~2.1%。
3.1.2 正交试验选择最优组方结果 由表3可知第5组试验综合评分最高。经正交试验助手Ⅱ直观分析可见,因素c对试验结果的影响较大,因素b次之,各因素的最优组合初步确定为a2b2c3,即按体积分数甘油占7%、吐温-80占1.5%及羧甲基纤维素钠占2.1%。
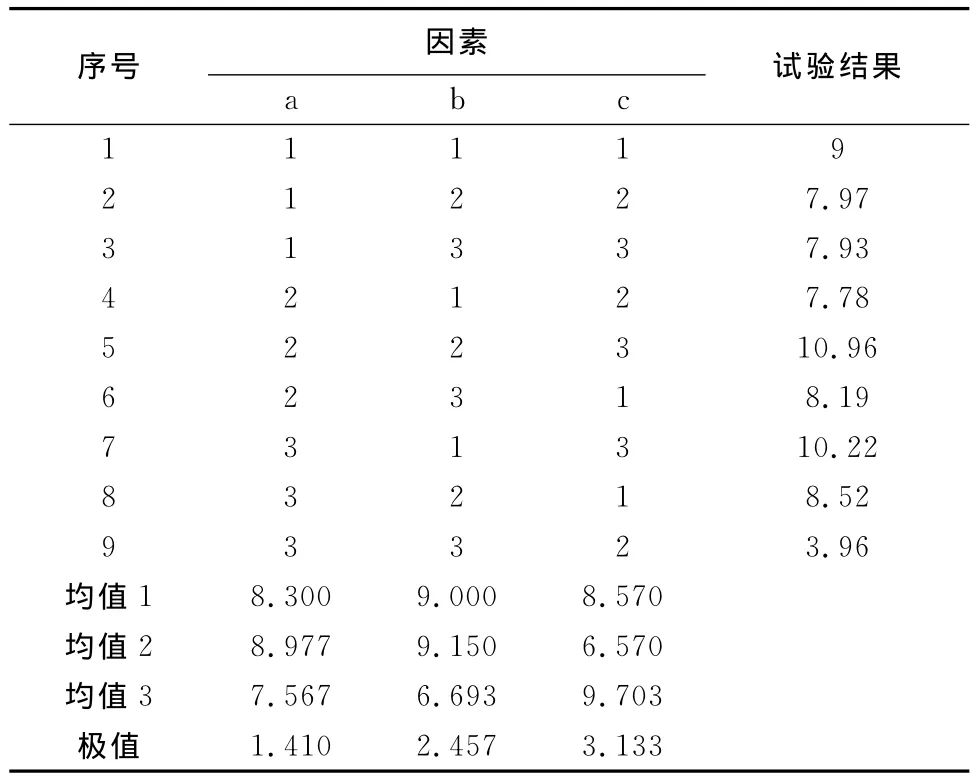
表3 正交试验表及结果
3.2 中药成膜剂膜性能的研究结果
3.2.1 膜粘附力测定试验结果 粘附力的大小决定了药物的吸收,以及药物的作用时间[4]。该中药成膜剂膜粘附力的范围在144.71g~204.68g之间,可知该药的吸收和作用时间都较长。结果见表4。

表4 中药成膜剂膜粘附力的大小
3.2.2 膜透气性试验结果 透气装置随着时间的变化重量发生变化的速率,反映了水蒸气在药物膜中的透过速率。以时间为横坐标,质量变化为纵坐标,所得标准曲线如图1所示。线性回归方程式为y=0.005x-0.0017,R2=0.968,时间在0h~4h内具有良好的线性关系。根据线性回归方程得到直线斜率为0.005。由斜率与透气量的计算公式得出膜的透气量在7.92g/h·m2~8.46g/h·m2之间,结果见表5。
3.2.3 中药液紫外吸收波长的选择结果 利用紫外吸收光谱对中药溶液进行定性分析,将中药溶液在400~470nm波长范围内进行扫描,发现随着中药溶液生药浓度的不同,紫外吸收图谱形状一致,均在波长为418nm处出现最大吸收峰。中药溶液的紫外吸收图谱如图2所示,因此选择418nm为该药的检测波长。
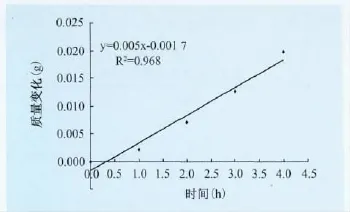
图1 透气性试验质量变化与时间的标准曲线
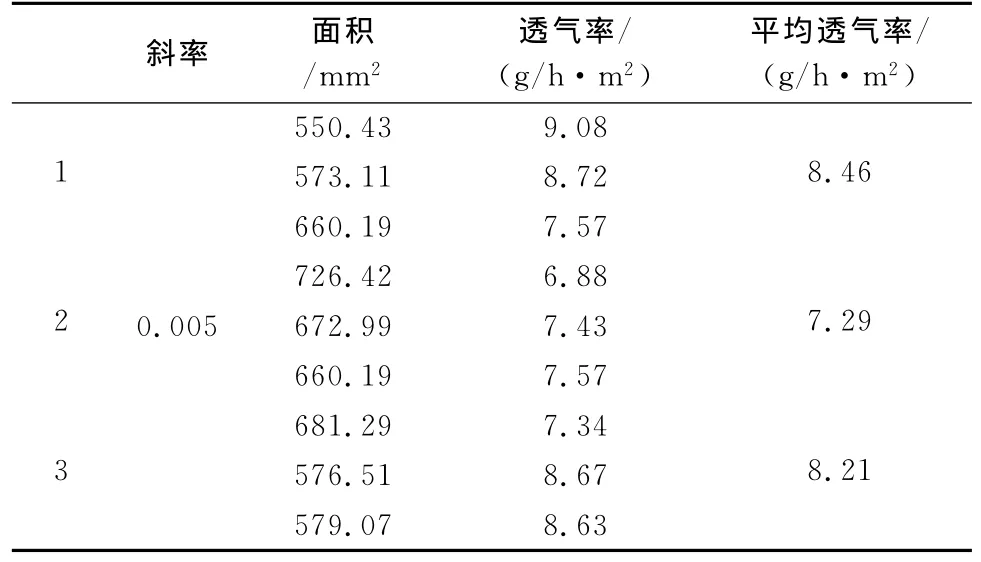
表5 透气性试验

图2 中药溶液紫外扫描图谱
3.2.4 线性关系的考察结果 根据以上试验结果,故选取紫外波长在418nm处测定不同浓度中药溶液的吸光度。以中药液的生药浓度为横坐标,吸光度为纵坐标绘制标准曲线如图3所示。线性回归方程为y=0.0942x-0.3161,R2=0.9544。浓度在5g/mL~25g/mL范围内具有良好的线性关系。
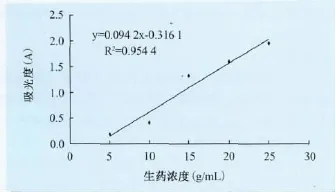
图3 中药液的生药浓度与吸光度的标准曲线
3.2.5 释药性试验结果 应用中药溶液生药浓度标准曲线对该药成膜剂的释药性进行测定。随着时间的增加释药量逐渐增加,但在330min之后该中药释药量达到平衡。测定结果如图4所示。

图4 膜释药性试验
4 讨论
4.1 中药成膜剂制备组方优化 中药成膜剂的成膜材料首选聚乙烯醇(PVA),PVA成膜性能如抗拉强度、柔软性、吸湿性和溶水性最好,而且无毒、无副作用,已经被广泛用于生物医用材料[5]。为了保证膜的质量、稳定性及舒适性,还需向成膜材料中加入增塑剂-甘油、表面活性剂-吐温-80及抗氧化剂等添加剂。据最新资料显示,含有黄酮类的中药也具有强抗氧化的能力,并且呈明显的量效关系[6]。而本中药提取液中正含有此类物质,从而减少了此类添加剂的使用。
4.2 膜性能的研究 Schroeder等[7]通过试验证明,无论是溶液的抗拉强度、断裂伸长率等机械性能指标与皮肤的亲和力之间的相关性,还是水蒸汽透过性与体内外相关性都不好,所以目前对膜性能的研究应以在活体皮肤上进行的考察结果为标准。李得堂[8]在离体皮肤冷冻保存对LJM中芍药苷经皮渗透行为的影响的试验中表明,离体皮肤冷冻保存应该在24h内使用,否则离体皮肤的透皮速率和增渗倍数都有所增加,使得药物释药性试验结果受到影响。
[1]崔福德.药剂学[M].北京:中国医药科技出版社,2008:157-160.
[2]国家药典委员会.中华人民共和国药典(一部拟增修订附录)附录Ⅳ:1[S].2010年版,北京:化学工业出版社,2010.
[3]刘建芳.吕慧英,侯艳宁.涂膜剂的研究进展[J].国医院药学杂志,2010,30(4):325-327.
[4]孙黎,范玉玲,乔喜芹.体外粘附力测定方法的研究[J].黑龙江医药,2005,18(6):434-435.
[5]万四华.环保型改性聚乙烯醇载药膜的制备及其性能研究[D].武汉:华中农业大学,2007.
[6]Yang Ping,Kong Xiang Zhen.Synthesis and biological evaluation of 8-substituted and deglucuronidated scutellarin and baicalin analogues as antioxidant responsive element activators[J].Science China Chemistry,2011,54(10):1565-1575.
[7]Schroeder I,Franke P,Schaefer U,et al.Development andcharacterization of film forming polymeric solutions for skindrug delivery[J].Eur J Pharm Biopharm,2007,65(1):111-121.
[8]李得堂.中药经皮给药制剂疗筋涂膜剂的研制[D].广州:广州中医药大学,2009.

