二烯丙基二硫通过活性氧介导的JNK信号通路诱导人白血病K562细胞凋亡
易 岚,谭 晖,吉晓霞,陈 歆,单 健,苏 琦
(南华大学1.肿瘤研究所、2.药学与生命科学学院,湖南衡阳 421001)
目前,激发或诱导肿瘤细胞凋亡已成为治疗肿瘤的新方法[1]。研究表明,众多的细胞因子和药物具有诱导肿瘤细胞凋亡的能力[2]。其中,大蒜及其烯丙基硫化物的抗癌作用正日益受到关注。有研究显示[3],大蒜主要有效成分二烯丙基二硫(diallyl disulfide,DADS)可诱导胃癌、肺癌、结肠癌等多种肿瘤细胞凋亡。我们前期工作已经证明,DADS不仅可诱导人结肠癌等细胞分化与凋亡[4],而且可诱导人白血病细胞分化与凋亡。DADS对人白血病细胞具有双效作用,小剂量DADS(<1.25 mg·L-1)诱导人白血病细胞分化,其机制与抑制 JAK1/STAT3的酪氨酸激酶活性、下调STAT3与Myc核内表达水平,提高组蛋白乙酰化水平及p21WAF1表达上调有关[5]。而中等剂量 DADS(>1.25 mg·L-1)可诱导人白血病细胞凋亡,其机制与G2/M期阻滞,抑制ERK和激活p38,下调Bag-1、Bcl-2,上调Fas-L、Bax 等有关[6-7]。但具体机制尚不清楚。
活性氧(reactive oxygen species,ROS)作为细胞内非常重要的信号分子参与了细胞凋亡的启动和执行[8]。最新研究表明,ROS与 MAPKs信号通路密切相关[9]。在许多肿瘤细胞的凋亡过程中,ROS是JNK信号通路的重要调节者[10]。尽管在DADS作用的肿瘤细胞中,ROS的水平有明显的上调,但ROS与其它信号分子在细胞凋亡过程中的相互作用仍不完全清楚。本研究旨在研究DADS通过ROS介导的JNK信号通路诱导人白血病K562细胞凋亡,进一步阐明白血病的发病机制,为白血病的诱导凋亡治疗提供新思路。
1 材料与方法
1.1主要试剂与仪器DADS为Fluka公司产品,小牛血清是杭州四季青生物工程公司产品。蛋白质分子量标准(protein molecular weight marker)购于碧云天生物技术有限公司。BCA蛋白定量试剂盒为Pierce公司产品。2',7'-二氯氢化荧光素二脂(DCFH-DA)为 Santa Cruz公司产品。N-乙酰-L-半胱氨酸(NAC),JNK特异抑制剂sp600125购自Sigma公司。JNK抗体、phospho-JNK抗体以及相应的二抗均为Abcam Biotechnology公司产品。
1.2方法
1.2.1细胞培养 细胞培养采用常规培养,培养液为含10%小牛血清的RPMI 1640,在37℃,饱和湿度,5%CO2孵箱中培养,每3~4天换液传代。取对数生长期细胞用于实验,DADS用培养基稀释到所需浓度。
1.2.2MTT检测 用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔103~104个细胞接种到96孔板,每孔体积100 μl,设3个复孔。加入处理因素并设0对照,空白对照(对照孔及调零孔加100 μl培养液),溶酶对照和不同浓度DADS处理组。在37℃,饱和湿度,5%CO2孵箱中常规培养,继续培养72 h。于结束前4 h除0对照组外,每孔加MTT 溶液(5 g·L-1用 PBS 配制,pH=7.4)20 μl,继续孵育4 h,终止培养。离心后再吸弃孔内培养上清液。每孔加150 μl DMSO,振荡10 min,使结晶物充分融解。于酶联免疫检测仪上测各孔吸光度,检测波长570 nm,在酶联免疫检测仪上测定各孔光吸收值,记录结果,按下列公式计算抑制率。

1.2.3凋亡细胞百分率检测 调整待测细胞的浓度为5 ×108-1 ×109·L-1。1 000 r·min-1,离心5 min,收集培养细胞,预冷PBS吹打重悬,离心沉淀,重复1次。用4℃预冷的75%乙醇固定细胞,冰盒送检。样本上机前离心洗涤,弃上清,加碘化丙啶(PI)50 μl,浓度为 1 g·L-1,振荡混匀,避光置冰箱30 min,上机检测时300目尼龙网滤过,随机计数10 000个细胞,进行DNA含量分析。DNA含量低于2n的细胞百分数为凋亡细胞百分率。
1.2.4细胞内ROS检测 收集细胞,用Hanks液洗涤细胞 2 次,加入终浓度为 10 μmol·L-1的DCFH-DA 400 μl,充分混匀,在 37℃条件下避光反应50 min,用Hanks液洗涤细胞3次以去除细胞外荧光剂,用500 μl Hanks液重悬细胞,37℃条件下水浴10 min.流式细胞仪分析荧光强度,激发波长488 nm,发射波长530 nm。
1.2.5Western blot检测 细胞裂解:分别收集未处理组、处理组细胞,冰PBS洗两次,以1×107个细胞浓度加入 100 ~150 μl裂解液(100 mmol·L-1NaCl,10 mmol·L-1Tris-HCl pH 7.6,1 mmol·L-1EDTA pH 8.0,1 mg·L-1Aprotinin,100 mg·L-1PMSF),冰上裂解 1 h,12 000 r·min-1离心 10 min,吸出上清液,即为细胞总蛋白。根据Bradford法进行蛋白含量的测定。收集蛋白,变性后经10%SDS-聚丙烯酰胺凝胶电泳后转移至PVDF膜上,用含5%牛血清白蛋白的TBST(Tris-HCl 20 mmol·L-1,NaCl 137 mmol·L-1含 0.1%Tween-20)封闭 1 h,用特异性一抗4℃孵育过夜,TBST洗3次,每次5 min,相应的二抗孵育1 h,TBST洗3次,每次5 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定印迹区带的光密度值。
1.3统计学处理采用SPSS 12.0统计分析软件,Student't-test法进行显著性检验,用Sigma plot 9.0软件进行绘图。
2 结果
2.1DADS对K562细胞的增殖抑制作用如Tab 1 所示,2.5、5.0、10.0、20.0、40.0 mg·L-1DADS处理人白血病K562细胞,抑制率分别为32.48%、59.34%、66.42%、81.05%、87.09%,抑制率呈浓度依赖性增加(P<0.05)。Tween80对照组对细胞增殖无明显抑制作用(P>0.05)。这些结果表明,DADS以剂量依赖性抑制K562细胞的生长。IC50值在 5.0 mg·L-1左右。
Tab 1 The OD570value of different concentration DADS treated K562 cells 48 hours(±s)
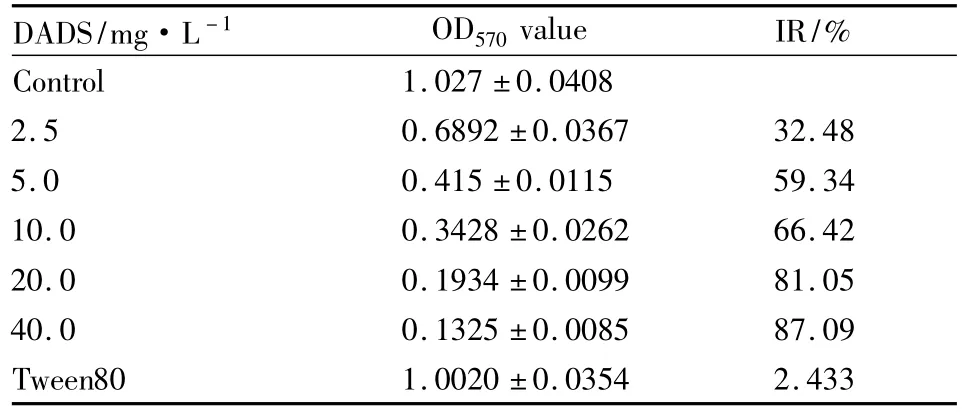
Tab 1 The OD570value of different concentration DADS treated K562 cells 48 hours(±s)
DADS/mg·L-1 OD570value IR/%Control 1.027 ±0.0408 2.5 0.6892 ±0.0367 32.48 5.0 0.415 ±0.0115 59.34 10.0 0.3428 ±0.0262 66.42 20.0 0.1934 ±0.0099 81.05 40.0 0.1325 ±0.0085 87.09 Tween80 1.0020 ±0.0354 2.433
2.2DADS对K562细胞内ROS的影响DCFHDA染色后,流式细胞术检测结果如Fig 1所示,5 mg·L-1DADS 处理人白血病 K562 细胞 0、1、2、4、8、12和24 h后,细胞荧光强度分别为7.9±1.08、10.1±1.24、12.5 ±0.63、15.9 ±1.47、26.1 ±0.99、20.8±1.56、12.7 ±0.65。结果表明:5 mg·L-1DADS作用 K562细胞,ROS水平在1 h内迅速上升,8 h到达高峰,随后的4 h又开始下降。

Fig 1 FCM analysis of K562 cells treated with 5.0 mg·L -1 DADS for different lengths of time
2.3DADS诱导人白血病K562细胞凋亡过程中JNK1/2的活化在DADS诱导人白血病K562细胞凋亡过程中有激酶JNK1/2的活化。如Fig 2所示,在DADS诱导K562细胞凋亡过程中,磷酸化JNK1/2表达水平呈时间依赖性,5 mg·L-1DADS作用K562细胞4h后,与未处理组想比,磷酸化JNK1/2表达水平明显上升,8 h达到高峰,随后表达开始下降,这和检测到得ROS水平相一致。
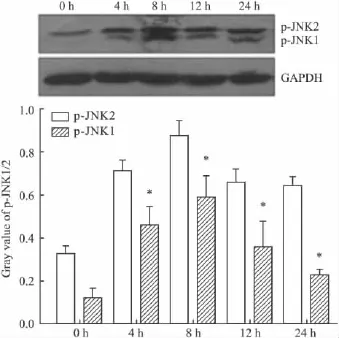
Fig 2 Western blot analysis of JNK activation in K562 cells induced by different lengths of time with 5.0 mg·L -1DADS
2.4NAC和sp600125对DADS诱导K562细胞凋亡的影响如Fig 3所示,5 mg·L-1DADS作用K562细胞24 h,凋亡率为(38.6±2.12)%,与未处理组(3.2% ±0.76%)相比,5 mg·L-1DADS 能明显诱导K562细胞凋亡,而10 mmol·L-1抗氧化剂NAC 和 10 μmol·L-1JNK 抑制剂sp600125并未能诱导细胞凋亡。在10 mmol·L-1NAC或10 μmol·L-1sp600125预处理后再用5 mg·L-1DADS作用细胞24 h,凋亡率分别为(15.8±1.76)% 和(17.1±1.54)%,这些结果表明用 NAC和sp600125预处理细胞能阻滞DADS诱导K562细胞凋亡(P<0.05)(Fig 4)。

Fig 3 Flow cytometry(FCM)analysis of apoptosis of K562 cells induced by 5 mg·L-1DADS,with and without pretreatment with 10 mmol·L -1NAC or 10 μmol·L -1sp600125
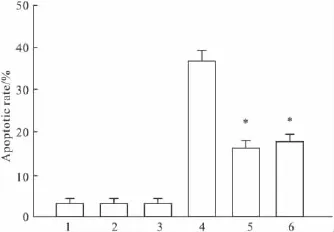
Fig 4 Flow cytometry(FCM)analysis of apoptosis rate of K562 cells
2.5NAC和sp600125对K562细胞p-JNK1/2表达的影响为了进一步研究JNK的活化与ROS的关系,我们在 DADS诱导细胞凋亡中应用了sp600125和NAC两种抑制剂来检测JNK的活化。Western blot分析结果如 Fig 5所示,在5 mg·L-1DADS作用30 min之前用sp600125或NAC预处理细胞,再用5 mg·L-1DADS作用8 h后,磷酸化JNK表达水平(尤其是磷酸化JNK1)表达水平明显下降。结果表明:在DADS诱导人白血病K562细胞凋亡过程中有激酶JNK1/2的活化与ROS密切相关。
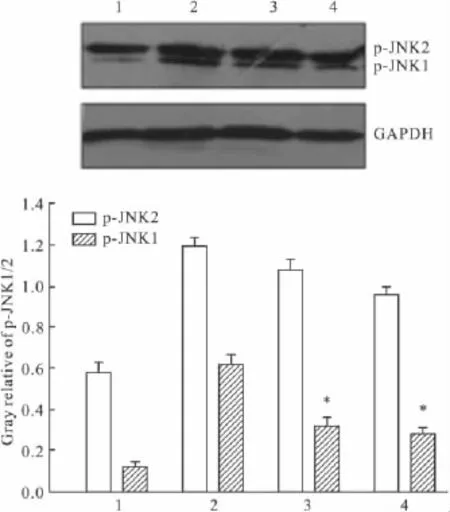
Fig 5 Effects of pretreatment with NAC and sp600125 on p-JNK1/2 activation in DADS-treated K562 cells
3 讨论
刺激和诱导肿瘤细胞凋亡已经成为治疗肿瘤的一种新的可能性[11]。众多的细胞因子和药物都能诱导肿瘤细胞凋亡,其中,大蒜及其烯丙基硫化物的抗肿瘤作用已日益吸引着人们的目光。DADS作为大蒜提取物中最有效的成分,可以诱导多种肿瘤细胞包括人慢性髓细胞性白血病K562细胞系凋亡,但是其具体机制还有待于进一步研究。
我们前期工作已经表明,低剂量(1.25 mg·L-1)的 DADS具有抗增殖作用,能诱导人白血病K562细胞分化[12]。本研究用中等浓度(2.5~20 mg·L-1)DADS来诱导人白血病K562细胞凋亡。本研究进一步证实了DADS对人白血病K562细胞的生长抑制作用。MTT实验结果表明,DADS以剂量依赖方式抑制人白血病K562细胞的活性。许多研究表明,各种刺激,比如抗肿瘤药物、紫外线、离子辐射等都能刺激形成内源性的ROS,这种内源性的ROS在细胞的凋亡过程中起着非常重要的作用[13]。本研究中,用DADS处理人白血病细胞,细胞内ROS水平明显升高,呈时间依赖性方式。流式细胞术检测结果显示,5 mg·L-1DADS作用K562细胞后,ROS水平在1 h内迅速上升,8 h到达高峰,随后的4 h又开始下降。而且,用抗氧化剂NAC或JNK抑制剂sp600125预处理细胞后再用5 mg·L-1DADS作用细胞24 h,凋亡率分别明显下降(P<0.05)。这些结果表明:DADS诱导人白血病细胞凋亡与ROS以及JNK有关。
大量研究已经表明,MAPK信号通路的成员,包括ERKs、JNKs和 p38 MAPK信号通路在细胞的生存和死亡上起着非常重要的作用[14]。有研究发现[15],在DADS诱导人白血病细胞凋亡过程中,细胞活化的磷酸化ERKs的水平降低了,而活化的p38 MAPK的表达水平升高。JNK在许多肿瘤细胞凋亡上起着非常重要的作用,用遗传或者药理学途径抑制JNK的活性,可阻滞细胞的凋亡[16]。本研究结果表明,JNK特异性抑制剂 sp600125能明显降低DADS诱导人白血病细胞凋亡的能力,可见,JNK通路参与了DADS诱导人白血病细胞凋亡。众所周知,ROS是凋亡的启动者和调节者,但ROS本身不能直接激活caspase的级联反应,因此ROS诱导凋亡需要其他一些物质的参与,包括 JNK信号通路[17]。本研究实验结果表明,在DADS诱导人白血病K562细胞凋亡过程中有JNK1/2的活化。Western blot分析结果显示,5 mg·L-1DADS作用 K562细胞4 h后,与未处理组相比,磷酸化JNK1/2表达水平明显上调,8 h达到高峰,随后表达开始下降,这和检测到的ROS水平相一致。为了进一步研究JNK的活化与ROS的关系,我们在DADS诱导细胞凋亡中应用sp600125和NAC两种抑制剂来检测JNK的活化。在 DADS作用30 min之前用sp600125或 NAC预处理细胞,再用 5 mg·L-1DADS作用8 h后,磷酸化JNK表达水平(尤其是磷酸化JNK1)表达水平明显下降。这些结果表明:在DADS诱导人白血病K562细胞凋亡过程中有激酶JNK1/2的活化,激酶JNK1/2的活化是由ROS来调节的。当然,DADS诱导人白血病细胞K562凋亡的具体机制还有待于进一步研究。
[1]Schulze-Bergkamen H,Krammer P H.Apoptosis in cancer-implications for therapy[J].Semin Oncol,2004,31(1):90 -119.
[2]Ferreira I C,Vaz J A,Vasconcelos M H,Martins A.Compounds from wild mushrooms with antitumor potential[J].Anticancer A-gents Med Chem,2010,10(5):424 -36.
[3]Zhang Y W,Wen J,Xiao J B,et al.Induction of apoptosis and transient increase of phosphorylated MAPKs by diallyl disulfide treatment in human nasopharyngeal carcinoma CNE2 cells[J].Arch Pharm Res,2006,29(12):1125 -31.
[4]Huang Y S,Xie N,Su Q,et al.Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J].Mol Med Report,2011,4(3):553 -9.
[5]黄卫国,谭 晖,易 岚,等.二烯丙基二硫上调p21、STAT1和CAMTA1诱导人白血病HL-60细胞分化[J].中国药理学通报,2010,26(4):513 -6.
[5]Huang W G,Tan H,Yi L,et al.Diallyl disulfide up-regulate p21、STAT1 and CAMTA1 induce differentiation of human leukemia HL-60 cells[J].Chin Pharmacol Bull,2010,26(4):513 -6.
[6]Tan H,Ling H,He J,et al.Inhibition of ERK and activation of p38 are involved in diallyl disulfide induced apoptosis of leukemia HL-60 cells[J].Arch Pharm Res,2008,31(6):786 -93.
[7]Lin M,Xie H L,Su Q,et al.Effects of diallyl disulfide on differential expression of apoptosis-associated genes in leukemia cell line HL-60[J].Ai Zheng,2007,26(4):351 -6.
[8]Murphy M P,Holmgren A,Larsson N G,et al.Unraveling the biological roles of reactive oxygen species[J].Cell Metabolism,2011,13(4):361-6.
[9]Son Y,Cheong Y K,Kim N H,et al.Mitogen-activated protein kinases and reactive oxygen species:how can ROS activate MAPK pathways[J]?J Signal Transduct,2011,2011:792639.
[10]Magdalena L C,Tak Y A.Reactiveoxygenspecies,cellular redox systems,and apoptosis[J].Free Radical Biol Med,2010,48(6):749-62.
[11]Lowe S W,Lin A W.Apoptosis in cancer[J].Carcinogenesis,2000,21(3):485 -95.
[12]武明花,唐 黎,李利平,等.二烯丙基二硫对HL-60细胞的生长抑制和诱导分化作用[J].中华血液学杂志,2004,25(5):300-2.
[12]Wu M H,Tang L,Li L P,et al.The effect of Diallyl disulfide on cell growth inhibition and differentiationof HL-60[J].Chin J Hematol,2004,25(5):300 -2.
[13]Booth D M,Murphy J A,Mukherjee R,et al.Reactive oxygen species induced by bile acid induce apoptosis and protect against necrosis in pancreatic acinar cells[J].Gastroenterol,2011,140(7):2116-25.
[14]Shen H M,Liu Z G.JNK signaling pathway is a key modulator in cell death mediated by reactive oxygen and nitrogen species[J].Free Radic Biol Med,2006,40:928-39.
[15]Wettschureck N,Offermanns S.Rho/Rho-kinase mediated signaling in physiology and path physiology[J].J Mol Med,2002,80(10):629-38.
[16]Finkel T.Reactive oxygen species and signal transduction[J].IUBMB Life,2011,52(1 -2):3 -6.
[17]Qiao S L,Murakami K,Zhao Q H,et al.Mimosine-induced apoptosis in C6 glioma cells requires the release of mitochondria-derived reactive oxygen species and p38,JNK activation[J].Neurochemical Res,2012,37(2):417 -27.

