蛇毒神经生长因子对大鼠肝星状细胞增殖、凋亡及肝纤维化相关蛋白质表达的影响
胡仁统,张学荣,徐 瑾,罗小玲,林 兴,廖 明
(广西医科大学1.医学科学实验中心、2.附属肿瘤医院,广西南宁 530021)
多年来对肝纤维化的研究越来越深入,但是缺乏理想的治疗方案。目前针对肝纤维化的药物治疗主要还是在离体和动物模型实验中显示具有一定的疗效,其中包括作用于细胞外基质(extracellular matrix,ECM)和细胞因子的药物[1]、抑制肝星状细胞(hepatic stellate cell,HSC)的药物如干扰素[2]及抗氧化剂[3]等。但让众多研究者困惑的是几乎所有的抗肝纤维化药物在离体细胞以及动物模型中具有一定的效果而在临床上无效或效果比较差,这导致了这些抗肝纤维化药物很难在临床应用与治疗。因为肝纤维化的发生发展是一种多途径、多因素参与的过程,主要病理改变是ECM的过度合成与异常沉积。HSC是参与肝纤维化的最重要细胞,HSC的活化、增殖被认为是肝纤维化发生的中心环节,而抑制HSC增殖、诱导其凋亡成为抗肝纤维化的重要策略[4]。神经生长因子(nerve growth factor,NGF)作为神经营养因子的典型代表[5],其在神经领域的应用已被公认。近年来NGF诱导HSC细胞凋亡的发现为抗肝纤维化药物的研发提供了一个新的靶点。眼镜蛇毒中富含NGF,而且分离纯化NGF不仅得率较高,还具有耐碱、耐酸、耐蛋白酶水解及稳定性高等的特点,广西是眼镜蛇的主要产地,充分开发这一资源具有重要的研究意义。因此,本实验通过流式细胞术、双向电泳-质谱技术相结合的方法,在细胞水平探讨NGF对HSC-T6细胞增殖、凋亡作用以及细胞中与肝纤维化相关蛋白质的表达差异,为进一步揭示肝纤维化的发展机制及NGF抗肝纤维化提供理论依据。
1 材料与方法
1.1试剂和仪器眼镜蛇蛇毒NGF由广西医科大学蛇毒研究所提供;大鼠肝星状细胞HSC-T6购于湖南湘雅医学院;大鼠肾上腺嗜铬瘤细胞(PC-12)购于上海中科院细胞研究所;胎牛血清、马血清、F12培养基、MTT购自Sigma公司;高糖DMED培养基购自HYCLONE公司;PC-12细胞用含体积分数为10%胎牛血清+5%马血清+1%的双抗的F12K培养液;HSC-T6细胞用含体积分数为10%胎牛血清+1%双抗的高糖DMED培养液,于CO2培养箱(37℃、5%CO2)培养。双向电泳所用试剂主要购自Promega公司,17 cm固相pH梯度(IPG)干胶条(pH 3~10)、IPGphorTM等电聚焦系统、Ettan DALT Six垂直电泳仪、高分辨的图像扫描仪和凝胶斑点采集仪(Picker)购于BIO-RAD公司。所有试剂以去离子水配置。
1.2实验方法
1.2.1眼镜蛇毒NGF活性鉴定 将生长良好的PC-12细胞以每毫升5×105个细胞的浓度接种于24孔板。待细胞贴壁后吸掉培养基,加入眼镜蛇NGF,并换用低浓度血清培养液(体积分数为2%马血清+5%胎牛血清的F12K培养液)进行培养,使NGF终浓度为2 mg·L-1,培养时间为2~4 d,其间在普通显微镜下观察细胞形态变化。
1.2.2MTT法检测HSC-T6细胞的增值 取对数生长期的HSC-T6细胞,用含体积分数为10%胎牛血清的高糖DMED培养液调整细胞密度至每毫升2×105个,接种于96孔板。待培养细胞至贴壁后,加入 NGF。以不同浓度 NGF(1、2、5、10、20 mg·L-1)分组,同时设置未加任何药物的空白对照组,每组设6个复孔。作用24 h后,每孔加5 000 mg·L-1的 MTT 贮存液 20 μl,孵育 4 h,弃上清并每孔再加150 μl DMSO溶解细胞内结晶,振荡器上振荡10 min,孵育10 min,酶标仪595 nm处测各孔吸光度。
1.2.3流式细胞仪观察和测定HSC-T6细胞凋亡实验设立空白对照组和NGF干预组,NGF浓度根据MTT结果选2、5 mg·L-1的NGF浓度进流式细胞仪实验。将对数生长的HSC-T6细胞接种于6孔板,每孔2 ml,培养12 h细胞贴壁,吸掉培养基,用体积分数为5%胎牛血清的高糖DMED培养基进行培养,并加入NGF,在培养箱孵育24 h,胰酶消化离心收集细胞。用体积分数为2%BSA的PBS洗细胞两次,加入300 μl流式上样缓冲液、5 μl FITC 和 5 μl PI,均匀混合,避光反应5~15 min。0.5 h内上机检测。
1.2.4双向凝胶电泳细胞总蛋白的提取 取生长良好的HSC-T6细胞于25 ml培养瓶里进行培养,待细胞长满培养瓶的60% ~70%开始药物作用,实验分为空白对照组和NGF药物作用组,NGF药物浓度根据MTT实验的结果以半数抑制率对应的药物浓度,用体积分数为5%胎牛血清的高糖DMED培养基培养,药物作用24 h后分别提取细胞总蛋白,同时每个组做3次平行实验。提取出来的细胞总蛋白用3 ku的超滤管进行超滤以除盐,然后用考马斯亮蓝法定量蛋白质浓度,SDS-PAGE电泳分析细胞总蛋白,并把蛋白质等质量分装真空冻干机冻干备用。
1.2.5双向凝胶电泳 使用17 cm IPG胶条(非线性)进行等电聚焦电泳,应用胶内泡胀法进行加样,蛋白上样量为500 μg左右。采用低电压50 V,12 h主动水化。等电聚焦步骤如下:500 V 1 h、1 000 V 1 h、10 000 V 5 h,待17 cm胶条等电聚焦总伏时达到60 000 V时结束聚焦。将胶条取出,在平衡液中进行两步平衡,平衡后将胶条转移到SDS-PAGE上,用质量分数为0.5%的低熔点琼脂糖封胶后进行第二向电泳,电泳条件为每块胶恒定电流10 mA,20 min后将电流加大到30 mA,待溴酚蓝指示带到达凝胶底部处结束电泳。
1.2.6银染及图像分析 SDS-PAGE凝胶使用固定液固定2 h以上,敏化液敏化30 min,用蒸馏水漂洗3次,每次15 min,然后银染20 min,倒掉银染液用蒸馏水漂洗2次,每次1 min,马上加入显色液晃动直到看到明显的蛋白点,立刻用终止液进行终止反应,最后用蒸馏水保存。然后通过GS-800凝胶扫描仪获得数字化图像,并用PD Quest 7.3软件进行分析。
1.2.7差异蛋白质点的鉴定 对表达差异在2倍以上的蛋白质点从凝胶上用枪头挖出来,然后进行胶内酶解,把酶解出来的蛋白质多肽用Zip Tip脱盐柱脱盐,浓缩后与基质1∶1比例混合,点在点板仪上,自然晾干后MALDI-TOF/TOF-MS检测,鉴定差异蛋白质。
1.3统计学处理采用SPSS 17.0统计学软件进行分析,组间差异用t检验,以±s表示。图谱分析由STATA 7.0统计分析软件(State Corp,College Station,TX,USA)完成。
2 结果
2.1NGF性质鉴定在空白对照组中PC12细胞体积缩小,细胞呈圆形或椭圆形,也有部分呈不规则形,无明显突起。而NGF实验组,可见PC12细胞长出多个神经纤维样的突触,突触数目不等,长短不一,有些交织成网状,细胞的分化程度与NGF呈时间依赖性,见Fig 1。结果表明,NGF能诱导PC12细胞分化,并具有良好的生物学活性。
2.2NGF对HSC-T6细胞增殖的影响将不同浓度的NGF干预对数生长的HSC-T6,MTT结果显示,与空白对照比较,NGF各剂量组均不同程度地抑制HSC-T6细胞的增殖,NGF浓度为1 mg·L-1时抑制率差异具有统计学意义(P<0.05);5 mg·L-1差异效果变得比较明显(P<0.01),抑制率先随着NGF浓度的增加而变大,然后又开始减小,见Tab 1,说明NGF在一定浓度范围内具有抑制HSC-T6细胞增殖的作用。

Fig 1 Analysis of the activity of PC-12 cells treated with cobra venom NGF

Fig 2 HSC-T6 cells after the cobra venom NGF is added(detected by flow cytometry)
Tab 1 Effect of NGF on the proliferation of HSC-T6(±s)
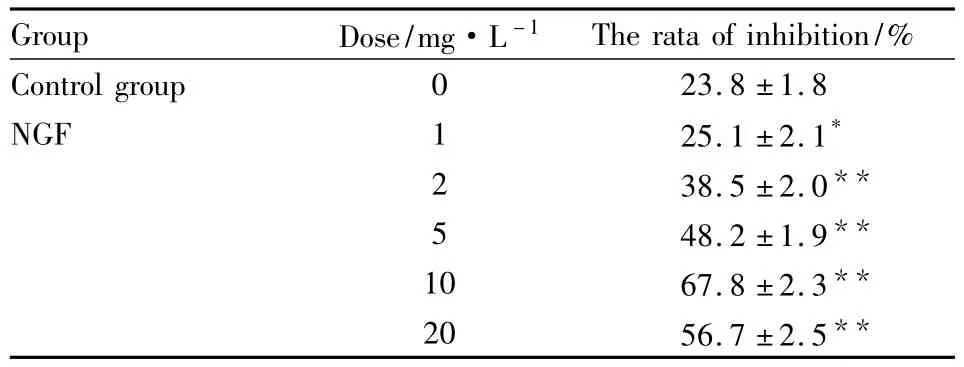
Tab 1 Effect of NGF on the proliferation of HSC-T6(±s)
*P<0.05,**P<0.01 vs control group
Group Dose/mg·L-1The rata of inhibition/%Control group 0 23.8 ±1.8 NGF 1 25.1 ±2.1*2 38.5 ±2.0**5 48.2 ±1.9**10 67.8 ±2.3**20 56.7 ±2.5**
2.3NGF对HSC-T6细胞凋亡的影响经流式细胞仪检测显示,空白对照组有少数细胞凋亡,而NGF干预组作用24 h后检测不同浓度组均存在不同程度的凋亡。其中NGF浓度为2 mg·L-1时凋亡率(16.16% ±3.02%),与空白对照组凋亡率(2.70%±1.55%)比较差异具有统计学意义(P<0.01);当 NGF浓度升到 5 mg·L-1时,凋亡率为21.15%±3.31%,与对照组凋亡率比较差异也具有统计学意义(P<0.01),并且凋亡效果更加明显,说明NGF可诱导HSC-T6细胞发生凋亡,见Fig 2。
2.4细胞总蛋白SDS-PAGE电泳图SDS-PAGE电泳显示空白对照组和NGF作用组细胞总蛋白的条带非常多,分子量大小不一,看不出明显的差异条带,见 Fig 3。
2.5HSC-T6细胞的2-DE图谱的建立及差异分析对空白对照组和NGF作用的实验组HSC-T6细胞总蛋白进行双向电泳,获得2张电泳图谱,空白对照的HSC-T6细胞和NGF作用的HSC-T6细胞的平均蛋白质点分别为(668±28)个和(607±23)个,两组之间的匹配率为90.9%。利用图像分析软件对蛋白图谱进行差异分析筛选出差异表达的蛋白47个,其中在NGF作用HSC-T6中表达上调的25个,下调的22个。其中NGF组中箭头标注为部分差异表达的蛋白质点,见Fig 4。

Fig 3 SDS-PAGE electrophoresis

Fig 4 Two-dimensional electrophoresis
2.6质谱鉴定结果对两组中表达差异在2倍以上的蛋白质点13个,通过质谱鉴定出13个蛋白质肽谱图,利用Peptidem查询软件搜索Mascot数据库得到9个蛋白质,有4个无法鉴定出结果。相对于无NGF干预的对照组,在NGF干预的实验组中有4个表达上调(用“↑”表示),有5个表达下调(用“↓”表示),结果见Tab 2,这些蛋白质主要参与细胞增殖、细胞凋亡、细胞代谢以及细胞信号传导等相关途径。
3 讨论
随着对肝病研究的不断深入与发展,肝纤维化被认为是肝硬化、肝癌发生、发展的关键而又必经的过程。因此揭示肝纤维化发生发展机制以及抑制其发展成为预防和控制肝癌发展的重要途径。近来研究表明,逆转肝纤维化关键在于减少活化的HSC数量,而HSC的数量是由HSC增殖和凋亡共同决定的,从理论上讲,减少活化HSC数量有这些途径:抑制HSC的增殖;诱导HSC发生凋亡,直接减少HSC数量;逆转活化的HSC细胞,让其变回静止型等。但研究表明抑制其增殖和诱导凋亡是减少活化型HSC数量的主要途径[6]。近年来,有研究显示NGF能抑制HSC细胞增殖并诱导其发生凋亡[7]。
本实验用眼镜蛇毒NGF对大鼠肝纤维化细胞株HSC-T6进行干预,MMT检测结果发现NGF能明显抑制HSC-T6的增殖(P<0.05);并且,流式细胞术结果也发现NGF能够诱导HSC-T6细胞发生凋亡(P<0.05),说明NGF具有抑制HSC-T6细胞增殖以及诱导其凋亡的作用。这可能是NGF作用HSCT6细胞后,通过某些途径参与抑制细胞增殖及诱导细胞凋亡的过程。有体外实验证明,NGF诱导HSCT6细胞凋亡主要是通过与细胞表面低亲和力受体p75结合介导胞内信号传递实现的,而促凋亡受体p75与抗凋亡因子TrkA在细胞凋亡过程中起着主要的作用[8]。
肝纤维化过程中基因并没有发生改变,而是某些基因表达不足或者过度表达引起,对肝纤维化中那些激活并过度表达的胶原基因进行抑制或封闭,对治疗肝纤维化具有广阔的前景[9]。目前认为ECM是主要的胶原蛋白,其过度表达和异常沉积是肝纤维化发生的主要机制[10]。因此,研究肝纤维化过程中与其相关蛋白质的变化对揭示肝纤维化的发生机制及抗肝纤维化药物的研发具有主要的意义。双向电泳(2-DE)作为研究蛋白质组学一种传统而又实用的技术,其操作简单,并能够在一个实验系统中同时研究多种蛋白质的变化,把这种技术应用于肝纤维化发生发展过程中,有助于全面阐明肝纤维化发生过程中各种蛋白质的变化情况[11]。由于2-DE对蛋白中盐浓度以及一些杂质比较敏感,容易受到影响,从而使所得的蛋白图谱分辨率较低。因此,为了得到分辨率更高、重复性更好的细胞蛋白2-DE技术方案,根据多年来在蛋白质组学方面的实验积累[12~13],本实验对样品预处理方案和硝酸银染色方法等进行了优化,得到更为理想的细胞2-DE图谱。

Tab 2 Differentially expressed protein
同时本课题应用双向电泳-质谱技术相结合,分析眼镜蛇毒NGF干预前后HSC-T6细胞蛋白质的差异表达,发现在两张图谱上相对应的位置并没有蛋白质点完全沉默,而是相对表达上调或者下调。这也说明在肝纤维化过程中没有发现基因的异常,而是某些基因过度表达或表达不足。质谱鉴定出的差异的蛋白质,通过功能分析发现这些蛋白主要参与细胞代谢、细胞增殖、细胞凋亡、细胞信号传导等相关途径。特别是表达下调的转化生长因子TGF-β1和金属蛋白酶组织抑制物TIMP-2,这是与肝纤维化相关性很紧密的蛋白,主要参与调节ECM合成和降解的作用。多项研究表明,TGF-β1是强有力的致纤维化细胞因子,在肝纤维化中表达明显增多,可促进HSC的增殖和活化,使ECM合成增多,降解减少,并存在正反馈放大效应,促进肝纤维化的进程[14]。而实验组中发现TGF-β1是表达下调的,这可能是抑制肝纤维化的有利信号。还有些蛋白是酶类,主要参与细胞的代谢与氧化应激反应等过程。说明改变细胞内代谢及氧化应激也可能是引起细胞发生凋亡的一个重要因素。
总之,肝纤维化的发生发展是一个多细胞参与、多途径的复杂过程,本实验用眼镜蛇毒NGF干预HSC-T6细胞,在细胞水平上发现其能抑制HSC-T6细胞的增殖、诱导HSC-T6细胞凋亡以及使HSC-T6细胞中与肝纤维化相关蛋白质表达发生改变,这提示我们蛇毒NGF可能成为一种新型的抗肝纤维化药物。蛇毒NGF可能是通过上调或者下调与肝纤维化相关蛋白质来实现抑制HSC-T6细胞的增殖、诱导HSC-T6细胞凋亡,从而达到抗肝纤维化的目的。而这些差异蛋白质的结构、功能和在整个抗肝纤维化网络中的作用有待于进一步的研究。
[1]Limuro Y,Brenner D A.Matrix metalloproteinase gene delivery for liver fibrosis[J].Pharm Res,2008,25:249 - 58.
[2]Weng H,Mertens P R,Gressner A M,et al.IFN-Y abrogates profibrogenic TGF-beta signaling in liver by targeting expression of inhibitory and receptor Smads[J].J Hepatol,2007,46(2):295-303.
[3]Comporti M,Signorini C,Arezzini B,et al.Isoprostanes and hepatic fibrosis[J].Mol Aspects Med,2008,29:43 - 9.
[4]刘成海,刘 平,胡义扬,等.丹酚酸B盐对转化生长因子-β1刺激肝星状细胞活化与胞内信号转导的作用[J].中华医学杂志,2002,82:1267 -72.
[4]Xiu C H,Xiu P,Hu Y Y,et al.Effects of salvianolic acid B on TGF-β1 stimulated hepatic stellate cell activation and its intracellular signaling[J].Nat Med J China,2002,18:1267 -72.
[5]Paoletti F,Malerba F,Kelly G,et al.Conformational plasticity of proNGF[J].Plos One,2011,6(7):1 -9.
[6]Gabele E,Brenner D A,Rippe R A.Liver fibrosis:signals leading to the amplification of the fibrogenic hepatic stellate cell[J].Front Biosci,2003,8(1):69 - d77.
[7]Trim N,Morgan S,Evans M,et al.Hepatic stellate cells express the low affinity nerve growth factor receptor p75 and undergo apoptosis in response to nerve growth factor stimulation[J].Am J Pathol,2000,156(4):1235 -43.
[8]Rabizadeh S,Oh J,Zhong L T,et al.Induction of apoptosis by the low-affinity NGF receptor[J].Science,1993,261(5119):345-8.
[9]Prieto J,Qian C,Hernandez A,et al.Gene therapy of liver diseases[J].Exp Opin Biol Ther,2004,4(7):1073 -91.
[10]Tsukada S,Parsons C J,Rippe R A.Mechanisms of liver fibrosis[J].Clin Chim Acta,2006,364:33 -60.
[11]程明亮.细胞信号转导与功能蛋自质组学在肝纤维化发生机制研究中的新动向[J].中西医结合肝病杂志,2005,15(15):193-4.
[11]Cheng M L.The new trends of cellular signal transduction and functional proteomics in liver fibrosis mechanism[J].Chin Acad J Electr Publish House,2005,15(15):193 -4.
[12]赵 欣,蒲小平,耿兴超.松果菊苷对帕金森病模型小鼠黑质纹状体蛋白表达影响的双向电泳分析[J].中国药理学通报,2008,24(1):28 -32.
[12]Zhao X,Pu X P,Geng X C.Effects of echinacoside on protein expression from substantia nigra and striatal tissue in mouse MPTP model of Parkinsons disease by using 2-dimensional electrophoresis analysis[J].Chin Pharmacol Bull,2008,24(1):28 -32.
[13]赵 欣,蒲小平.蛋白质组学在药物研究中的应用[J].中国药理学通报,2009,25(8):988 -91.
[13]Zhao X,Pu X P.The application of proteomics technology in drug study[J].Chin Pharmacol Bull,2009,25(8):988 -91.
[14]Schnur J,Oláh J,Szepesi A,et al.Thioacetamide-induced hepatic fibrosis in transforming growth factor beta-1 transgenic mice[J].Eur J Gastroenterol Hepatol,2004,16(2):127 -33.

