复方二氯醋酸二异丙胺氯化钠注射液的制备工艺
何伟,肖卫红,周本宏 (.武汉市第一医院药学部,湖北 武汉 4300;.武汉大学药学院,湖北 武汉 430060)
复方二氯醋酸二异丙胺氯化钠注射液在临床主要用于急慢性肝炎的辅助治疗以及脂肪肝或一般肝功能障碍的辅助治疗[1]。复方二氯醋酸二异丙胺注射液为二氯醋酸二异丙胺与葡萄糖酸钠制成的灭菌水溶液,目前临床上常用的规格为2mL,使用之前加入5%的葡萄糖输液或0.9%的氯化钠输液静脉滴注使用。为避免药液配制过程中的二次污染,减少医护工作者的劳动强度,方便患者使用,以及减少患者的经济负担,本试验参考上市产品的规格并根据市场需求,对复方二氯醋酸二异丙胺氯化钠100mL注射液的制备工艺进行了研究。
1 仪器与试药
Metter-AE26O电子天平(Mettler公司);Phs-3C型精密pH计(上海雷磁精密仪器厂);注射用二氯醋酸二异丙胺,注射用葡萄糖酸钠(上海通用药业股份有限公司第三公司,含量大于99.5%);注射用氯化钠(武汉银河化工有限责任公司,含量大于99.5%);针用炭(上海活性炭总厂)。
2 方法
2.1 规格的确定 我国目前上市的复方二氯醋酸二异丙胺注射液规格为:(1)1mL:二氯醋酸二异丙胺20mg与葡萄糖酸钠19mg;(2)2mL:二氯醋酸二异丙胺40mg与葡萄糖酸钠38mg。
参考该规格并根据市场需求,制定复方二氯醋酸二异丙胺氯化钠注射液的规格为(1)100mL:二氯醋酸二异丙胺20mg、葡萄糖酸钠19mg与氯化钠0.9g;(2)100mL:二氯醋酸二异丙胺40mg、葡萄糖酸钠38mg与氯化钠0.9g。2种规格浓度不一致,装量相同。
2.2 工艺研究
2.2.1 制备工艺 取注射用水800mL,加热至60℃,保温。加入处方量的二氯醋酸二异丙胺、葡萄糖酸钠、氯化钠,充分搅拌使溶解。加入0.1%针用活性炭,搅拌15min,趁热粗滤。补加注射用水至全量,检测半成品。分别经0.45,0.22μm聚四氟乙烯微孔滤膜精滤至澄明,灌装、压盖,115℃、0.075MPa热压灭菌30min,冷却,取出进行灯检并进行样品全检。产品全检合格后,包装得成品。
2.2.2 含量测定方法
(1)二氯醋酸二异丙胺含量测定[2]:以依利特C18柱(4.6mm×150mm,5μm)为色谱柱;流动相为0.9%氯化钠溶液(用磷酸调节pH 值至2.5);检测波长210nm;柱温为室温;流速为1.0mL·min-1;进样量:20μL。理论板数按二氯醋酸二异丙胺峰计算应不低于2 000。线性回归方程为A=1 312 092C-2 463,r=0.999 5,线性范围0.02~0.18mg·mL-1
(2)葡萄糖酸钠含量测定:以旋光度测定法(中国药典2010年版二部附录ⅥE)测定本品中葡萄糖酸钠含量。
(3)氯化钠的含量测定:参照中国药典2010年版二部“氯化钠注射液”的含量测定方法硝酸银滴定法测定本品中氯化钠含量。
2.2.3 稳定性评价
(1)溶解度考察:二氯醋酸二异丙胺、葡萄糖酸钠、氯化钠均在水中易溶,按处方配制复方二氯醋酸二异丙胺氯化钠溶液,放置在冰箱(4℃)、80℃及4 500Lx光照下考察10d,结果样品无析晶或变浑浊情况,表明复方二氯醋酸二异丙胺氯化钠在拟订处方溶液中溶解性良好,可以满足注射液的要求。
(2)pH值的确定:由于注射液的特殊要求,结合国家标准对复方二氯醋酸二异丙胺注射液的pH值(4.0~6.5)要求,故对本制剂pH 4.0~7.0范围内进行考察。
按上述工艺分别配制规格(1)和规格(2)的溶液各4 000mL,分4份,分别用0.1mol·L-1盐酸液或0.1mol·L-1氢氧化钠液调节pH 值至4.0,5.0,6.0,7.0,观察不同pH值的复方二氯醋酸二异丙胺氯化钠溶液在高温(100℃)条件下2h的含量,结果见表1。

表1 不同pH值的复方二氯醋酸二异丙胺氯化钠溶液高温2 h试验结果Tab 1 Effect of different pH values on compound diisopropylamine dichloroacetate and sodium chloride infusion at high temperature two hours
从表1可以看出,复方二氯醋酸二异丙胺氯化钠溶液在高温条件下放置2h,pH值在4.0~7.0范围内,样品稳定,根据注射液pH值要求范围及人体的生理适应性,确定本品的pH值范围为4.0~7.0。
2.2.4 活性炭用法用量的筛选 在注射液制备工艺中须加入适量的活性炭以吸附热原和脱色,试验筛选主要考察活性炭对二氯醋酸二异丙胺、葡萄糖酸钠、氯化钠的吸附。方法为按上述工艺配制20mg规格的溶液4 000mL,分4份,其中1份不加针用活性炭,另3份分别加入不同量(0.1%,0.3%,0.5%)的针用活性炭,保温60℃,吸附15min,分别趁热抽滤除炭,并用水洗涤活性炭2次,洗液与滤液合并,每份补水至全量,分别取样测定含量(脱炭前含量计作100.0%)。测定结果与未加活性炭样品比较,结果见表2。
结果表明:活性炭对二氯醋酸二异丙胺、葡萄糖酸钠有明显的吸附,确定复方二氯醋酸二异丙胺氯化钠溶液加入0.1%针用活性炭。
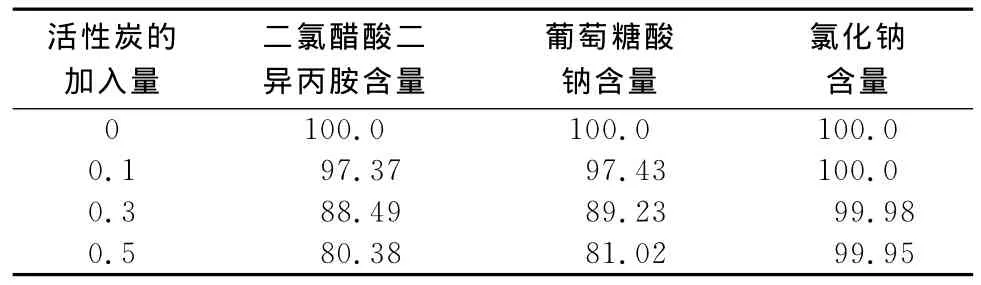
表2 活性炭用法用量筛选试验结果 (%)Tab 2 Results of screening test of the dosage of activated carbon(%)
2.2.5 灭菌条件的确定 按处方配制复方二氯醋酸二异丙胺氯化钠注射液,分别采用100℃流通蒸汽下灭菌60min、109℃热压灭菌45min、115℃热压灭菌30min,测定结果见表3。

表3 灭菌条件对注射液的影响Tab 3 Effect of sterilization conditions on injection
由表3结果,选用生产上简便易行的115℃灭菌30min。
2.3 成品质量检查 以确定的处方与工艺制备中试产品复方二氯醋酸二异丙胺氯化钠注射液两规格各3批,并对其质量进行检查,结果见表4。
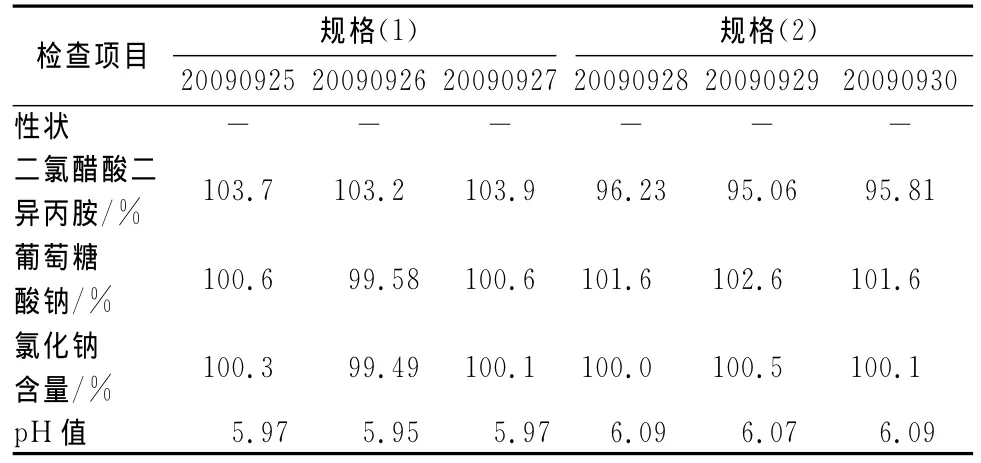
表4 复方二氯醋酸二异丙胺氯化钠注射液质量检查结果Tab 4 Quality analysis of compound diisopropylamine dichloroacetate and sodium chloride infusion
结果表明,2个规格各3批样品均符合质量标准的规定,说明选定的处方与工艺是合理的。
3 稳定性试验
3.1 影响因素试验 取复方二氯醋酸二异丙胺氯化钠注射液规格(1)和规格(2)各1批,分别放置于照度为4 500Lx的光源下、4℃、60℃温度下,分别于5、10d取样,考察各项指标,并与0天的结果比较。结果本品在光照(4 500Lx)、低温(4℃)、高温(60℃)条件下放置10d,各指标无明显变化,说明本品是比较稳定的。
3.2 加速试验 取复方二氯醋酸二异丙胺氯化钠注射液[规格(1):20090830、20090906、20090907、20090925、2009092、20090927 批;规 格 (2):20090910、 20090919、 20090920、 20090928、20090929、20090930批],按市售包装,在温度(40±2)℃、相对湿度为(75±5)%的条件下放置6个月,分别在放置后的第1、2、3、6个月末分别取样一次,按稳定性重点考察项目检测其性状、pH值、含量及无菌,并同0月比较。结果加速试验结果表明,复方二氯醋酸二异丙胺氯化钠注射液,按市售包装条件,在加速试验条件下稳定性重点考察项目均无明显变化,表明复方二氯醋酸二异丙胺氯化钠注射液在40℃条件下是比较稳定的,可将其有效期暂定为24个月。
4 讨论
活性炭的用量应视原料质量、品种而定,常用量为0.1%~0.5%[3]。若用量不足,对杂质、热原等不能完全吸附,用量过大,可能吸附主药,造成药物含量降低。活性炭的用量与活性炭的吸附力、活性炭对药物的吸附力,溶媒的性质、药物的结构等因素都有关系。本试验中对主要含量较少的20mg规格的复方二氯醋酸二异丙胺氯化钠注射液所用活性炭的用量进行考察,选用0.1%质量分数的活性炭较为合适。
对注射剂灭菌条件的选择,以达到灭菌效果,同时保证药物的理化性质及治疗作用不改变[4],本试验中所采用的3个灭菌条件均能达到灭菌的效果,但考虑到生产的通用性,选用生产上简便易行的115℃灭菌30min为灭菌条件。
[1]张石革.脂肪肝与药物治疗[J].中国药房,2006,16(21):1680.
[2]何伟,周本宏.HPLC法测定复方二氯醋酸二异丙胺氯化钠注射液中二氯醋酸二异丙胺的含量[J].数理医药学杂志,2011,24(6):727-728.
[3]屠锡德,张钧寿,朱家璧.药剂学[M].北京:人民卫生出版社,2002:421.
[4]徐荣周,缪立德,薛大权,等.药物制剂生产工艺与注解[M].北京:化学工业出版社,2008:145.

