肝癌血浆游离DNA甲基化谱检测及临床意义*
张 晔 杨 斌 王毅军 高英堂 白 同 白 彧 杜 智
肝细胞癌发生的分子机制仍不明确,但抑癌基因启动子区的异常甲基化可使抑癌基因失活,是参与肝癌发生、发展的重要机制之一。肝癌相关的抑癌基因异常甲基化,具有肿瘤特异性,可能用于开发肝癌诊断及预后评估的生物标志物。目前,对肝癌外周血游离DNA甲基化的研究局限于少数基因,结果也不尽相同[1-10]。本研究在肝癌血浆游离DNA中检测了12个抑癌基因的甲基化状态,首次筛查了肝癌特异性血浆游离DNA甲基化谱并评价其临床意义。
1 材料与方法
1.1 材料
1.1.1 研究对象 收集55例肝癌及54例慢性肝病(慢性病毒性肝炎或肝炎后肝硬化)患者全血标本,所有患者均为天津市第三中心医院2001年至2009年间住院患者。肝癌者经手术治疗,病理学检查证实为肝细胞癌。慢性肝病者依据临床表现及血清学、影像学、肝穿活检等检查做出临床诊断。标本取材通过伦理委员会审核,患者家属知情同意。
1.1.2 临床病理资料采集 55例肝癌患者中,男性46例,女性9例,中位年龄52.0岁,依据Child-Pugh标准评估肝功能,以影像学及术中所见评估肿瘤大体特征,结合影像学及病理所见评估血管侵犯,根据临床及病理结果进行国际TNM6分期。全部病例从手术日进入随访,随访内容包括术后复发时间、生存时间等。54例慢性肝病患者,男性42例,女性12例,中位年龄为50.2岁,包括慢性病毒性肝炎24例,肝炎后肝硬化30例。
1.2 方法
1.2.1 血浆游离DNA的提取 抗凝全血标本经3 000 g离心5 min,吸取上层血浆。400 μL血浆经QIAamp DNA Blood Mini Kit(德国Qiagen公司)试剂盒提取游离DNA,按操作说明进行,DNA溶解于超纯水中。
1.2.2 DNA的甲基化检测 采用亚硫酸氢钠修饰及甲基化特异性PCR(MSP)方法检测12个目标基因的甲基化状态,目标基因为 APC、p16、GSTP1、Cyclin D2、LHX1、TFPI2、DKK2、DKK3、SFRP2、14-3-3 sigma、ppENK、NPTX2。参考文献方法对DNA进行亚硫酸氢钠修饰及MSP检测[11]。简述如下,在上步提取的DNA标本中加入3 M的NaOH、10 mM的对苯二酚和3 M的亚硫酸氢钠溶液,温浴,使DNA中未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶保持不变,完成修饰过程。用无水乙醇洗涤、沉淀修饰后的DNA,溶于TE缓冲液中作为MSP的模板。针对修饰后的DNA序列,设计各基因特异性的引物,进行PCR扩增,各基因甲基化引物序列及退火温度见表1。全部引物由上海超生生物科技有限公司合成。PCR反应条件设定,预变性95℃,2 min;变性95℃,30 s,退火 35 s,延伸72℃,30 s;后延伸 72℃,5 min。每次PCR反应均以超纯水做阴性对照,以SssI甲基转移酶处理的外周血单个核细胞DNA作为各基因甲基化阳性对照。PCR产物经琼脂糖凝胶电泳判定结果。如果某基因的甲基化引物可以扩增出阳性结果,提示该标本该基因呈甲基化状态。用甲基化频率(甲基化频率=甲基化阳性例数/检测标本数×100%)表示各基因在不同组中的甲基化阳性率。用甲基化指数(methylation index,MI)反应同一个标本多个基因同时甲基化的状态,MI定义为:MI=被检测基因中发生甲基化的数量/被检测的基因总数。
1.3 统计学方法
统计分析应用SPSS 13.0软件完成,应用Chi-square检验或Fisher确切检验比较肝癌组与慢性肝病组甲基化频率差异。应用t检验、Chi-square检验和Fisher确切检验分析肝癌中各基因甲基化状态与临床病理资料间关系,应用Kaplan-Meier法建立肝癌中基因甲基化状态的总体生存和无瘤生存曲线,以Log-rank方法进行生存期假设检验。P<0.05为假设检验具有统计学差异。

表1 MSP反应各基因甲基化引物序列及退火温度Table 1 Primer sequences for PCR
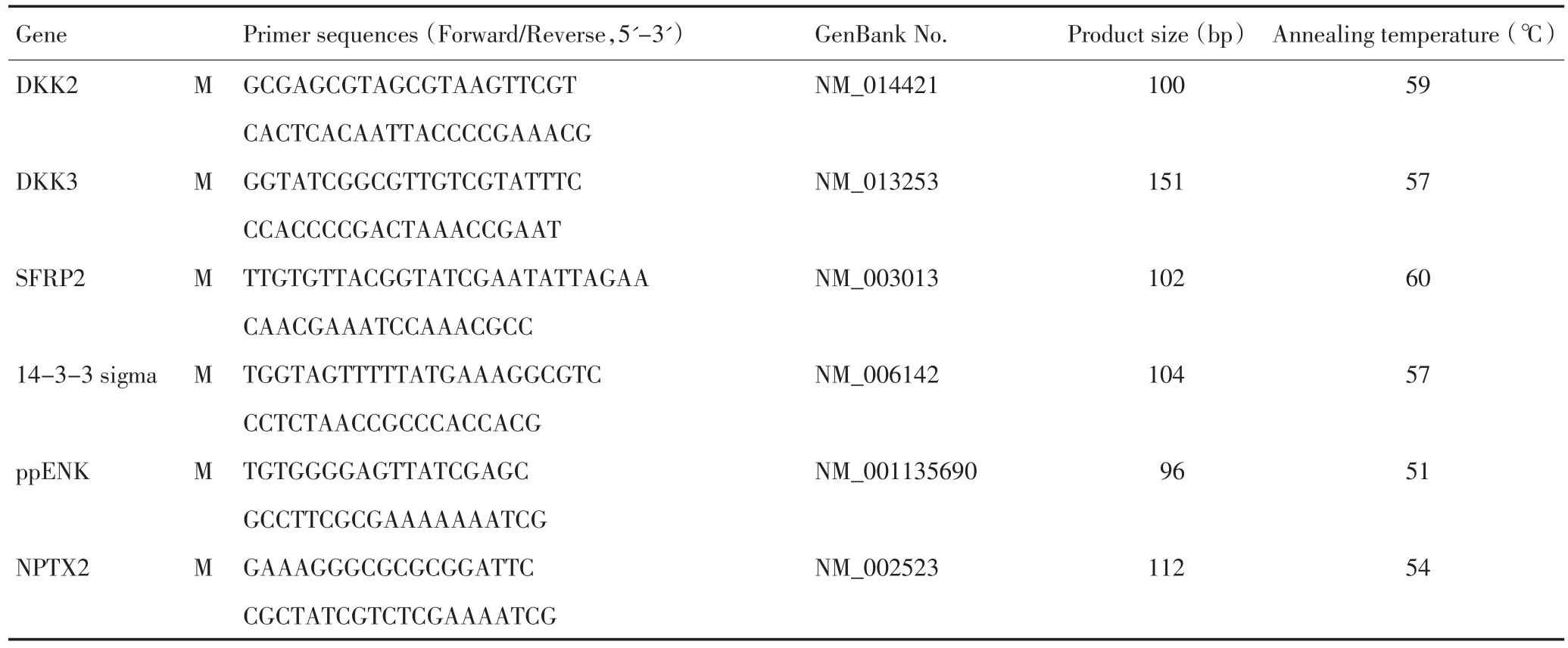
表1 MSP反应各基因甲基化引物序列及退火温度 (续表1)Table 1 Primer sequences for PCR (Continued table 1)
2 结果
2.1 肝癌患者临床病理资料及随访结果
肝癌患者临床病理资料显示:年龄>52岁的为27例,≤52岁的为28例,肝功能Child-Pugh A级为44例,Child-Pugh B级为11例,国际TNM6分期Ⅰ期为24例,Ⅱ期为31例。收集肝癌患者预后资料,55例患者随访期限1~43个月,中位随访时间为20个月,30例患者在随访期内复发,复发时间1~25个月,中位复发时间7个月。
2.2 MSP结果
MSP方法检测12个抑癌基因的甲基化状态,代表性电泳结果见图1,各基因在不同组中的甲基化频率如表2所示。比较不同组间各基因的甲基化频率差别,其中,肝癌组中APC、Cyclin D2、TFPI2、DKK3和GSTP1基因甲基化频率高于慢性肝病组,差异有统计学意义(P<0.01)。
2.3 肝癌组和慢性肝病组多基因甲基化数量分析
在检测的12个基因中,有5个基因在肝癌组甲基化频率显著高于慢性肝病组,选择APC、Cyclin D2、TFPI2、DKK3和GSTP1 5个基因组成甲基化谱,计算每一例标本的MI,肝癌组的MI中位值(0.6,IQR 0.4~0.8)明显高于慢性肝病组MI中位值(0.2,IQR 0~0.2),差异有统计学意义(P<0.001)。
2.4 肝癌组多基因甲基化状态与临床病理和生存资料的相关分析
在分析5个肝癌甲基化特异性基因与临床病理资料的相关性中,肝癌组病人分为高甲基化组(MI≥0.6)和低甲基化组(MI<0.6)。结果显示MI与患者年龄相关,年龄大的患者MI值偏高(P=0.007),其它临床病理参数与MI间未显示显著相关性。对甲基化状态不同的肝癌患者的整体生存期和无瘤生存期进行统计分析。结果显示,MI与肿瘤患者生存期未见明显相关(表3,图2,图3)。

图1 MSP甲基化引物扩增的PCR产物电泳图Figure 1 Representative results of MSP
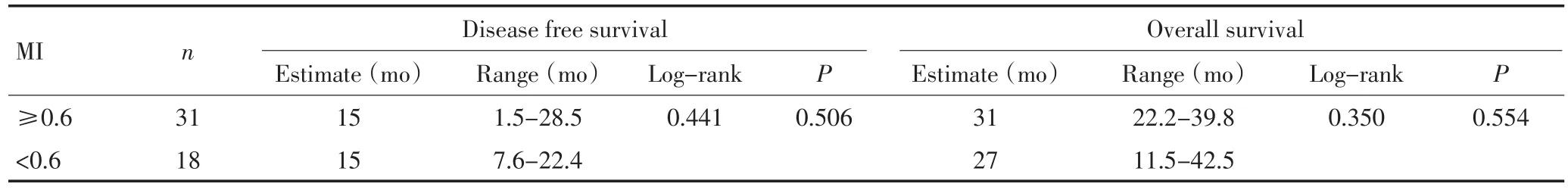
表3 肝癌组MI与患者整体生存和无瘤生存期相关性分析Table 3 Relation of MI with survival time in HCC

图2 肝癌组患者无瘤生存曲线Figure 2 Disease-free survival curve of HCC patients
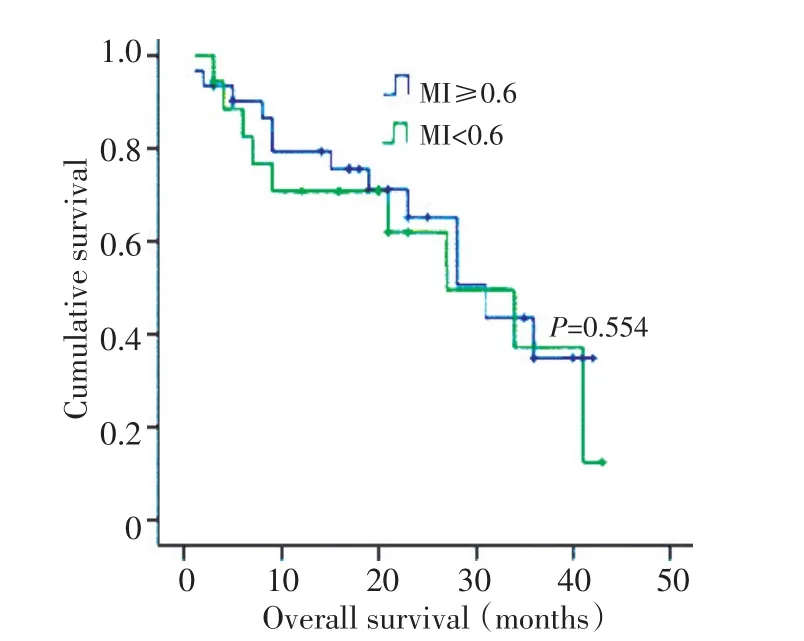
图3 肝癌组患者总体生存曲线Figure 3 Overall survival curves of HCC patients
3 讨论
目前,已有研究证实肿瘤患者外周血中游离DNA的含量高于正常人[12],肿瘤患者游离DNA进入血循环的可能机制包括肿瘤细胞凋亡或坏死后DNA释放进入血循环,或者肿瘤细胞将DNA分子片段直接分泌到细胞外,进入血循环[13]。检测这些肿瘤特异性的DNA,有助于开发核酸类肿瘤标志物。
关于肝癌外周血游离DNA的甲基化研究,目前已检测的基因有RASSF1A[1-5]、p16[3-4,6-7]、p15[3,7-8]、APC[4-5,7]、FHIT[7]、E-cadherin[4,7]、GSTP1[4-5,9]、Cyclin D2[10]、SFRP1[5]等,各研究组检测的基因不同,所用方法也不完全相同,对于相同的基因,结论也不完全相同。例如,Wong等[8]和Zhang等[3]的研究显示p16基因在肝癌者游离DNA的甲基化率明显高于肝硬化者,而Chang等[4]的研究却显示两者间无差别。这种差异体现了因地域差异、受检人群不同、样本量偏小等因素造成的单基因检测的不足。肝癌的发生、进展涉及到许多抑癌基因的异常甲基化,多基因联合检测,合理组成甲基化谱,作为诊断或预后标志物,其准确性优于单基因指标。
本研究选择的12个抑癌基因中,APC、Cyclin D2、TFPI2、DKK3、GSTP1的甲基化频率在肝癌组中明显高于慢性肝病组,具有较好的肿瘤特异性,可以作为甲基化谱的候选基因。Wang等[9]检测32例肝癌患者外周血游离DNA的GSTP1甲基化,阳性率为50%,Tsutsui等[10]检测70例肝癌者血清样本,Cyclin D2甲基化阳性率为55.7%,Sun等[14]最近检测游离DNA的TFPI2甲基化,显示肝癌组甲基化率为46.5%,显著高于对照组,Huang等[5]检测游离DNA的APC甲基化,肝癌组显著高于对照组。本研究GSTP1、Cyclin D2、TFPI2、APC甲基化阳性率分别为49.09%、63.64%、58.18%和78.18%,肝癌组显著高于肝病组,结果及结论与上述研究相似,提示这4个基因具有较广泛的代表性和肝癌特异性。此前,游离DNA中DKK3的甲基化检测尚无报道,但在组织标本中,该基因甲基化表现为肝癌的高发事件,且具有较好的特异性[15]。功能研究显示这些特异的基因参与细胞周期调控、细胞凋亡调控等重要过程。如APC基因高甲基化失活后,可以激活Wnt/β-catenin途径,从而促进细胞增殖,导致肝癌形成[16]。DKK3是Wnt途径的拮抗剂,甲基化使之失活,同样可激活Wnt途径,促进肿瘤形成[17]。肝癌外周血游离DNA同样具有这些特征,可从中检测出特异的基因甲基化,是将这些特异基因作为生物标志物的基础。
以APC、Cyclin D2、TFPI2、DKK3、GSTP1 组成肝癌特异的甲基化谱,以MI反应甲基化谱整体的甲基化程度,肝癌组的MI显著高于慢性肝病组,这反映了由慢性肝病到肝癌甲基化程度加强的过程。在慢性肝病组也同样检测到一些基因的甲基化事件,这种甲基化异常被认为与年龄、营养等因素相关,甲基化谱可最大程度地减小单基因甲基化受背景因素的干扰。对临床病理资料与MI进行相关分析,发现MI与年龄相关,年龄高者,MI值较大,这与Ahuja等[18]的研究结论一致,该研究以组织标本为材料,显示出年龄是导致基因高甲基化的重要因素,本研究在游离DNA标本中,同样显示出随着年龄增长,甲基化程度增强的趋势。在生存分析中,MI与无瘤生存期和整体生存期均未见相关性,提示以目前的5个特异基因组成的甲基化谱,尚不能作为肝癌预后评估的指标。扩大甲基化谱的基因数量,加入与肝癌复发、转移、侵袭力等密切相关的抑癌基因,可能会发现生存期与基因甲基化程度间的联系,进而筛选出较好的预后指标。
今后,增加候选基因、扩大样本量、进行前瞻性研究将更好地优化、验证甲基化谱作为肿瘤标志物的价值。
1 Lang H,Gang C,Hongping Y,et al.Clinicopathological signifi⁃cance of RASSF1A reduced expression and hypermethylation in he⁃patocellular carcinoma[J].Hepatol Int,2010,4:423-432.
2 Chan KC,Lai PB,Mok TS,et al.Quantitative analysis of circulat⁃ing methylated DNA as a biomarker for hepatocellular carcinoma[J].Clin Chem,2008,54(9):1528-1536.
3 Zhang YJ,Wu HC,Shen J,et al.Predicting hepatocellular carcino⁃ma by detection of aberrant promoter methylation in serum DNA[J].Clin Cancer Res,2007,13(8):2378-2384.
4 Chang H,Yi B,Li L,et al.Methylation of tumor associated genes in tissue and plasma samples from liver disease patients[J].Exp Mol Pathol,2008,85(2):96-100.
5 Huang ZH,Hu Y,Hua D,et al.Quantitative analysis of multiple methylated genes in plasma for the diagnosis and prognosis of hepa⁃tocellular carcinoma[J].Exp Mol Pathol,2011,91(3):702-707.
6 Zhang YJ,Rossner P Jr,Chen Y,et al.Aflatoxin B1 and polycyclic aromatic hydrocarbon adducts,p53 mutations and p16 methylation in liver tissue and plasma of hepatocellular carcinoma patients[J].Int J Cancer,2006,119(5):985-991.
7 Iyer P,Zekri AR,Hung CW,et al.Concordance of DNA methyla⁃tion pattern in plasma and tumor DNA of Egyptian hepatocellular carcinoma patients[J].Exp Mol Pathol,2010,88(1):107-111.
8 Wong I,Dennis Y,Winnie Y,et al.Frequent p15 promoter methyl⁃ation in tumor and peripheral blood from hepatocellular carcinoma patients[J].Clin Cancer Res,2000,6:3516-3521.
9 Wang JH,Qin Y,Li B,et al.Detection of aberrant promoter meth⁃ylation of GSTP1 in the tumor and serum of Chinese human prima⁃ry hepatocellular carcinoma patients[J].Clinical Biochemistry,2006,39:344-348.
10 Tsutsui M,Iizuka N,Moribe T,et al.Methylated cyclin D2 gene cir⁃culating in the blood as a prognosis predictor of hepatocellular carci⁃noma[J].Clin Chim Acta,2010,411(7-8):516-520.
11 齐 翀,李建芳,瞿 颖,等.胃癌血清肿瘤相关基因超甲基化检测及其意义[J].中国肿瘤临床,2007,34(22):1275-1279.
12 Leon SA.Free DNA in the serum of caneer patients and the effect of therapy[J].Cancer Res,1977,37:646-650.
13 Martin W,Usha M.Circulating methylated DNA:a new generation of tumor markers[J].Clin Cancer Res,2006,12(24):7205-7208.
14 Sun FK,Fan YC,Zhao J,et al.Detection of TFPI2 methylation in the serum of hepatocellular carcinoma patients[J].Dig Dis Sci,2013,58(4):1010-1015.
15 Yang B,Du Z,Gao YT,et al.Methylation of Dickkopf-3 as a prog⁃nostic factor in cirrhosis-related hepatocellular carcinoma[J].World J Gastroenterol,2010,16(6):755-763.
16 Colnot S,Decaens T,Niwa-Kawakita M,et al.Liver-targeted dis⁃ruption of Apc in mice activates beta-catenin signaling and leads to hepatocellular carcinomas[J].Proc Natl Acad Sci,2004,101:17216-17221.
17 Niehrs C.Function and biological roles of the Dickkopf family of Wnt modulators[J].Oncogene,2006,25:7469-7481.
18 Ahuja N,Li Q,Mohan AL,et al.Aging and DNA methylation in colorectal mucosa and cancer[J].Cancer Res,1998,58(23):5489-5494.
- 中国肿瘤临床的其它文章
- 尼妥珠单抗联合术后同步放化疗治疗华人恶性胶质瘤的Ⅰ期临床试验*

