双胎妊娠染色体非整倍体产前筛查及诊断
S O G C
双胎妊娠染色体非整倍体产前筛查及诊断
S O G C
1 双胎妊娠流行病学、合子性质及绒毛膜性
自从20世纪80年代以后,在加拿大和其他发展国家多胎妊娠的发生率大幅度的增加。在1995~2004年期间,多胎妊娠的出生率从2.2%稳定增长到3.0%[1]。主要的2个原因是妇女生育年龄普遍提高、辅助生殖技术的普及与不规范的卵巢刺激。
合子性质反映了胎儿的遗传同一性,而绒毛膜性指的是胎盘的分布。在单合子双胎中,单个受精卵在多次卵裂后分裂成2个独立的个体,几乎所有这样的双胎基因完全相同,因此性别是一样的。在极少数情况下,由于基因突变或染色体不分离可引起单合子双胎基因不一致,引起双胎表型和染色体不一致[2]。当2个独立的卵母细胞同时受精时,形成双合子双胎,这种双胎遗传基因是截然不同的,而且染色体也常常不一致。单合子双胎的发生率非常稳定,约为4/1000。辅助生殖技术使单合子双胎的发生率增加了2~12倍[3-5],具体机制尚不清楚[6]。双合子双胎的发生率随着孕妇年龄、种族及不孕治疗(机制等同于母体血清卵泡雌激素水平的升高)的影响变化很大。总的来说,约66%的双胎妊娠为双合子双胎,33%为单合子双胎。
双胎绒毛膜性质的确定至关重要,在第一孕期评估准确率最佳。孕早期超声诊断双胎绒毛膜性的准确性达到96%~100%,孕中期则明显降低,约为80%[7-9]。绒毛膜性决定双胎的妊娠结局[10],主要源于其胎盘血管吻合引起的并发症,如双胎输血综合征等。所有双合子双胎均为双绒毛膜,而单合子双胎根据胚芽分裂的时间不同可以是双绒毛膜性(约占33%)或单绒毛膜性(约占66%)[11]。绒毛膜性可以通过超声确定,但是合子性并不能完全通过绒毛膜性来推断确定。同性别的双绒毛膜双胎,通过分子遗传学技术(微卫星或单核酸多态性等技术)可确定其合子性质[12]。
2 双胎产前筛查
2.1 基于母亲年龄、合子和绒毛膜性估算双胎染色体非整倍体风险值 总体而言,双胎妊娠胎儿染色体非整倍体的发生率高于单胎妊娠,主要源于孕妇高龄。单绒毛膜双胎发生结构异常的风险明显增高,包括胎儿心脏缺陷、神经管和大脑缺陷、唇裂、胃肠和前腹壁缺陷等,但是发生非整倍体的风险与单胎妊娠相似。由于唐氏综合征风险值的计算需要整合复杂的实际和伦理问题,使得双胎或多胎妊娠风险值的调整变得非常复杂。合子性质决定了2类双胎有不同的产前筛查风险值计算方法,不论双胎的染色体异常是否一致。单合子双胎妊娠,两胎儿应同时为患儿或同为正常胎儿,特殊情况下亦可见单合子双胎染色体核型不一致。但在双合子双胎中,每个胎儿都有独立患染色体非整倍体的风险。有学者建议修正双胎妊娠传统推荐的行介入性产前诊断的孕妇年龄界限。Rodis等[13]提出公式来计算双合子双胎或单合子双胎中单胎或双胎可能患染色体非整倍体的几率,从中计算获得的图表曾被用于判断年龄相关的胎儿非整倍体风险。单合子双胎比率固定为3.5/1000。该作者断定一个31岁的双胎妊娠(合子性不详)的孕妇与一个35岁的单胎妊娠孕妇胎儿患非整倍体风险是一样的。于是,他们总结得出所有≥31岁的双胎妊娠孕妇均应建议行介入性产前诊断。基于以下4个理由,该近似值不宜再运用:①双胎介入性产前诊断手术相关的风险比单胎更高,而且单胎的介入性产前诊断也应该权衡相关的胎儿丢失率;②该近似值在单绒毛膜双胎中并不适用,因单绒毛膜双胎染色体非整倍体的风险与单胎相似。单合子双胎在双胎中的发生率难以确定,特别是辅助生育技术获得的双胎;③加拿大指南已不建议将35岁作为单胎介入性产前诊断的年龄临界值[14];④双胎妊娠中唐氏综合征的实际发生率低于理论的风险评估值[15],即使是双绒毛膜双胎,也并非是单胎的2倍。遗憾的是,目前并无大样本的研究对双绒毛膜双胎中唐氏综合征发生率进行准确评估,大部分的研究仅限于统计建模。
2.2 NT测量的价值 NT检测范围在双胎与单胎中没有明显差异[16-18],多胎妊娠中唐氏综合征检出率与单胎相似。NT可单独计算每一个胎儿的风险。因此,NT测量结合母亲年龄已作为双胎妊娠染色体非整倍体筛查的方案。绒毛膜性质与合子性质均可影响双胎唐氏综合征的风险评估。单绒毛膜双胎中,每一个胎儿均有相同的机会患唐氏综合征,故总的风险与单胎相似。因此,可用目前发布的单胎NT参考值来计算单个风险从而评估妊娠的总风险。双绒毛膜双胎中每个胎儿被认为是独立的,各个胎儿的风险可运用单胎NT测量的中位数进行计算的。头臀长C R L用于计算胎龄。这种方法将增加双绒毛膜单合子双胎的假阳性。计算妊娠特定风险更为恰当。
运用早孕NT结合母亲年龄,Sebire团队[20,21]计算了448例双胎妊娠中各个胎儿的唐氏综合征特定风险。在假阳性率为7.3%时,其检出率为88%。重要的是,单绒毛膜双胎NT增厚的发生率高于双绒毛膜双胎(8.4%vs 5.4%),原因在于单绒毛膜双胎中NT增厚可能是双胎输血综合征(TTTS)等疾病的早期表现。因此,在运用NT计算单绒毛膜双胎染色体非整倍体风险时,应进行调整。在一个769例单绒毛膜双胎的研究中,Vandecruys等[22]发现,最好的筛查效能是运用双胎的NT平均值而非最小值或最大值。运用NT平均值对单绒毛膜双胎进行检测,在假阳性率为4.2%时,其预测灵敏度为100%,这也是目前英国胎儿基金会推荐的方法[23]。在双绒毛膜双胎,各个胎儿的检出率及假阳性率与单胎相似。NT结合母亲年龄的筛查在双胎妊娠中,NT结合母亲年龄进行筛查可达到2007年S O G C指南的标准,即在假阳性率为5.0%时,其检出率达到75%。然而,目前并没有大样本的研究以支持这些结果。
2.3 NT结合血清学指标 少有文献研究早孕游离β-hC G及P A PP-A对双胎的筛查价值[19,24-27]。在一项1914例双胎的研究中,Spencer等[26]调查绒毛膜性质在早孕血清学标志物中的影响,发现双胎妊娠需要对计算的中位数倍数进行调整。一般来讲,游离β-hC G校正的中位数,是观察到的中位数除以2.023。对于P A PP-A,需分2种不同的情况:在双绒毛膜双胎,除以2.192,而单绒毛膜双胎,除以1.788。Spencer和Nicolaides[27]报道运用NT结合早孕血清学标志物对206例双胎妊娠进行筛查,唐氏综合征的检出率为75%,假阳性率为9%,其中包括了4例双胎一胎为唐氏综合征。其检出率与NT结合母亲年龄的检出率相似。W ald等[19]的研究发现,在假阳性率均为5%时,单独运用NT及运用NT结合早孕血清学标志物在单绒毛膜双胎中的检出率分别为73%和84%;在双绒毛膜双胎分别68%和70%;在总的双胎妊娠分别为69%和72%。与单胎妊娠相似,NT结合早孕血清学标志物可提高双胎妊娠特别是单绒毛膜双胎的检出率。然而,在给出确切的建议前,尚需大样本的多胎妊娠早孕血清学联合筛查的前瞻性研究。
双胎妊娠早、中孕血清学检查结合NT的整合筛查模式研究同样重要。与中孕血清学筛查相似,早孕多胎妊娠血清学筛查备受争议,因为双胎中异常胎的血清学水平将受正常胎的干扰。另一方面,辅助生殖对早孕血清学的影响,也需要进一步的评估。
2.4 母体血清学筛查 母体血清学方法用于双胎筛查仍面临很多的困难和疑惑。首先,血清学标志物水平并非确切地为单胎的2倍。由于阳性病例及对照病例较少,在不同的研究中,其参考值变化范围较大[15,28-33]。双胎唐氏综合征血清标志物的参考范围无法准确计算,从而提出“假设风险”而非基于大样本研究[32]。其次,血清标志物的水平与整个妊娠相关,而超声的指标,如NT,是每个胎儿特异的。第三,合子性质与绒毛膜性质在风险评估中的意义与它们在NT筛查中类似。
在一个273例双胎中孕血清学筛查的前瞻性研究中,假阳性率为5%[34]。该研究中没有出现唐氏综合征的病例,故无法评估灵敏度。利用统计学模型,作者推算在假阳性率为5%时,单合子双胎和合子双胎中唐氏儿的检出率分别为73%和43%,总体检出率为53%。在另一个多胎中孕期血清学筛查的研究中,Spencer等[35]评估了420例双胎及19例三胎的游离β-hC G及A FP水平,标志物的水平在双胎中高达2倍,并检出8对双胎之一为唐氏综合征。作者估计,运用“假设风险”,双胎妊娠中唐氏综合征的检出率及假阳性率分别为51%及5%。M uller等[30]对3292例行中孕血清学唐氏综合征筛查的双胎进行评估,共有4例病例双胎均为唐氏综合征胎儿,而其余7例病例为双胎之一为唐氏综合征。平均A FP水平在单绒毛膜双胎与双绒毛膜双胎中相似,而游离β-hC G在单绒毛膜双胎中较高。单独使用母亲年龄,唐氏综合征的检出率及筛查阳性率分别为27.3%及6.6%;使用母亲年龄结合绒毛膜性质,其检出率及筛查阳性率分别为54.5%及24.6%;运用测量的A FP值及游离β-hC G值除以2,其检出率及筛查阳性率分别为54.5%及7.75%;运用全球双胎妊娠人群观察到的中位数,其检出率及筛查阳性率分别为54.5%及8.05%;运用针对单绒毛膜双胎和双绒毛膜双胎的中位数,其检出率及筛查阳性率成分别为54.5%及7.75%。该作者得出中孕血清学筛查双胎唐氏综合征优于单独根据母亲年龄进行筛查。最近,在一项迄今规模最大的双胎中孕血清学筛查(二联筛查)研究中,法国的团队研究了11 040例双胎,其中包括27例唐氏综合征[29]。对照组包括了64 815例单胎,其中86例为唐氏综合征。使用1/250为诊断临界值,双胎唐氏综合征的总体检出率为63%(17/27,95%CI 44.8%~81.2%),该研究中30.3%的孕妇年龄大于35岁。在单胎中,唐氏综合征地检出率为74.4%(64/84,95%CI 65.2%~83.6%);双胎均为唐氏综合征时,检出率为71%;一胎为唐氏综合征时,检出率为60%(较单胎降低约15个百分点);双胎筛查的假阳性率较高,为10.8%。
在另一项研究中,M ay m on等[36]比较了60例双胎及120例单胎早孕NT测量与中孕血清学三联筛查(A FP,β-hC G,及uE3)的结果,发现NT测量的筛查假阳性率明显低于中孕血清学三联筛查(双胎5%vs 15%;单胎2.5%vs.6%)。双胎中孕血清学筛查假阳性率较高,导致了18.3%的羊膜腔穿刺率,而单胎仅为7.5%。因此,多胎妊娠中,建议使用早孕NT测量联合母亲年龄进行筛查。仅当NT测量无法实施或由于双胎妊娠诊断过晚(大于14周)而错过了NT测量的时机,可以考虑中孕血清学筛查。
2.5 整合筛查 对于单胎,结合早孕及中孕筛查的优点可施行整合筛查[37]。这种NT测量结合早孕、中孕血清学筛查方法得到了大规模前瞻性研究的确认,整合筛查检出率高且假阳性率低[38]。目前尚未有双胎整合筛查的前瞻性研究。W ald和Rish[32]基于大量假设的计算,已发表双胎整合筛查的评估:在5%假阳性率时,单绒毛膜双胎中唐氏综合征患儿检出率为93%,双绒毛膜双胎中检出率为78%,双胎总检出率为80%。
2.6 双胎中孕超声非整倍体筛查 尽管妊娠中期遗传学超声用以筛查单胎唐氏综合征已得到充分的研究,但很少证据评估该方法筛查双胎的准确性[39]。一般来说,双胎的研究数据亦是结合单胎的。用外推法评估针对双胎的筛查效能是无法实行的。在一项研究中,软指标不一致用于筛查双胎之一唐氏综合征。NT能准确筛查9例唐氏综合征中的5例,其他的软指标筛查效果较差[40]。目前,该研究尚不足以推荐或反对超声软指标用以筛查双胎非整倍体。评估超声软指标在双胎筛查中的作用,需要进一步的前瞻性研究[6]。
3 双胎介入性产前诊断
进行介入性产前诊断的多胎妊娠孕妇需要非指向性咨询。他们可能是不孕行辅助生殖技术或自然受孕,夫妻的态度与抉择也会相差甚远[43]。这个讨论的内容需要包括可供选择的方案、各个方案的优点与风险。咨询时需要告知双胎自然流产的背景风险是6%~7%[44]。所有的双胎,特别是双绒毛膜双胎,应充分告知核型不一致可能及可选择的方案[]。
3.1 多胎妊娠介入性产前诊断的共同点 多胎妊娠行介入性产前诊断前需进行全面的超声评估,应尽可能确定绒毛膜性质,每一个胎儿的外观和位置应该正确地确定及标示。应使用文档和(或)图像准确地评估与记录羊膜腔、胎儿、胎盘、脐带插入的位置和胎儿性别[45]以便确认样本属于哪一个胎儿。分子遗传学进行合子鉴定在复杂的多胎妊娠和超声无法确定绒毛膜性质时是有帮助的。
3.2 羊膜腔穿刺 尽管尚未有针对双胎早期行羊膜腔穿刺的大样本研究,一般来讲,由于单胎早期穿刺有较高的风险,羊膜腔穿刺多在15周或15周之后进行[48]。
3.2.1 羊膜腔穿刺的方法 羊膜腔穿刺有3种方法,但未有随机研究进行比较。①双穿刺法:最常见的方法是在超声定位下,用2个穿刺针分别在隔膜两侧两个穿刺位点进行连续穿刺。在加拿大一个中心260例双胎的研究中,未使用染料滴入第一个羊膜腔时,2次穿刺为同一羊膜腔的风险为1.8%[49]。胎儿性别与核型的相关性有利于识别取样误差(例如,核型结果提示相同性别,而超声显示不同性别)。染料用于判断羊水样本是否来自同一羊膜腔。利于这种技术,在第一个羊膜腔穿刺后,将染料注入穿刺的羊膜腔,当第二次穿刺时,如果染料存在,应警惕羊水来自第一个羊膜腔,可以移动穿刺位点,直到抽未染色的羊水。最早使用的染料是亚甲蓝,但可能引起肠闭锁及胎儿死亡限制了其运用[50-54]。后来使用了靛蓝,并未有报道其先天异常超过预期的背景风险[55,56]。但至少有4例宫内暴露于该染料的胎儿出现空肠闭锁[53,56,57]。尽管并不确定该发病率是否高于一般人群,许多的操作者仅于超声可视性差或胎数较多时使用染料[46,58,59]。②单穿刺法:此法在超声介导下,穿刺针插入靠近隔膜的位置[60-64]。从第一个羊膜腔取样,在超声介导下,穿刺针移动通过羊膜进入第二个羊膜腔。弃去开始的1~2 ml羊水,以减少第一个羊膜腔的污染,再进行第二个羊膜腔取样。该技术挑战是进入第二个羊膜腔困难和受到第一个羊膜腔的污染[58],以及有可能制造医源性单羊膜[65]。尽管在2项77例的研究中,并未遇到这些问题,该技术并未得到广泛的认可[58]。③同步的可视化法:此法是超声同步可视下用一个穿刺针插入隔膜两侧的羊膜囊[66]。尽管具有记录隔膜2次同步取样的优点,由于在临床上难以达到同步,并缺少清晰记录,该技术使用较少[58]。
3.2.2 单绒毛膜双胎取样数 单绒毛膜双胎应行一胎或两胎取样存在争议。针对不少案例报道,单绒毛膜双胎核型不一致及妊娠晚期难以判断单绒毛膜双胎,许多学者建议2个羊膜腔取样,特别是双胎不同畸形、NT不一致、生长不一致或14周前未确定绒毛膜性质时更应双羊膜囊取样。
3.2.3 妊娠或胎儿丢失率 羊膜腔穿刺术后的妊娠或胎儿丢失率应与双胎背景丢失率比较。理想情况下,应考虑绒毛膜性质,因单绒毛膜双胎胎儿丢失率高[11]。近期大部分的研究报道相关的丢失率从0.3%~2.2%[70-73]。加拿大2006年发表的一项回顾性队列研究显示,24周前妊娠丢失率为1/64,即1.6%[71]。当一个双胎妊娠是多胎妊娠减胎后,羊膜腔穿刺与多胎妊娠减胎相比,并未有更高的妊娠丢失风险(总的丢失率为8.1%vs 12.5%,无统计学差异)[74,75]。
3.2.4 穿刺时机 单胎研究提示羊膜腔穿刺不应在15周之前进行,因其可增加先天异常及胎儿丢失的风险。当可能存在双胎核型不一致,若正常胎围产期死亡率及发病率较低,可选择较晚行羊膜腔穿刺。尽管该选择对正常胎儿的好处是显而易见的,也应考虑早产、结果未报前或选择性减胎前分娩及延迟穿刺带来的心理问题的风险。W eisz和Rodeck[58]认为,延迟的羊膜腔穿刺仅在以下情况下使用:22~28周诊断的染色体非整倍体发生风险增高的胎儿异常、早期穿刺易导致流产和严重早产的病例。此种情况建议向母胎医学专家咨询。
3.3 绒毛活检
3.3.1 取样方法 与单胎相比,多胎妊娠绒毛活检复杂性大大提高,包括准确的子宫和胎盘定位(位置及种植点)、各个胎儿的关系,而且必须从每个胎盘份额准确取样[58]。注意膀胱的充盈可明显改变子宫位置,引起胎盘及胎儿位置的改变[76]。一些学者也建议,在绒毛活检的间隔,进行每周一次的超声检查以追踪胎儿的位置。
多胎妊娠绒毛活检可通过经腹及经宫颈途径单独或联合实行[76-82]。分开取样时,需要更换穿刺针。Casals等[77]报道了36例经宫颈行两胎盘取样,尽管随着经验的增加,操作技术也得到提高,仍有15例因各种原因结果无法确认而需重复进行羊膜腔穿刺[77]。在单绒毛膜双胎,无特殊情况下,尽管存在核型不一致的少许风险,仍建议一次取样。
3.3.2 妊娠或胎儿丢失率 双胎绒毛活检后妊娠丢失率较难估计,报道为2.02%~2.2%,相当于5次羊膜腔穿刺[58]。接受绒毛活检的人群其妊娠总丢失率与对照组相似[58]。在回顾4组接受绒毛活检的614例双胎中,22周前总妊娠丢失率为3.1%,总体丢失率(分娩前)为4.8%[78-82]。
3.3.3 绒毛活检的误差 核型结果性别相同而双胎出生性别不同,可以认为是绒毛活检存在取样误差的原因。之前报道双胎绒毛活检该误差率接近6%,最新的报道为2%~4%[45,59,80,81,83]。荧光原位杂交(FISH)技术发生胎儿诊断误差更常见(接近11.5%)[83]。为了减少取样误差,Jenkins和W apner[45]建议采用经腹结合经宫颈取样的方法,于胎盘插入处取样,避免穿破隔膜。经过这些改进,取样污染的风险约为3%~4%[58]。
3.4 选择绒毛活检还是羊膜腔穿刺 较多学者认为选择性减胎越早,妊娠丢失相关风险越低。因此,早期诊断及早期终止妊娠是绒毛活检的优势。然而,对超过13~14周的妊娠,最新的研究并不支持这个观点。
绒毛活检技术难度大,取样误差较高,优势不如羊膜腔穿刺。在一项比较286例羊膜腔穿刺及159例绒毛活检的双胎研究中,van den Berg等[86]报道采用2次穿刺方法,羊膜腔穿刺成功率为99.3%,绒毛活检成功率为99.7%,7例绒毛活检结果不明确(5例由于胎盘嵌合)而在羊膜腔穿刺中未出现此情况。羊膜腔穿刺成功地确认了7例绒毛活检不明确的结果。
仅有两项研究比较了绒毛活检与羊膜腔穿刺妊娠丢失率[59,79]。报道的总丢失率是相似的,绒毛活检相关丢失率为3.2%~4.5%;羊膜腔穿刺相关丢失率为2.9%~4.2%,两项研究均报道0.3%的差异无统计学意义。由于这些研究并非随机而是同时期的群体,且存在患者与操作者选择偏倚,不宜进行概括及等值假设。若由技术熟练,经验丰富的操作者实行,似乎没有哪种方法具有明显优势[58,78]。
4 双胎核型不一致的处理
4.1 初步咨询 与单胎妊娠相似,双胎妊娠患者在面临伴胎儿异常的诊断时,应接受非指向性、无偏倚的信息和咨询。医生应尊重他们的价值观,认可对不同生活质量的看法,并准确告知胎儿异常的短期及远期预后,解答患者的疑问。
4.2 选择性减胎 双胎核型不一致通常发生在双合子双胎,即双绒毛膜双胎,本指南重点关注该情况下双绒毛膜双胎减胎的问题,并未论及单绒毛膜双胎的减胎。减胎应在病人已被充分告知关于胎儿畸形预后、减胎程序和非指向性咨询之后实行。医学遗传学专家及母胎医学专家应对此提供帮助。
4.3 技术方面 必须确定哪一个是染色体异常胎儿。这个过程从介入性操作开始,确定核型不一致时再次评估。诊断后尽快详细回顾介入性操作时的描述及超声评估,诊断不明确时应再次行介入性检测及快速核型诊断[76]。
双绒毛膜双胎的选择性减胎多数使用经腹的方法,以20 G或22 G的穿刺针插入胎儿心脏,注射氯化钾或利多卡因,直至心跳停止,建议至少观察5分钟,有些学者也建议在操作后24~48小时再次检查确认[76]。被减胎儿留于子宫内,随着妊娠的继续,一般在分娩时候随活胎娩出。被减胎可在活胎娩出前几天或几周娩出。在这些情况下,被减胎在宫内的位置低于活胎。Lynch等[87]报道存活胎早产的相对危险度为4.1%(%CI 1.4~12.3)。Berkowitz等[88]统计了早期100例双绒毛膜双胎选择性减胎中3例患者血液凝固参数的改变,结果并无统计学意义。
4.4 妊娠结局 Evans等[89]分析了402例选择性减胎的经验,其总丢失率为8.2%,三胎或三胎以上的妊娠其丢失率最高。双胎选择性减胎的总丢失率为7.9%。然而,一项单中心的200例选择性减胎的研究,报道双绒毛膜双胎减胎后丢失率为2.4%,三胎或四胎为11.1%[90]。未发生胎儿丢失的孕妇,其平均分娩孕周为36~37周,6%的分娩发生在25~28周[89,90]。这些数据与双绒毛膜双胎预后相似,提示选择性减胎对早产率影响较小。
4.5 减胎时机 Evans等[89]报道随着孕周的增加,胎儿丢失率增加(9~12周时为5.4%,13~18周时为8.7%,19~24周为6.8%),但并无统计学差异。Eddleman等[90]报道了相反的趋势,20周之前胎儿丢失率为5.9%,20周之后为1.3%,差异并无统计学意义(P=0.09)。
5 循证及建议
本文章证据的价值采用加拿大预防卫生保健报告中描述的标准来评估(表1)。
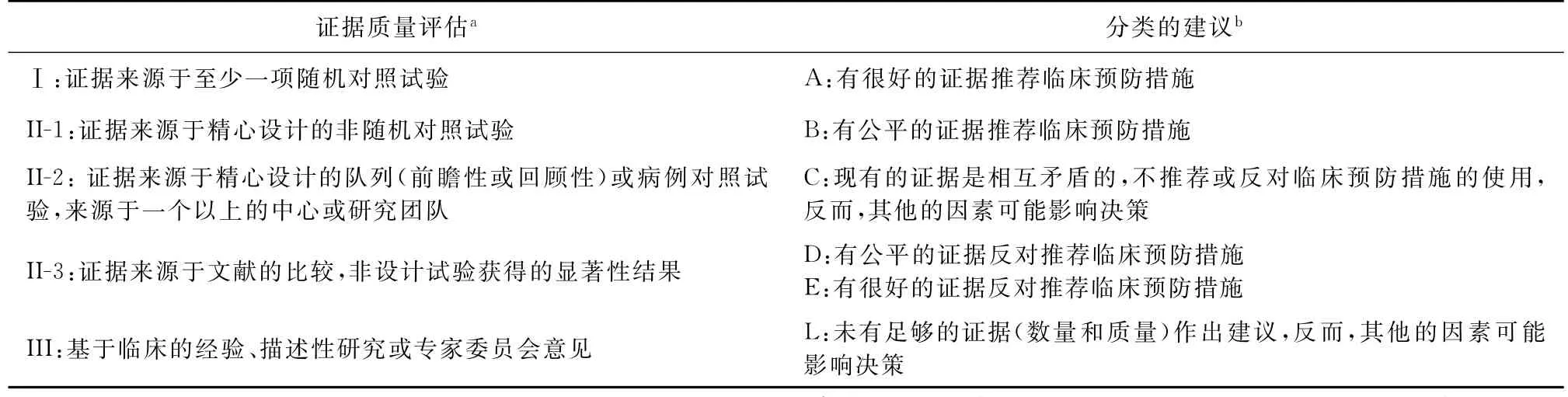
表1 循证及分级建议
5.1 简要概述
5.1.1 胎儿颈项透明层(nuchal translucency,NT)结合母亲年龄是可接受的双胎妊娠早孕期染色体非整倍体筛查方法。(II-2)
5.1.2 双胎妊娠可考虑早孕血清学指标联合NT的联合筛查方法。该方法较NT结合母亲年龄筛查方法可降低假阳性率。(II-3)
5.1.3 早孕血清学指标联合NT及中孕血清学指标的整合筛查方法也双胎筛查的一种选择。但双胎的早、中孕整合筛查方法还没有前瞻性研究证实,仍需要进一步的探讨。(III)
5.1.4 若双胎妊娠需要介入性产前诊断,应提供非指向性的咨询。(III)
5.1.5 在非单绒毛膜多胎妊娠行绒毛活检术时,经腹和经阴途径联合取样或仅经腹取样可降低取样错误的似然比。(II-2)
5.2 建议
5.2.1 经知情同意后,应该对所有加拿大孕妇(不论年龄)提供一种产前筛查主要胎儿染色体非整倍体的方法。除此之外,还应提供中孕超声检查,以评估胎儿有无结构畸形并对多胎妊娠作出评估。(I-A)
5.2.2 咨询必须是非指向性的,对于提供的部分或者所有的检查或在就诊过程中提供的任何意见,孕妇均有选择接受或拒绝的权利,应该尊重孕妇的选择。(III-A)
5.2.3 如果可实施双胎染色体非整倍体的产前筛查方法,单纯高龄不应作为双胎妊娠介入性产前诊断的指征(II-2 A)。
5.2.4 如果无法实现的话,孕妇年龄35岁及以上应建议行介入性产前诊断。(II-2B)
5.2.5 绒毛膜性对产前筛查结果有重大的影响,所有的双胎均应在孕早期行超声检查确定绒毛膜性。(II-2 A)
5.2.6 采用NT结合母亲年龄筛查时,单绒毛膜双胎应计算出其妊娠特异的风险值,双绒毛膜双胎应计算每个胎儿特异的风险值。(II-3C)
5.2.7 羊膜腔穿刺时,单绒毛膜双胎应行双羊膜囊穿刺,分别抽取双胎羊水样本,除非孕14周前已明确单绒毛膜性且双胎结构和生长发育一致。(II-2B)
5.2.8 介入性检查前或者发现双胎结构发育不一致的情况下,合理咨询后可探讨选择性减胎并提供给可能需要的患者。(II-2B)
5.2.9 双绒毛双胎选择性减胎后无需监测弥散性血管内溶血(disseminated intravascular coagulopathy,DIC)指标。(II-2B)
[1]Public H ealth A gency of Canada.Canadian Perinatal H ealth Report,2008 Edition[R].Ottawa:P H A C,2008.
[2]H all JG.T winning[J].Lancet,2003,362:735-743.
[3]Aston KI,Peterson C M,Carrell D T.M onozygotic twinning associated with assisted reproductive technologies:a review[J].Reproduction,2008,136:377-386.
[4]Blickstein I.Estimation of iatrogenic m onozygotic twinning rate following assisted reproduction:pitfalls anDCaveats[J].A m J Obstet Gynecol,2005,192:365-368.
[5]Blickstein I,Jones C,Keith L G.Zygotic-splitting rates after single-em bryo transfers in in vitro fertilization[J].N Engl J M ed,2003,348:2366-2367.
[6]M orin L,Lim K,S O G C Diagnostic Imaging Co mmittee,et al.Ultrasound for twin pregnancies.S O G C Clinical Practice Guideline No.260,June 2011[J].J O bstet Gynaecol Can,2011,33:643-656.
[7]M achin G A.W hy is itim portanTTo diagnose chorionicity and how do we do it?[J].BesTPract Res Clin O bstet Gynaecol,2004,18:515-530.
[8]Sepulveda W,Sebire NJ,H ughes K,et al.T he la m bda sign at 10-14 weeks of gestation as a predictor of chorionicity iNTwin pregnancies[J].Ultrasound O bstet Gynecol,1996,7:421-423.
[9]Shetty A,S mith A P.T he sonographic diagnosis of chorionicity[J].Prenat Diagn,2005;25:735-739.
[10]Dube J,Dodds L,Armson B A.Does chorionicity or zygosity predict adverse perinatal outco mes iNTwins?[J].A m J O bstet Gynecol 2002;186:579-583.
[11]Sebire NJ,Snijders RJ,H ughes K,et al.T he hiddenm ortality of m onochorionic twin pregnancies[J].Br J O bstet Gynaecol,1997,104:1203-1207.
[12]H annelius U,G herman L,M akela V V,et al.Large-scale zygosity testing using single nucleotide poly m orphisms[J].T win Res H u mgenet,2007,10:604-625.
[13]Rodis JF,Egan JF,Craffey A,et al.Calculated risk of chrom oso mal abnormalities iNTwin gestations[J].O bstet Gynecol,1990,76:1037-1041.
[14]Su mmers A M,Langlois S,W yatTP,et al.Prenatal screening for fetal aneuploidy.S O G CClinical Practice G uideline N o.187,February 2007[J].J O bstet Gynaecol Can,2007,29:146-179.
[15]Cuckle H.Dow n’s syndro me screening iNTwins[J].J M ed Screen,1998,5:3-4.
[16]Cleary-Gold man J,Berkowitz R L.FirsTTrimester screening for Dow n syndro me inm ultiple pregnancy[J].Semin Perinatol,2005,29:395-400.
[17]Cleary-Gold man J,D’Altonm E,Berkowitz R L.Prenatal diagnosis and m ultiple pregnancy[J].Semin Perinatol,2005,29:312-320.
[18]Sebire NJ,Snijders RJ,H ughes K,et al.Screening for trisom y 21 iNTwin pregnancies by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation[J].Br J O bstet Gynaecol,1996,103:999-1003.
[19]W ald NJ,Rish S,H ackshaw A K.Co m bining nuchal translucency and seru mmarkers in prenatal screening for Dow n syndro me iNTwin pregnancies[J].Prenat Diagn,2003,23:588-592.
[20]Sebire NJ,D’Ercole C,H ughes K,et al.Increased nuchal translucency thickness at 10-14 weeks of gestation as a predictor of severe twin-to-twiNTransfusion syndro me[J].Ultrasound O bstet Gynecol,199710:86-89.
[21]Sebire NJ,Souka A,Skentou H,et al.Early prediction of severe twin-to-twiNTransfusion syndro me[J].H u mReprod 2000;15:2008-2010.
[22]Vandecruys H,Faiola S,A uer M,et al.Screening for trisom y 21 inm onochorionic twins by measurement of fetal nuchal translucency thickness[J].UltrasoundO bstetGynecol,2005,25:551-513.
[23]Snijders RJ,T ho m E A,Zachary J M,et al.First-trimester triso m y screening:nuchal translucency measuremenTTraining and quality assurance to correct and unify technique[J].Ultrasound O bstet Gynecol,2002,19:353-359.
[24]Chasen S T,Perni SC,Kalish R B,et al.First-trimester risk assessment for triso mies 21 and 18 iNTwin pregnancy[J].A m J O bstet Gynecol,2007,197:374.e1-e3.
[25]Gonce A,BorrellA,FortunyA,et al.First-trimester screening for triso m y 21 iNTwin pregnancy:does the addition of biochemistry make an im provement?[J].Prenat Diagn,2005,25:1156-1161.
[26]Spencer K,Kagan K O,Nicolaides K H.Screening for trisom y 21 iNTwin pregnancies iNThe firsTTrimester:an update of the im pact of chorionicity onmaternal seru mmarkers[J].Prenat Diagn,2008,28:49-52.
[27]Spencer K,Nicolaides K H.Screening for triso m y 21 iNTwins using firsTTrimester ultrasound and maternal seru m biochemistry in a one-stop clinic:a review of three years experience[J].BJO G,2003,110:276-280.
[28]BersingeRNA,N oble P,Nicolaides K H.First-trimester maternal seru m P A PP-A,SP1 and M-CSF levels in normal and triso mic twin pregnancies[J].Prenat Diagn,2003,23:157-162.
[29]Garchet-Beaudron A,Dreux S,Leporrier N,et al.Secondtrimester Dow n syndro me maternal seru mmarker s creening:a prospective study of 11 040 twin pregnancies[J].Prenat Diagn,2008,28:1105-1109.
[30]M uller F,Dreux S,Dupoizat H,et al.Second-trimester Down syndro me maternal seru m screening iNTwin pregnancies:im pact of chorionicity[J].Prenat Diagn,2003,23:331-335.
[31]Noble PL,Snijders RJ,A braha H D,et al.M aternal seru m free beta-hC GAT 10 to 14 weeks of gestation iNTriso mic twin pregnancies[J].Br J O bstet Gynaecol,1997,104:741-743.
[32]W ald NJ,Rish S.Prenatal screening for Dow n syndro me and neural tube defects iNTwin pregnancies[J].Prenat Diagn,2005,25:740-745.
[33]W att H C,W ald NJ,George L.M aternal seru m inhibin-A levels iNTwin pregnancies:im plications for screening for Down’s syndro me[J].Prenat Diagn,1996,16:927-929.
[34]Neveux L M,Palo maki G E,K night GJ,et al.M ultiple marker screening for Dow n syndro me iNTwin pregnancies[J].Prenat Diagn,1996,16:29-34.
[35]Spencer K,Salonen R,M uller F.Dow n’s syndro me screening inm ultiple pregnancies using alpha-fetoprotein and free beta hC G[J].Prenat Diagn,1994,14:537-542.
[36]May mon R,Dreazen E,Rozinsky S,et al.Co m parison of nuchal translucency measurement and second-trimester triple seru m screening iNTwin versus singleton pregnancies[J].Prenat Diagn,1999,19:727-931.
[37]Wald NJ,Watt HC,H ackshaw A K.Integrated screening for Down’s syndro me oNThe basis of tests performed during the first and second trimesters[J].N Engl J M ed,1999,341:461-467.
[38]Malone F D,Canick JA,Ball R H,et al.First-trimester or second-trimester screening,or both,for Down’s syndro me[J].N Engl J M ed,2005,353:2001-2011.
[39]Bush MC,M alone F D.Dow n syndro me screening iNTwins[J].Clin Perinatol,2005,32:373-386.
[40]Lynch L,Berkowitz G S,Chitkara U,et al.Ultrasound detection of Dow n syndro me:is it really possible?[J].O bstet Gynecol,1989,73:267-270.
[41]Spencer K.Screening for triso m y 21 iNTwin pregnancies iNThe firsTTrimester using free beta-hC G and P A PP-A,co mbined with fetal nuchal translucency thickness[J].Prenat Diagn,2000,20:91-95.
[42]May mon R,Jauniaux E,H olmes A,et al.N uchal translucency measurement and pregnancy outco me after assisteDConception versus spontaneously conceived twins[J].H u m Reprod,2001,16:1999-2004.
[43]Geipel A,Berg C,Katalinic A,et al.DifferenTPreferences for prenatal diagnosis in pregnancies following assisted reproduction versus spontaneous conception[J].Reprod Bio med O nline,2003,8:119-124.
[44]Yaron Y,Bryant-Green wood P K,Dave N,et al.M ultifetal pregnancy reductions of triplets to twins:co m parison with nonreduced triplets and twins[J].A m J O bstet Gynecol,1999,180:1268-1271.
[45]Jenkins T M,W apner RJ.T he challenge of prenatal diagnosis iNTwin pregnancies[J].Curr O pin O bstet Gynecol,2000,12:87-92.
[46]Taylor M J,Fisk nm.Prenatal diagnosis inm ultiple pregnancy[J].Baillieres BesTPract Res Clin O bstet Gynaecol,2000,14:663-675.
[47]Levy R,Mirlesse V,Jacquemard F,et al.Prenatal diagnosis of zygosity by fetal DNA analysis,a contributioNTo the management of m ultiple pregnancies.A series of 31 cases[J].Fetal DiagNT her,2002,17:339-342.
[48]T he Canadian Early and Mid-trimester A m niocentesis Trial(C E M A T)Group.Rando mised trialto assess safety and fetal outco me of early and midtrimester a m niocentesis[J].Lancet,1998,351:242-247.
[49]M F Delisle,L Brosseuk,R D Wilson.A m niocentesis for twin pregnancies:is alpha-fetoprotein usefulin confirming thaTThe two sacs were sam pled?[J].Fetal DiagNT her,2007,22:221-225.
[50]Kidd S A,Lancaster P A,A nderson JC,et al.A cohort study of pregnancy outco me after a m niocentesis iNTwin pregnancy[J].Paediatr Perinat Epidemiol,1997,11:200-213.
[51]W apner RJ.Genetic diagnosis inm ultiple pregnancies[J].Sem Perinatol,1995,5:361-362.
[52]Kidd S A,Lancaster P A L,A nderson JC.Fetal death after exposure to methylene blue dye during mid-trimester a m niocentesis iNTwin pregnancy[J].Prenat Diagn,1996,16:39-47.
[53]van der Pol JG,W olf H,Boes K,Treffers P E,et al.Jejunal atresia related to the use of methylene blue in genetic a m niocentesis iNTwins[J].Br J O bstet Gynaecol,1992,99:141-143.
[54]MCFadyen I.T he dangers of intra-a m niotic methylene blue[J].Br J Obstet Gynaecol,1992,99:89-90.
[55]Cragan JD,M artinm L,K houry M J,et al.Dye use during am niocentesis and birth defects[J].Lancet,1993,341:1352.
[56]Prugg mayer M R,Jahoda mg,van der Pol JG,et al.Genetic am niocentesis iNTwin pregnancies:Resultsof a m ulticenter study of 529 cases[J].Ultrasound O bstet Gynecol,1992,2:6-10.
[57]Brandenburg H.T he use of synthetic dyes for identification of the am niotic sacs inm ultiple pregnancies[J].Prenat Diagn,1997,17:281-282.
[58]W eisz B,Rodeck C.Invasive diagnostic procedures iNTwin pregnancies[J].Prenat Diagn,2005,25:751-758.
[59]A ntsaklis A,Souka A P,Daskalakis G,et al.Secondtrimester am niocentesis vs.chorionic villus sa m pling for prenatal diagnosis inm ultiple gestations[J].Ultrasound O bstet Gynecol,2002,20:476-481.
[60]Jeanty P,Shah D,Roussis P.Single-needle insertion iNTwin am niocentesis[J].J Ultrasound M ed,1990,9:511-517.
[61]Buscaglia M,G hisoni L,Bellotti M,et al.Genetic am niocentesis in biam niotic twin pregnancies by a single transabdo minalinsertion ofthe needle[J].Prenat Diagn,1995,15:17-19.
[62]van V ugt J M,Nieu wint A,van Geijn H P.Single-needle insertion:an alternative technique for early second-trimester genetic twin am niocentesis[J].Fetal DiagNT her,1995,10:178-181.
[63]Cirigliano V,Cañadas P,Plaja A,et al.Rapid prenatal diagnosis of aneuploidies and zygosity inm ultiple pregnancies by am niocentesis with single insertion ofthe needle and quantitative fluorescenTPCR[J].Prenat Diagn,2003,23:629-633.
[64]Sebire NJ,Noble PL,Odibo A,et al.Single uterine entry for genetic am niocentesis iNTwin pregnancies[J].Ultrasound Obstet Gynecol,1996,7:26-31.
[65]M egory E,W einer E,Shalev E,et al.Pseudo m onoa m niotic twins with cord entanglement following genetic funipuncture[J].Obstet Gynecol,1991,78:915-917.
[66]Bahado-Singh R,Sch mitt R,H obbins JC.New technique for genetic am niocentesis iNTwins[J].O bstet Gynecol,1992,79:304-307.
[67]Sch mid O,Trautmann U,Ashour H,et al.Prenatal diagnosis of heterokaryotypic m osaic twins discordant for fetal sex[J].Prenat Diagn,2000,20:999-1003.
[68]Shalev S A,Shalev E,Pras E,et al.Evidence for blooDChimerism in dizygotic spontaneous twin pregnancy discordant for Down syndro me[J].Prenat Diagn,2006,26:782-784.
[69]Cleary-Gold man J,D’Altonm E,Berkowitz R L.Prenatal diagnosis and m ultiple pregnancy[J].Semin Perinatol,2005,29:312-320.
[70]Cahill A G,M acones G A,Sta milio D M,et al.Pregnancy loss rate after mid-trimester a m niocentesis iNTwin pregnancies[J].A m J O bstet Gynecol,2009,200:257.e1-e6.
[71]Millaire M,Bujold E,M orency A M,et al.Mid-trimester genetic a m niocentesisiNTwin pregnancy and the risk offetalloss[J].J O bstet Gynaecol Can,2006,28:512-518.
[72]G hidini A,Lynch L,Hicks C,et al.T he risk of secondtrimester a m niocentesis iNTwin gestations:a case-control study[J].A m J O bstet Gynecol,1993,169:1013-1016.
[73]Y ukobowich E,A nteby E Y,Cohen S M,et al.Risk of fetal loss iNTwin pregnancies undergoing second trimester a m niocentesis[J].O bstet Gynecol,2001,98:231-234.
[74]MCLean L K,Evans M I,Carpenter RJ Jr,et al.Genetic a mniocentesis following m ultifetal pregnancy reduction does not increase the risk of pregnancy loss[J].Prenat Diagn,1998,18:186-188.
[75]Stephen JA,Tim or-Tritsch IE,Lerner JP,et al.A m niocentesis after m ultifetal pregnancy reduction:isit safe?[J].A m J O bstet Gynecol,2000,182:962-965.
[76]Rochonm,Stone J.Invasive procedures inm ultiple gestations[J].Curr O pin O bstet Gynecol,2003,15:167-175.
[77]Casals G,Borrell A,M artinez J M,et al.Transcervical chorionic villus sa m pling inm ultiple pregnancies using a biopsy forceps[J].Prenat Diagn,2002,22:260-265.
[78]A ppelman Z,Furman B.Invasive genetic diagnosis inm ultiple pregnancies[J].O bstet Gynecol Clin N A m,2005,32:97-103.
[79]W apner RJ,Johnson A,Davis G,et al.Prenatal diagnosisiNTwin gestations:a co m parison between second-trimester a mniocentesis and first-trimester chorionic villus sa m pling[J].O bstet Gynecol,1993,82:49-56.
[80]Bra m bati B,Terzian E,Tognoni G.Rando mizeDClinicaltrial of transabdo minal versus transcervical chorionic villus sa mpling methods[J].Prenat Diagn,1991,11:285-293.
[81]Perga ment E,Schulman JD,Copeland K,et al.T he risk and efficacy of chorionic villus sa m pling inm ultiple gestations[J].Prenat Diagn,1992,12:377-384.
[82]De Catte L,Liebaers I,Foulon W.O utco me of twin gesta-tions after firsTTrimester chorionic villus sam pling[J].O bstet Gynecol,2000,96:714-720.
[83]Fiddler M,FredericksonMC,Chen P X,et al.Assessment of fetal status inm ultiple gestation pregnancies using interphase FISH[J].Prenat Diagn,2001,21:196-199.
[84]Evans M,Ciorica D,Britt D W,et al.U pdate on selective reduction[J].Prenat Diagn,2005,25:807-813.
[85]Brandenburg H,van der M eulen J H,Jahoda mg,et al.A quantitative estimation of the effect of prenatal diagnosis in dizygotic twin pregnanciesin wo men of advanced maternal age[J].Prenat Diagn,1994,14:243-256.
[86]van den Berg C,Braat A P G,Van O pstal D,et al.A m niocentesis or chorionic villus sa m pling inm ultiple gestations?Experience with 500 cases[J].Prenat Diagn,1999,19:234-244.
[87]Lynch L,Berkowitz R L,Stone J,et al.Preterm delivery after selective termination iNTwin pregnancies[J].O bstet Gynecol,1996,87:366-369.
[88]Berkowitz R L,Stone J,Eddleman K A.O ne hundreDConsecutive cases of selective termination of an abnormal fetus in a m ultifetal gestation[J].O bstet Gynecol,1997,90:606-610.
[89]Evans M I,Goldberg JD,H orenstein J,et al.Selective termination for structural,chro m oso mal,and mendelian ano malies:international experience[J].A mJ Obstet Gynecol,1999,181:893-897.
[90]Eddleman K A,Stone JL,Lynch L,et al.Selective termination of ano malous fetuses inm ultifetal pregnancies:two hundreDCases at a single center[J].A m J O bstet Gynecol,2002,187:1168-1172.
[91]W oolf S H,Battista R N,A ngersonG M,et al.CanadiaNTask Force on Preventive H ealth Care.New grades for reco mmendations fro m the CanadiaNTask Force on Preventive H ealth Care[J].CMAJ,2003,169:207-208.
石晓梅 摘译周祎校
本刊对照片及图像的要求
照(图)片每3张图单独占1页,集中附于文后,分别按其在正文中出现的先后次序连续编码。每张照(图)片均应有必要的图题及说明性文字置于图的下方,并在注释中标明图中使用的全部非公知公用的缩写;图中箭头标注应有文字说明。大体标本照片在图内应有尺度标记,病理照片要求注明特殊染色方法和高、中、低倍数。照片要求有良好的清晰度和对比度,并在背面标明图号、作者姓名及图的上下方向。说明文字应简短,不应超过50字,所有的图在文中相应部分应提及。电子图片采用jpg格式,分辨率不低于300像素/英寸,并应经过剪切后充分显示关键部分。
动态图像分别按其在正文中出现的先后次序连续编码,文中应标记为“动态图×”。视频资料要求图像清晰稳定,剪接顺畅,保持可能获得的最高清晰度模式,视频文件采用A VI格式,大小在5 M以内。每个文件名均应与文中的名称相符,如“动态图×”。
中国产前诊断杂志(电子版)编辑部
该临床实践指南由加拿大妇产科遗传委员会和加拿大大学医学遗传产前诊断委员会拟定,并由加拿大妇产科执行委员会及加拿大大学医学遗传董事会批准。主要作者为François A udibert、Alain Gagnon、SO G C遗传委员会成员和C C mg产前诊断委员会成员。

