奥曲肽对结肠癌SW480细胞Wnt通路β-catenin/TCF及下游靶基因表达的影响
肖忠盛, 王 松, 梁庆模, 龙建武, 李 卫
2012年卫生部发布的“2003至2007年中国结直肠癌发病与死亡分析”显示我国结肠癌发病率和死亡率高于世界平均水平和发展中国家水平,还指出中国结肠癌发病率和死亡率呈上升趋势。积极探寻安全、经济、有效的治疗结肠癌的化疗药尤为重要[1]。生长抑素类似物奥曲肽可通过下调Wnt/βcatenin通路,从而抑制结肠癌细胞的增殖,诱导细胞凋亡及使细胞停滞在G1期,而奥曲肽如何通过激活通路信号,改变重要靶基因尚需进一步探讨[2-3]。本研究通过分析奥曲肽对Wnt/β-catenin通路核心分子β-catenin、下游“联姻分子”TCF-4及靶基因 C-myc、CyclinD1的影响,探讨奥曲肽抑制Wnt/β-catenin通路的作用机制。
1 材料和方法
1.1 细胞及试剂
人结肠癌细胞株SW480购自上海中科院细胞库。醋酸奥曲肽购自诺华制药公司。RPMI-1640培养基购自美国Gibco公司。DMSO、MTT为美国Sigma公司产品。胰蛋白酶系美国Amresco公司研发。牛血清系杭州四季青公司研发。BCA蛋白定量试剂盒、Western Blot BeyoECL Plus发光试剂、考马斯亮蓝、预染分子量标准蛋白质均购自江苏碧云天生物技术研究所。β-actin单抗为美国Santa Cruz生物公司产品。羊抗人β-catenin多抗、兔抗人CyclinD1单抗、兔抗人C-myc单抗为ABZOOM公司产品。兔抗人TCF-4单抗为美国EPITOMICS公司产品。辣根过氧化物酶标记的羊抗兔IgG、辣根过氧化物酶标记的兔抗山羊IgG为美国Jackson Immuno Reasearch公司产品。PVDF膜为美国Millipore公司产品。过硫酸胺(APS)、十二烷基硫酸钠(SDS)、甲叉双丙烯酰胺、丙烯酰胺(acrylamide)、四甲基乙二胺(TEMED)、三羟基甲基氨基甲烷(Tris)、蛋白酶抑制剂(PMSF)、甘氨酸溴酚蓝均为上海生物工程公司产品。
1.2 方法
1.2.1 MTT法检测奥曲肽对SW480细胞的增殖抑制作用 处理组以奥曲肽干预,设置浓度分别为10-12M、10-11M、10-10M、10-9M、10-8M、10-7M及10-6M共7个亚组;对照组为空白细胞加生理盐水干预。结肠癌SW480细胞处于对数生长期,经0.25%胰酶消化处理制成细胞悬浮液,接种于96孔培养板中,每孔加入细胞悬液180 μL,每孔细胞数为6×103个,置饱和湿度恒温细胞培养箱中培养(温度为37℃、CO2体积分数为5%)。培养6 h细胞贴壁后,加入20 μL生理盐水或者不同浓度奥曲肽,继续置于培养箱中培养24、48、72 h,于培养结束前4 h在培养板中每孔加入20 μL的MTT液(5 g·L-1)。吸去上层培养基,每孔加入100 μL二甲基亚砜,震荡10 min待紫蓝色沉淀充分溶解后,酶标仪在570 nm波长测吸光度值(A值)。计算抑制率,抑制率=(1-处理组A值/对照组A值)×100%。以上每组设4个平行孔,实验重复3遍。
1.2.2 Western blot测定 β-catenin、TCF-4、C-myc、CyclinD1蛋白的表达 取对数生长期的SW480细胞,以2×108/L的密度接种于100 mL培养瓶中,每瓶1 mL,再加完全培养基4 mL,在温度为37℃、CO2体积分数为5%、饱和湿度的培养箱中培养。培养24 h,弃去培养基,用PBS洗2遍,每瓶加入5 mL不含小牛血清的RPMI-1640培养液,同步化24 h后,每瓶分别加入奥曲肽使终浓度为10-6M、10-8M、10-10M,培养48 h。提取细胞核内的蛋白,BCA测蛋白浓度并定量。Western blot法:制备 SDSPAGE凝胶,用蒸馏水冲洗上样孔;测定蛋白含量,计算并调整样品浓度,加入2×SDS凝胶上样缓冲液,将样品于沸水中煮5 min使蛋白变性,加足够电泳液后开始上样,用微量移液器贴壁吸取样品,将加样器针头插入加样孔内,加入样品,每孔上样40 μg蛋白;取28 mA恒流进行电泳,电泳约30 min后待样品溴酚蓝行至分离胶、积层胶界面,再以120 V恒压、约1.5 h行分离胶电泳;将凝胶中蛋白电转移至PVDF膜上(预先用甲醇处理),温度为4℃,恒流105 mA,3h;5%脱脂奶粉封闭室温下2 h;4℃孵育一抗(β-catenin羊多克隆抗体、TCF-4兔单克隆抗体、CyclinD1兔单克隆抗体、C-myc兔单克隆抗体,以抗体稀释液稀释,浓度依抗体而定)每次孵育一种抗体过夜,TBST液洗膜3次,每次约5 min;室温下二抗(1∶5 000)孵育1 h,TBST液洗膜3次,每次约5 min;于暗室中加入Western Blot发光试剂约1 min,X片曝光、显影、定影,胶片扫描后采用AlphaImagerTM2200软件测定印迹区带的灰度面积值。每一种蛋白的Western blot实验均重复3遍。
1.3 统计学方法
所有数据采用SPSS 13.0软件进行统计学处理,实验数据以平均值)±标准差 (s)表示,处理组与对照组比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为有统计学意义。
2 结果
2.1 奥曲肽对SW480细胞的增殖的抑制作用
奥曲肽对SW480细胞增殖的抑制作用结果见表1、图 1。结果提示浓度为 10-10M、10-9M、10-8M、10-7M及10-6M的奥曲肽可抑制SW480细胞的增殖,且在一定浓度范围(10-10M~10-8M)内对SW480细胞的增殖抑制作用呈浓度依赖性,但奥曲肽浓度在10-8M及以上时,并不提高抑制效果。奥曲肽作用于SW480细胞在48 h内细胞的增殖抑制作用呈时间依赖性,且在48 h时间点对细胞增殖抑制作用最强,超过48 h后抑制作用不再随着时间延长而增强。
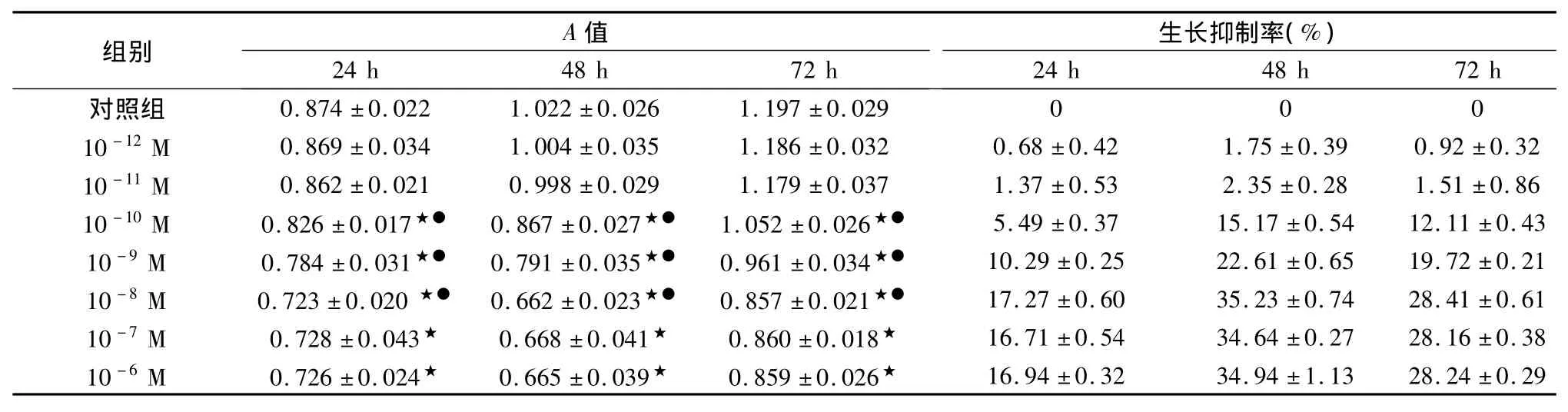
表1 奥曲肽对结肠癌SW480细胞生长抑制作用
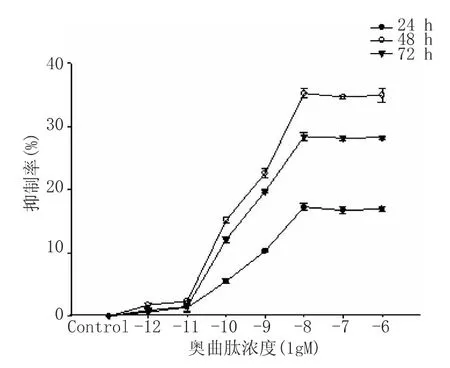
图1 奥曲肽对SW480细胞生长的抑制作用变化趋势图
2.2 奥曲肽对SW480细胞核中β-catenin蛋白的影响
通过 Western-blot法检测,浓度为 10-6M、10-8M、10-10M的奥曲肽作用结肠癌SW480细胞48 h后,与对照组比较,细胞核中β-catenin蛋白表达减少,印迹区带的灰度面积扫描值处理组与对照组有统计学意义,且各浓度组间亦有统计学意义(均P<0.01),见图2、3。
2.3 奥曲肽对SW480细胞核中TCF-4蛋白的影响
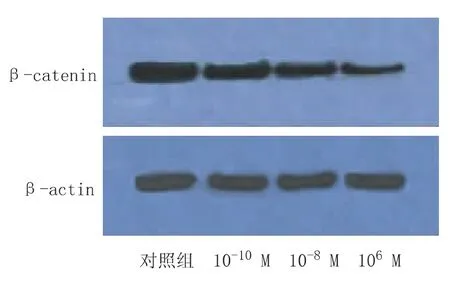
图2 奥曲肽对SW480细胞核内β-catenin
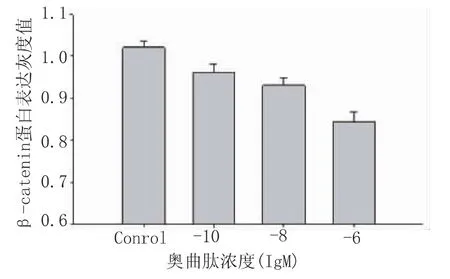
图3 奥曲肽对SW480细胞核内β-catenin蛋白表达的影响
通过Western-blot法检测浓度为10-6M 、10-8M、10-10M的奥曲肽作用SW480细胞48 h后,细胞核中TCF-4蛋白表达减少,印迹区带的灰度面积扫描值经统计学分析,处理组与对照组有统计学意义,各浓度组间亦有统计学意义(均P<0.01),见图4、5。

图4 奥曲肽对SW480细胞核内TCF-4
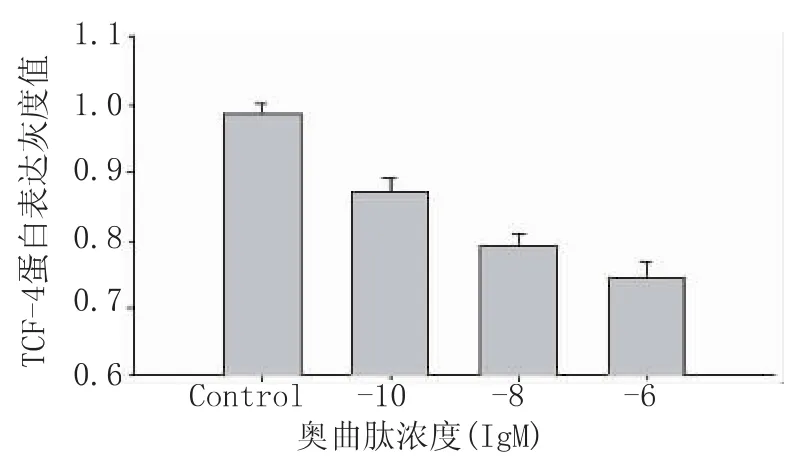
图5 奥曲肽对SW480细胞核内TCF-4蛋白表达的影响
2.4 奥曲肽对SW480细胞核中C-myc蛋白的影响
通过 Western-blot法检测浓度为 10-6M、10-8M、10-10M的奥曲肽作用SW480细胞48 h后,细胞核中C-myc蛋白表达减少,印迹区带的灰度面积扫描值经统计学分析显示,处理组与对照组有统计学意义,且各浓度组间亦有统计学意义(均P<0.01),见图 6、7。

图6 奥曲肽对SW480细胞核内C-myc
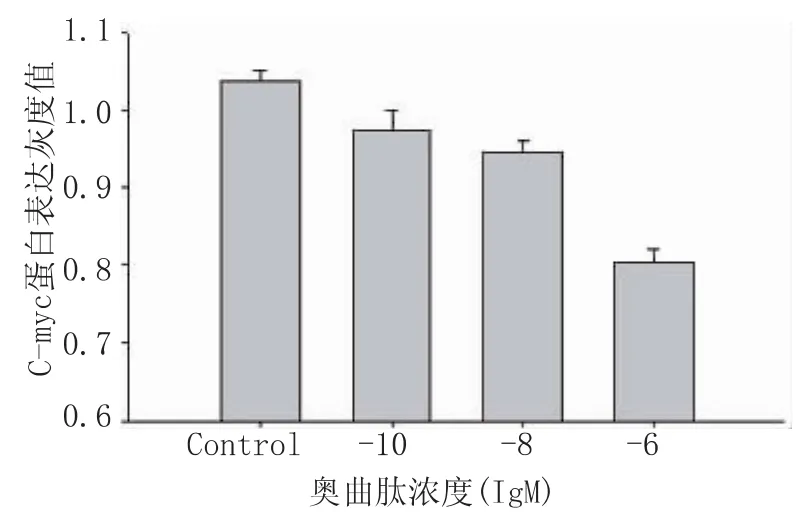
图7 奥曲肽对SW480细胞核内C-myc蛋白表达的影响
2.5 奥曲肽对SW480细胞核中CyclinD1蛋白的影响
通过 Western-blot法检测浓度为 10-6M、10-8M、10-10M的奥曲肽作用SW480细胞48 h后,细胞核中CyclinD1蛋白表达减少,印迹区带的灰度面积扫描值经统计学分析显示,处理组与对照组有统计学意义,且各浓度组间亦有统计学意义(均P<0.01),见图8、9。

图8 奥曲肽对SW480细胞核内CyclinD1
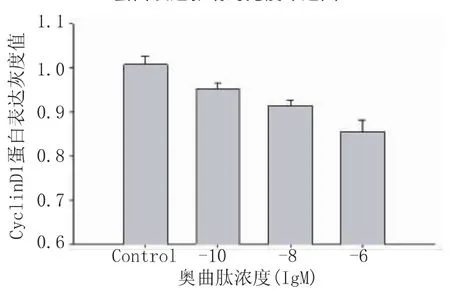
图9 奥曲肽对SW480细胞核内CyclinD1蛋白表达的影响
3 讨论
奥曲肽是一种人工合成的8肽生长抑素类似物,半衰期长,皮下注射半衰期可达2 h,且对内分泌的抑制作用较强,停药后不发生“反跳性高分泌”,因此其临床应用广泛。动物试验认为奥曲肽能降低化学致癌物诱导的结肠癌的发生率,并能抑制其发展[4]。临床研究发现晚期结肠癌患者通过应用奥曲肽治疗可明显缓解患者症状、提高其生活质量[5]。我们的前期工作也提示在体外条件下,奥曲肽可通过下调 Wnt/β-catenin通路而抑制结肠癌SW480 细胞[2-3]。
在本研究中,MTT法检测发现奥曲肽在10-10M以上能抑制人结肠癌SW480细胞的增殖,且在一定浓度范围(10-10M ~10-8M)呈现浓度依赖性,在10-8M时对SW480细胞的增殖抑制作用最强(约35%),与Dy等[6]的实验结果相近。奥曲肽浓度超过10-8M对结肠癌细胞的抑制作用不再随着浓度的增加而增强,考虑为奥曲肽通过与生长抑素受体结合而发挥抗肿瘤作用,而受体具有饱和特性。本研究发现奥曲肽作用在48 h内对SW480细胞的增殖抑制作用呈时间依赖性,但作用超过48 h后对结肠癌细胞增殖的抑制作用不再随着时间的延长而增强,考虑可能与奥曲肽在体外降解有关。
β-catenin是Wnt/β-catenin信号通路中的枢纽分子。在正常结肠细胞中,胞质β-catenin主要参与细胞骨架的调节,与E-cadherin及α-catenin结合形成复合体,作用与维持细胞间的黏附防止细胞转移有关,少部分游离的β-catenin在胞浆内被降解复合体磷酸化后由泛素蛋白酶体识别并降解,保持胞内β-catenin低水平状态,通路处于失活状态。而当WNT处于激活状态时(如结肠癌SW480细胞),由APC 蛋白、GSK-3β、Axin、β-catenin等形成的“降解复合体”受到抑制,使β-catenin不被GSK-3β磷酸化从而避免了泛素蛋白酶体对其识别和降解,进而在胞质中逐渐积聚;当β-catenin在胞浆中积聚到一定浓度时即向细胞核转移,并与胞核内的转录因子TCF4结合,导致下游靶基因的启动因子暴露而被激活(如C-myc、Cyclin-D1等),从而导致细胞异常增殖和凋亡抵抗[7]。本研究中检测了奥曲肽作用后的SW480细胞核内蛋白的表达,发现核内β-catenin、TCF-4蛋白表达水平是明显下降的,并且下游的靶基因CyclinD1和C-myc蛋白的表达也得到明显下降。结合前期工作,我们考虑奥曲肽在SW480细胞中抑制Wnt/β-catenin通路的机制为:在该通路上游(细胞质内)通过上调APC2、CK1α分子,重新聚合“降解复合体”,下调 β-catenin、TCF4,或减少β-catenin往细胞核内转移,从而减少 β-catenin-TCF4复合体形成,下游靶基因启动子激活受抑,最终使得C-myc、Cyclin-D1下降。
[1]陈琼,刘志才,程兰平,等.2003-2007年中国结直肠癌发病与死亡分析[J].中国肿瘤,2012,21(3):179-182.
[2]王松,包铮,龙建武,等.APC/β-catenin/TCF通路在奥曲肽调控结肠癌SW480中的分子机制[J].世界华人消化杂志,2010,18(36):3857-3862.
[3]Chen JS,Liang QM,Li HS,et al.Octreotide inhibits growth of colonic cancer SW480 cells by modulating the Wnt/β-catenin pathway[J].Pharmazie,2009,64(2):126-131.
[4]Watanabe H,Inoue Y,Uchida K,et al.Octreotide improved the quality of life in a child with malignant bowel obstruction caused by peritoneal dissemination of colon cancer[J].Pediatr Surg,2007,42(1):259-260.
[5]Gencosmanoglu R,Bugra D,Bulut T,et al.The inhibitory effect of octreotide on experimental colorectal carcinogenesis[J].Surg Today,2002,32(3):249-256.
[6]Dy DY,Whitehead RH,Morris DL.SMS 201.995 inhibits in vitro and invivo growth of human colon cancer[J].Cancer Res,1992,52(7):917-923.
[7]Gordon MD,Nusse R.Wnt signaling:multiple pathways,multiple receptors,and multiple transcription factors[J].J Biol Chem,2006,281(32):22429-22433.

